醇提水沉与水提醇沉对桉叶多酚提取物抗氧化活性的影响
2016-02-18谭荣威陈运娇
李 伟,汤 杰,谭荣威,曹 庸,陈运娇*
(1. 华南农业大学食品学院,广东 广州 510642;2.广东省天然活性物工程技术研究中心,广东 广州 510642)
醇提水沉与水提醇沉对桉叶多酚提取物抗氧化活性的影响
李 伟1,2,汤 杰1,2,谭荣威1,2,曹 庸1,2,陈运娇1,2*
(1. 华南农业大学食品学院,广东 广州 510642;2.广东省天然活性物工程技术研究中心,广东 广州 510642)
本文以氧化自由基吸收能力(ORAC)、DPPH自由基清除能力以及多酚含量为指标,探讨醇提水沉法、水提醇沉法对桉多酚提取物抗氧化性的影响。结果表明,醇提水沉法上清液组分ORAC值高于其沉淀组分,也高于水提醇沉法的沉淀组分和其上清液组分。醇提水沉上清液组分多酚含量以及清除DPPH自由基活性均强于其他组分。因此可得醇提水沉法优于水提醇沉法,这对桉多酚后期的分离纯化起到指导作用。
醇提水沉;水提醇沉;氧化自由基吸收能力(ORAC);DPPH自由基
桉树(Eucalyptus)具有生长快、经济价值高、抗病虫害能力强等特点,是世界性造林树种[1]。我国引进桉树已经有100多年历史,桉树人工林种植面积约450万hm2,广泛种植于华南、广西等地,每年桉树叶的产量为2000多万吨[2-4],除了少部分用来提取桉叶油之外,大部分被焚烧,导致环境污染。目前较多的研究主要集中在桉树种植、木材加工等方面,对于桉叶活性成分研究相对较少。
现有研究表明,桉叶中除含有挥发性芳香油以外,还含有大量黄酮类化合物、酰基间苯三酚衍生物、非挥发性萜类及其苷类、鞣质等活性物质[5]。同时,植物多酚因其具有较强的抗氧化性以及对氧自由基的清除能力而逐渐成为研究热点之一。多酚提取方法主要有溶剂浸提法、超声波提取法和微波提取法,不同提取方法提取出的物质有不同的活性成分。一种合理的提取方法能最大限度地提取出有效成分并且还有可能除去不相关的成分[6]。本实验采用溶剂提取法中醇提水沉法与水提醇沉法对桉多酚抗氧化活性影响进行比较研究,旨在选出最合理的提取方式,为后续分离纯化乃至生产打下基础。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂
实验所用的乙醇、过硫酸钾、三氯乙酸、铁氰化钾、Na2CO3、维生素C、磷酸氢二钠、磷酸二氢钠、H2O2、邻二氮菲、FeSO4、甲硫氨酸、核黄素为分析纯试剂,均在有效期内使用;DPPH•(2,2-二苯代苦味肼基)、福林-酚试剂,均为Sigma公司试剂。
1.1.2 仪器与设备
FW100型高速万能粉碎机:(天津市华鑫仪器厂);R204旋转蒸发器:(上海申生科技有限公司);FD-1型冷冻干燥机:(北京博医康技术公司);AL 104电子天平:(梅特勒-托利多仪器(上海)有限公司);KQ-500B型超声波清洗器:(昆山市超声仪器有限公司);pH计:(赛多利斯科学仪器(北京)有限公司);SH-D真空泵:(河南予华仪器有限公司);WZ-100恒温水浴锅:(上海申生科技有限公司);U-3010紫外可见分光光度计:(日本日立公司);MK-3酶标仪:(Thermo Labsystems 公司)。
1.1.3 实验材料
桉叶取自巨尾桉(E.grandis×E.uropnhlla)广林九号,采于广东湛江,自然阴干,粉碎。
1.2 实验设计与方法
1.2.1 实验设计
分别设计醇提水沉和水提醇沉两种提取方法对“广林九号”桉树叶进行提取和纯化,并对不同提取方法中所得粗提液、上清液和沉淀物组分进行多酚含量、抗氧化活性等分析测定。每个实验3组重复。
1.2.2 醇提水沉法与水提醇沉法纯化桉多酚工艺试验
夏循礼等[7]分别采用正交设计实验研究了提取溶剂浓度、提取次数、提取时间、溶剂用量以及醇沉溶剂浓度等对醇提水沉法和水提醇沉法提取杜仲(Eucommia ulmoides)叶活性成分的影响。本文在作者团队研究的基础上,结合文献进行方法优化,实验方法为:
醇提水沉法:桉叶粉2 g,以60%乙醇为提取溶剂,料液比1:25,常温下提取1 h后浓缩至无醇味,待冷却后高速离心得到上清液与沉淀,上清液与沉淀分别浓缩干燥得到干样备测。
水提醇沉法:桉叶粉5 g,以水为提取溶剂,料液比1:20,常温提取1 h后,浓缩至近干,加入90%乙醇沉淀,待冷却,高速离心得到上清液与沉淀,分别浓缩干燥后备测。
沉淀率按如下公式计算:
沉淀率=[沉淀质量/(沉淀质量+溶液中干物质质量)]*100%
1.2.3 分离各组分多酚含量测定
较为常用的植物多酚测定方法有:酒石酸亚铁比色法、福林-酚比色法等[8-9]。其中,福林-酚比色法是根据酚类化合物在碱性条件下可以将钨钼酸还原,生成蓝色的化合物,颜色的深浅与酚含量呈正相关,在760 nm波长下测吸光度。以没食子酸为标准品,测定样品的总多酚含量,参照凌关庭[8]所述多酚测定方法对桉叶总多酚进行测定。
标准曲线的绘制:准确称取真空干燥至恒重的没食子酸标准品44.3mg,用50%甲醇溶解并定容至100mL。以此溶液分别配成浓度为8.86、17.72、35.44、52.16、70.88和88.60 μg·mL-1的溶液。分别取上述不同浓度溶液 1mL加到10mL比色管中,然后依次加入1mL去离子水,0.5mL已稀释2倍的福林-酚试液,1.5mL 26.7% Na2CO3溶液,最后用水定容至10mL,室温下反应2 h,在760 nm下测定其吸光度。由吸光度对浓度进行回归分析,求得标准曲线。
试样测定:准确称取桉多酚粗提物、醇提水沉上清液组分、醇提水沉沉淀组分、水提醇沉上清液组分、水提醇沉沉淀组分各10mg,用50%甲醇溶解。取1mL样品加到10mL比色管中,依次加入去离子水1mL、福林-酚试液0.5mL、26.7% Na2CO3溶液1.5mL,然后用水定容至10mL,室温下反应2 h,在760 nm下测定其吸光度。测定的吸光度代入所得的标准曲线,求得试样中总多酚的含量,以没食子酸含量计。
1.2.4 分离各组分抗氧化活性指数(ORAC)
抗氧化活性指数(ORAC)参照文献[10-11]测定 。AAPH溶液的制备:精确称取AAPH 414.00mg,以磷酸盐缓冲液溶解并定容至10mL量瓶,即得浓度为153mmol·L-1的AAPH溶液。
FL溶液的制备:精确称取FL 40.00mg,以PH7.4的75mmol·L-1磷酸盐缓冲液溶解定容为25mL,制成4.25mmol·L-1的FL溶液,记为FL母液A。精确吸取FL 母液A 50 µL置50mL 量瓶中以上述缓冲液定容至刻度,得到4.25×10-3mmol·L-1溶液,记为FL母液B;FL母液A,B均于4℃冷藏。实验时精确吸取FL母液B 500 µL置25mL量瓶中,以上述缓冲液定容至刻度,即得8×10-3mmol·L-1的稀释液。
Trolox溶液的制备:精确称取Trolox 2.50mg,以甲醇溶解并定容至10mL量瓶,即得1mmol·L-1的Trolox溶液。实验时分别精确吸取Trolox甲醇溶液1000、800、600、400、200和100 µL于10mL量瓶中,pH 7.4的75mmol·L-1磷酸盐缓冲液定容,配成不同浓度Trolox溶液。
样品的制备:精确称取样品以甲醇适量溶解,配制成1000mg·L-1母液,继而以磷酸盐缓冲液稀释成10mg·L-1的样品溶液备测。
标准曲线的建立:精确吸取FL稀释液100 µL于96孔荧光板中,以激发波长490 nm,发射波长514 nm进行测定并记录荧光值(记为A0)。随后加入不同浓度Trolox溶液50 µL振荡3min,37℃温育10min后迅速加入AAPH 液50 µL启动反应。反应过程中每隔1.5min测定一次荧光值(记为Fn)。直至荧光值衰减至直线。按式(1)计算荧光衰退曲线下的面积(AUC)、式(2)计算保护面积(Net AUC),以Trolox溶液浓度为横坐标,以NetAUC为纵坐标,绘制标准曲线。

试样测定:分别称取桉多酚粗提物、醇提水沉上清液组分、醇提水沉沉淀组分、水提醇沉上清液组分、水提醇沉沉淀组分各10mg,用50%甲醇溶解并定容至10mL容量瓶中,摇匀。准确吸取各样品溶液100 μL加入10mL容量瓶中并用pH7.4磷酸盐缓冲液定容至刻度,摇匀,按上述方法测定不同样品ORAC值。
1.2.5 分离各组分清除DPPH自由基活性
参照文献[12-13]的方法,将桉多酚、醇提水沉上清液组分、醇提水沉沉淀组分、提水醇沉上清液组分、水提醇沉沉淀组分用50%甲醇配成0.1mg·mL-1浓度,取上述配好样品0.2mL 及1×10-4mol·L-1DPPH溶液3.8mL加入同一具塞试管中摇匀,在室温下密闭静置30min,用纯溶剂作参比,于517 nm波长下测定吸光度。根据式(3)计算每种提取液对DPPH自由基的清除率:

其中:As为加0.2mL提取液后DPPH溶液的吸光度;
Asb为0.2mL提取液+3.8mL溶剂(甲醇)后的吸光度;
Ac为0.2mL溶剂(甲醇)+3.8mL DPPH溶液的吸光度。
根据上述方法测定其清除率,根据回归方程求出清除率达50%时的样品浓度即IC50。
1.2.6 数据处理
实验数据采用Excel 2010与SPSS 18.0软件进行处理,采用单因素方差分析,实验数据以均数±标准误表示。
2 结果与分析
2.1 醇提水沉与水提醇沉法沉淀得率研究
多酚类物质引起具有较多的极性基团而带有较强的极性,可溶于水、乙醇、丙酮等亲水性有机溶剂。根据相似相溶的原理,醇提水沉与水提醇沉法利用的是乙醇与水之间的极性差异,从而进一步纯化抗氧化组分。由表1可以看出,醇提水沉法沉淀率明显高于水提醇沉法沉淀率。醇提水沉法与水提醇沉法均通过沉淀分离从而达到提高沉淀或者溶液部分中抗氧化物质含量的目的。综合分析,醇提水沉法采用的是60%浓度的乙醇溶液作为提取溶剂,溶液将桉叶中大量较弱的极性物质提取出来,因而水沉之后产生了28.4%的水不溶物;而桉叶中较弱极性物质含量多于不溶于90%乙醇的强极性物质,因而沉淀率较低,只有12.22%。袁春龙等[14]以70%乙醇做浸提剂对葡萄皮渣中的多酚物质进行浸提在优化工艺条件下多酚得率达80%左右。但作为食品添加剂或者功能食品的原材料则必须使用安全、无毒的提取溶剂,因而往往采用乙醇、水体系用于多酚提取。
2.2 分离各组分多酚含量分析
如图1所示,多酚含量的测定以没食子酸为标准品,绘制没食子酸浓度—吸光值标准曲线,多酚含量测定标准曲线以没食子酸浓度为横坐标,以反应体系760 nm波长下吸光值为纵坐标,并计算回归方程。

表1 醇提水沉法与水提醇沉法沉淀率
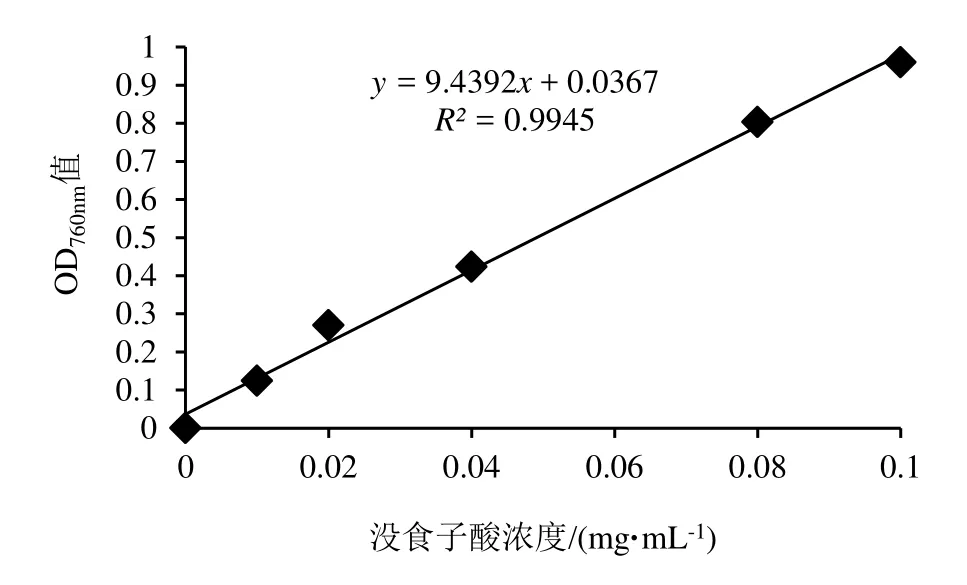
图1 多酚含量测定标准曲线

图2 分离得到的各组分总酚含量
通过测定不同样品反应后吸光值,结果如图2所示,实验结果显示桉叶粗提物多酚含量达41.9%,经醇提水沉后,上清液干燥物多酚含量增加至43.2%。而水提醇沉法,上清液干燥物多酚含量为42.0%,而其沉淀干燥物多酚含量显著低于其他各组分(P<0.05),为32.2%。本研究团队田宏[15]对桉多酚成分抗氧化活性进行了研究,结果表明:提取物中酚类物质的含量与抗氧化性成正相关,初步判断桉叶非挥发性成分其抗氧化活性的物质为多酚类。王俊亮等[16]研究表明,比较桉叶不同萃取物抗氧化能力与其总酚含量关系,总酚含量越多,抗氧化能力越强,其抗氧化能力与其总酚含量成正相关,因此桉叶中主要为多酚类物质起到抗氧化作用的功效。因此,相比于水提醇沉,醇提水沉后上清液干燥物多酚含量的增加有利于提高其抗氧化性。
2.3 分离各组分ORAC值变化
通过ORAC法评价醇提水沉法、水提醇沉法2种分离纯化方法制备上(上清液)、下(沉淀)组分的抗氧化活性,实验结果如图3所示:

图3 分离得到的各组分ORAC值
Osawa等[17]用硫氰酸盐和TBA研究了从蓝桉(E.globulus)中分到的正三十三烷-16,18-二酮、4-羟基三十三烷-16,18-二酮的抗氧化活性,结果表明在水-醇系中均具有明显的抗氧化活性,其活性高于维生素E和丁羟胺尼唑,而在油系中无抗氧化活性。由图3可以看出,醇提水沉与水提醇沉法均有一定的抗氧化组分纯化效果,本实验以正交优化后提取工艺桉叶粗提物为对照,分别比较了2种方法分离各组分抗氧化活性,醇提水沉法去除沉淀后上清液干物质ORAC值显著高于醇提水沉下层和水提醇沉下层(P<0.05)。而且水提醇沉法不论沉淀还是上清液干物质组分ORAC值均低于粗提物。
2.4 分离各组分清除DPPH自由基活性分析
根据评价抗氧化活性采用两种或两种以上方法的原则,采用DPPH法评价醇提水沉法与水提醇沉法各组分抗氧化活性,结果如图4:

图4 分离得到的各组分清除DPPH自由基活性
田玉红[18]采用DPPH自由基清除法分别评价了桉叶挥发性成分(油相成分和水溶性成分)的抗氧化性能。桉叶的水溶性挥发成分(IC50为0.46-3.15mg·mL-1)对DPPH自由基的清除作用比油相成分(IC50为0.74-26.96mg·mL-1)显著增强,分析是桉叶水溶性挥发成分中含有的酚类物质作用的结果。由图4可知,桉叶粗提物对DPPH自由基清除率达到33.1%,经醇提水沉后,上清液干燥物对DPPH自由基清除率上升至35.23%,而水提醇沉上清液干燥物、水提醇沉沉淀部分清除率均显著小于粗提物和醇提水沉上清液干燥物、水提醇沉沉淀部分(P<0.05)。
3 结论
通过研究比较醇提水沉和水提醇沉提取桉多酚对抗氧化活性的影响,以多酚含量、ORAC以及DPPH为指标,醇提水沉法提取后得到的多酚总量和抗氧化活性均高于水提醇沉法,得出醇提水沉法优于水提醇沉法。本研究提供了一种制备桉多酚的科学方法,为进一步优化其工艺以及后续分离纯化打下基础。
[1] 祁述雄.中国桉树(第2版)[M].北京:中国林业出版社, 2002.
[2] 何耀松,张继东.桉树化学成分及药理作用研究进展[J].动物医学进展,2007,28(7):98-101.
[3] 韦学丰,邓年方.桉树叶的开发利用[J].贺州学院学报, 2008,24(2): 133-136.
[4] 陈少雄,陈小菲.我国桉树经营的技术问题与思考[J].桉树科技,2013,30(3):52-59.
[5] 窦德强,陈荚杰.桉属植物的化学成分与生物活性[J].国外医药植物药分册,2003,18(2):51-58.
[6] 倪鹏.金荞麦提取物抗氧化、抗肿瘤作用研究[D].吉林:吉林大学,2008.
[7] 夏循礼,陈勇.醇提水沉与水提醇沉提取杜仲叶活性成分的比较研究[J].湖北大学学报:自然科学版,2003,25(3): 267-270.
[8] 凌关庭.抗氧化食品与健康[M].北京:化学工业出版社,2004.
[9] 曹炜,索志荣.Folin-Ciocalteu比色法测定蜂蜜中总酚酸的含量[J].食品与发酵工业,2003,29(12):80-82.
[10] 续洁琨,姚新生,栗原博.抗氧化能力指数(ORAC)测定原理及应用[J].中国药理学通报,2006,22(8):1015-1021.
[11] Ou B, Hampsch-Woodill M, Prior R L. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe [J].Journal of Agricultural and Food Chemistry,2001, 49(10):4619-4626.
[12] 刘微微,任虹,曹学丽,等.天然产物抗氧化活性体外评价方法研究进展[J].食品科学,2010,31(17):415-419.
[13] Kumaran A. Antioxidant and free radical scavenging activity of an aqueous extract of Coleus aromaticus [J]. Food Chemistry,2006,97(1):109-114.
[14] 袁春龙,任亚梅,梁艳英,等.醇溶法提取葡萄皮渣中的多酚物质[J].中国食品学报,2006,6(3):70-73.
[15] 田宏.尾巨桉叶抗氧化活性成分的研究[D].长沙:湖南农业大学,2009.
[16] 王俊亮,肖苏尧,陈运娇,等.广林9号桉叶多酚抗氧化活性研究[J].食品科学,2012,33(1):20-24.
[17] Osawa K, Yasuda H, Morita H,et al.Macrocarpals H, I, and J from the leaves of Eucalyptus globulus[J]. Journal of Natural Products,1996,59(9): 823-827.
[18] 田玉红.广西桉叶挥发性成分分析及抗菌抗氧化性能研究[D].南宁:广西大学,2006.
The Effect of Water-extraction and Alcohol-precipitation Method and Alcohol-extraction and Water-precipitation Method on the Antioxidant Activity ofEucalyptusPolyphenols
LI Wei1,2, TANG Jie1,2, TAN Rong-wei1,2, CAO Yong1,2, CHEN Yun-jiao1,2
(1.College of Food Science, South China Agricultural University,Guangzhou510642,Guangdong,China; 2.Guangdong Province Engineering Research Center for Bioactive Natural Products,Guangzhou510642,Guangdong,China)
In this study, we considered the oxygen radical absorbance capacity (ORAC) value, DPPH free radical scavenging activity and polyphenols content as indexes to compare the antioxidant activity of compounds obtained from eucalypt leaves by the water-extraction and alcohol-precipitationmethod (WEAP) to those obtained by the alcohol-extraction and water-precipitationmethod (AEWP). The results showed that the ORAC value of supernatant from AEWP was higher than those of the precipitation from AEWP, and higher than the supernatant and precipitation from WEAP. Similarly, the DPPH free radical scavenging activity and polyphenols content of supernatant from AEWP were highest among those four components. In conclusion, AEWP was better than WEAP, and it played a guiding role for purification ofEucalyptuspolyphenols.
alcohol-extraction and water-precipitationmethod; Water-extraction and alcohol-precipitationmethod; oxygen radical absorbance capacity; DPPH free radical
TQ463
A
广东省自然科学基金博士启动项目(2015A030310118);广东省自然科学基金自由申请项目(2016A030313394);广东省教育厅科研项目(平台)( 2013gjhz0003)
李伟(1991— ),男,在读硕士,主要从事天然活性物分离纯化研究.E-mail: 13535584901@163.com
*通讯作者:陈运娇(1984— ),女,讲师.E-mail: yunjiaochen@scau.edu.cn
