多重聚合酶链反应体系的建立及其在诊断急性胰腺炎继发感染中的应用价值▲
2016-02-17徐伟松倪润洲
徐伟松 倪润洲
(1 江苏省南通市第二人民医院消化内科,南通市 226002,E-mail:xws71@sina.com;2 南通大学附属医院消化内科,南通市 226001)
论著·临床研究
多重聚合酶链反应体系的建立及其在诊断急性胰腺炎继发感染中的应用价值▲
徐伟松1倪润洲2
(1 江苏省南通市第二人民医院消化内科,南通市 226002,E-mail:xws71@sina.com;2 南通大学附属医院消化内科,南通市 226001)
目的 建立多重聚合酶链反应(m-PCR)体系,并探讨其在诊断急性胰腺炎(AP)继发感染中的应用价值。方法 选取185例AP患者,轻症AP 140例,重症AP 45例。建立一种同时扩增9种肠道常驻菌特异性目的基因的m-PCR体系,于患者发病7~14 d内采用该技术检测患者外周血中9种肠道常驻菌的目的基因,诊断患者有无继发性细菌感染;同时抽取外周血或腹腔穿刺液进行培养,以培养结果为金标准,评价m-PCR对AP继发感染的诊断效能。结果 建立的m-PCR体系可同时检测9种肠道常驻致病菌。185例AP患者m-PCR诊断34例为重症胰腺炎患者继发感染,8例为轻症胰腺炎患者继发感染;培养法诊断26例为重症胰腺炎患者继发感染,5例为轻症胰腺炎患者继发感染。m-PCR诊断重症胰腺炎继发感染的灵敏性为92.3%,特异性为47.37%,阳性预测值70.59%,阴性预测值81.82%,准确度为73.33%;m-PCR检查轻症胰腺炎继发感染的灵敏性为80%,特异性为97.04%,阳性预测值50%,阴性预测值99.24%,准确度为96.43%。结论 m-PCR适用于监测重症胰腺炎患者继发细菌感染,该方法准确度高,方便快捷,可作为对重症胰腺炎患者继发细菌性感染的诊断方法。
急性胰腺炎;继发性感染;多重聚合酶链反应;诊断
急性胰腺炎(acute pancreatitis,AP)是临床常见的危重急症,肠道细菌移位造成的继发性感染是其患者死亡的最常见原因[1-2]。有研究表明,预防性静脉应用抗生素并不能降低重症AP患者继发感染的发生率[3]。目前诊断胰腺炎继发胰腺及胰腺周围感染的主要方法是血培养和超声或CT引导下取穿刺液培养[4]。多重聚合酶链式反应(multiplex polymerase chain reaction,m-PCR)是在常规PCR 基础上发展起来的一种新技术,其在同一个PCR反应体系中加入多对引物,分别扩增不同的目的基因。本研究建立一种同时扩增9种肠道常驻菌(金黄色葡萄球菌、表皮葡萄球菌、粪肠球菌、屎肠球菌、大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌病原菌)特异性目的基因的m-PCR体系,通过该技术检测AP患者血标本了解继发感染情况,以评价该技术用于诊断AP继发感染的价值。
1 资料与方法
1.1 临床资料 选取2011年1月至2015年10月期间南通市第二人民医院消化内科收治的AP患者185例,诊断符合《中国AP诊治指南(草案)》[5]中的相关标准,均处于继发感染高危期,病程>1周<2周。其中男性96例,女性89例,年龄42~92(59±10)岁;轻症AP140例,重症AP45例。于患者发病7~14 d内抽取外周血行血培养,腹腔渗出液较多的重症AP患者行CT引导下腹腔穿刺引流,并取穿刺液培养,以培养结果为诊断继发性感染的标准。
1.2 主要仪器与试剂 超净工作台(苏州净化设备公司),电子恒温水浴锅(上海精宏实验设备有限公司),Centrifuge台式高速离心机(德国Eppendorf公司),冷冻离心机(德国Eppendorf公司),PCR仪(美国ABI公司),DYY-6C电泳仪(北京六一仪器有限公司),电泳凝胶成像系统(上海BioSense公司),酶标仪(美国Bio-Rad公司),4℃冰箱(日本Sanyo公司),-80℃超低温冰箱(美国Thermo Fisher Scientific公司),旋涡振荡器XW-80A(上海青浦泸西仪器公司),移液器(Eppendorf公司)。质粒小抽试剂盒[天根生化科技(北京)有限公司,DP118140606],琼脂糖胶回收试剂盒[天根生化科技(北京)有限公司,GK2043-200],Taq DNA聚合酶/pfu DNA聚合酶(南通麦杰生物科技有限公司),脱氧核糖核苷三磷酸(deoxy-ribonucleotide triphosphate,dNTP;南通麦杰生物科技有限公司),琼脂糖(Sigma公司),DL2000 ladder(南通麦杰生物科技有限公司)。
1.3 m-PCR体系建立 (1)针对9种肠道常驻菌(金黄色葡萄球菌、表皮葡萄球菌、粪肠球菌、屎肠球菌、大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌病原菌)设计并筛选9对特异性引物,测序及引物合成均由生工生物工程(上海)股份有限公司完成,引物序列见表1。首先建立单重PCR检测体系,对标准菌株(根据GeneBank相关菌株基因编码构建而成,南通麦杰生物科技有限公司完成)目的基因DNA进行扩增,以10 ng/μl的鲑鱼精DNA为溶剂,梯度稀释细菌标准菌株基因组DNA至104、103、102、10个拷贝数,确定检测的特异性和灵敏度,并与测序验证对照判断其同源性,从而为建立一种同时扩增9种肠道常驻菌的m-PCR检测体系的建立奠定基础。(2)于患者发病7~14 d内抽外周血10 ml。行m-PCR检测。采用碱液加热裂解法对患者血标本提取革兰阳性菌和革兰阴性菌基因组DNA[6],经特异性引物扩增,分别采用针对3组细菌(第1组:金黄色葡萄球菌、粪肠球菌、嗜麦芽窄食单胞菌病原菌;第2组:屎肠球菌、肺炎克雷伯菌、铜绿假单胞菌;第3组:大肠埃希菌、表皮葡萄球菌、鲍曼不动杆菌)的三重实时荧光PCR行m-PCR,以获取特异性目的基因扩增产物。建立m-PCR反应体系,根据影响m-PCR的主要因素(引物浓度、dNTP浓度、Taq酶浓度、Mg2+浓度)优化反应条件,确定50 μl反应体系各组分的量如下:模板DNA各2 μl,上、下游引物(20 pmol/μl)各1 μl,10×PCR 缓冲液5 μl,4 μl dNTP(2.5 mmol/L),2 μl Mg2+(25 mmol/L),0.5 μl Taq 酶(5 U/μl),其余用灭菌ddH2O补足,总体积 50 μl。PCR 扩增条件:95℃预变性5 min,94℃变性45 s,54℃退火 40 s,72℃延伸45 s,共进行 35 个循环,最后72℃延伸10 min,4℃保存。感染阳性的标准以≥最低下限检测拷贝数为准,检测出1种以上常驻菌种阳性则诊断为继发感染。
1.4 统计学分析 应用SPSS 13.0软件进行统计学分析。以外周血液培养或腹腔穿刺液培养结果为继发感染的金标准,计算m-PCR法诊断胰腺炎继发感染的敏感度、特异度性、准确度、阳性预测值与阴性预测值等诊断效能指标。
2 结 果
2.1 9种细菌标准菌株目的基因PCR扩增产物 9种标准菌株目的基因经PCR扩增后均产生单一条带,产物大小与预期结果相符。见图1。
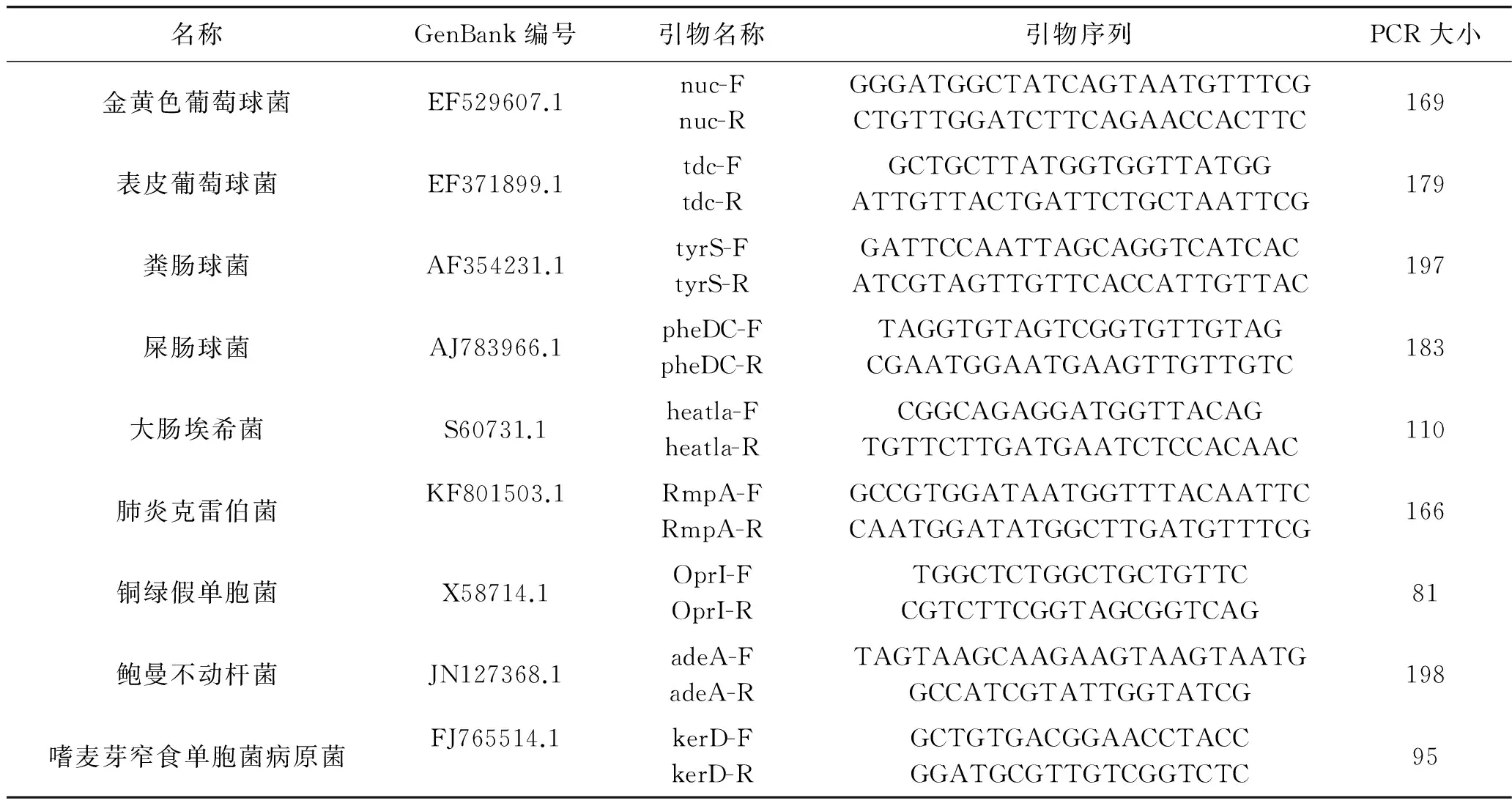
表1 9种肠道常驻菌特异性目的基因及所筛选的特异性引物

图1 9株细菌的PCR扩增产物
注:1为金黄色葡萄球菌(169 bp);2为表皮葡萄球菌(179 bp);3为粪肠球菌(197 bp);4为屎肠球菌(183 bp);5为大肠埃希菌(110 bp);6为肺炎克雷伯菌(166 bp);7为铜绿假单胞菌(81 bp);8为鲍曼不动杆菌(198 bp);9为嗜麦芽窄食单胞菌病原菌(95 bp);M为标志物DL2000。
2.2 9种细菌标准菌株目的基因PCR扩增的敏感性 9种细菌标准菌株目的基因PCR扩增后,灵敏度检测结果显示,大肠埃希菌的敏感性最高,检出的下限为10个拷贝,其次为肺炎克雷伯菌、表皮葡萄球菌、粪肠球菌、屎肠球菌、铜绿假单胞菌,检出下限为102个拷贝,再次为金黄色葡萄球菌、嗜麦芽窄食单胞菌病原菌、鲍曼不动杆菌,检出下限为103个拷贝。见图2。
2.3 患者血标本的细菌基因组DNA m-PCR扩增产物 提取患者血标本的革兰阳性菌和革兰阴性菌基因组DNA,并针对3组细菌的三重实时荧光PCR行m-PCR后,获得9个特异性目的基因扩增产物,见图3。
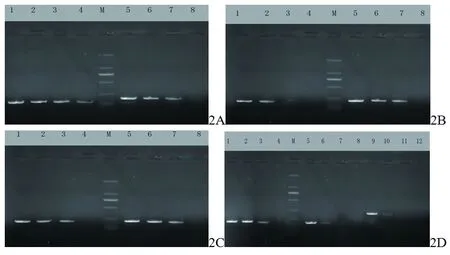
图2 9株细菌的梯度拷贝的PCR扩增
注:2A左为大肠埃希菌,2A右为肺炎克雷伯菌,2B左为金黄色葡萄球菌,2B右为表皮葡萄球菌,2C左为粪肠球菌,2C右为屎肠球菌,2D为铜绿假单胞菌(1~4)、嗜麦芽窄食单胞菌(5~8)、鲍曼不动杆菌(9~12)。
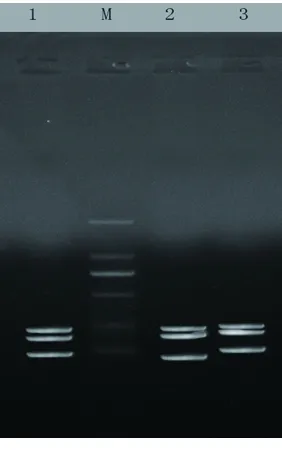
图3 9种肠道常驻菌m-PCR扩增产物电泳图
注:1:粪肠球菌(197 bp),金黄色葡萄球菌(169 bp),嗜麦芽窄食单胞菌病原菌(95 bp);2:屎肠球菌(183 bp),肺炎克雷伯菌(166 bp),铜绿假单胞菌(81 bp);3:鲍曼不动杆菌(198 bp),表皮葡萄球菌(179 bp),大肠埃希菌(110 bp);标志物:DL2000。
2.4 m-PCR法与培养法细菌检测结果比较 m-PCR法诊断34例重症胰腺炎患者继发感染,8例轻症胰腺炎患者继发感染;培养法诊断26例重症胰腺炎患者继发感染,5例轻症胰腺炎患者继发感染。以培养结果为金标准,m-PCR诊断重症胰腺炎继发感染的灵敏性为92.31%,特异性为47.37%,阳性预测值70.59%,阴性预测值81.82%,准确度为73.33%;以培养结果为金标准,m-PCR诊断轻症胰腺炎继发感染的灵敏性为80.00%,特异性为97.04%,阳性预测值50.00%,阴性预测值99.24%,准确度为96.43%;m-PCR法检测重症胰腺炎继发感染具有较高灵敏度。见表2、表3。

表2 m-PCR法与培养法细菌诊断 重症胰腺炎继发感染结果比较

表3 m-PCR法与培养法细菌诊断 轻症胰腺炎继发感染结果比较
3 讨 论
AP是以全身性炎症反应综合征为病理生理特征的急性全身性炎症性疾病,以局部脏器发病、全身多脏器功能受损为表现。胰腺的坏死呈不可逆、进行性发展,是消化系统最常见的危重急症,其致残率、病死率高,严重危害广大人民群众的身心健康。AP患者继发性感染细菌绝大多数来源于肠道细菌易位,通常称为“二次打击”。肠道细菌易位与内毒素血症可加重全身反应综合征、诱发多器官功能障碍综合征与多器官功能衰竭[7-8]。最近有学者报告部分急性坏死性胰腺炎患者的感染还未被发现其病情已出现恶化[9]。因此,如何早期诊断重症胰腺炎并发感染、指导应用抗生素、判断病情严重程度以及预后,是迫切需要解决的问题。
临床医生及时准确地诊断AP患者继发细菌感染具有一定的难度。对AP患者预防性使用抗生素存在巨大的争议,且效益成本比较低[10]。此外,滥用广谱抗生素会增加菌株耐药和二重感染的概率,增加患者经济负担,延长住院时间,增加病死率[11-13]。目前临床上通常采用的调节患者肠内营养状态、改善免疫力及置管引流等治疗方法,在一定程度上有利于缩短病程、减少并发症的发生[14-17]。目前,临床上对于AP患者继发细菌感染的诊断,更多的是基于症状、炎症性标记物、腹部CT等临床资料的综合判断[18-20]。有研究表明血清降钙素原作为一种评估细菌感染的炎症性标记物,已在AP并发感染及其他感染性疾病的诊断中广泛应用[21-22]。但是,最近有荟萃分析结果显示降钙素原在急诊科诊断细菌感染的敏感度为76%,特异度70%,具有中度的诊断价值;此外,在严重的烧伤、大型手术后,降钙素原在体内会暂时增加,导致了结果的假阳性[23]。单纯的症状体征和固有的生物标记物都不能对疾病作出全面精确地评估,探索更有临床价值的生物标记是近年来国内外学者的研究方向。临床工作中迫切需要探索和研究新的检测方法来判断重症胰腺炎患者是否存在继发性细菌感染,从而指导抗生素的合理应用。
m-PCR能够在提高通量的同时节省样品、降低成本,它需要优化dNTP、MgCl2、聚合酶和盐的浓度,一般来说,最多能在同一个管中同时检测到5个目标片段。本研究以“二次打击”学说为理论依据,根据前期研究方法,以肠道常驻致病菌为基础建立m-PCR方法[24],检测重症胰腺炎患者发病7~14 d内的外周血液标本或穿刺液标本。结果显示,以血培养或穿刺液培养结果为金标准,m-PCR诊断重症胰腺炎继发感染的灵敏性为92.3%,特异性为47.37%,阳性预测值70.59%,阴性预测值81.82%,准确度为73.33%;m-PCR诊断轻症胰腺炎继发感染的灵敏性为80.00%,特异性为97.04%,阳性预测值50.00%,阴性预测值99.24%,准确度为96.43%。其中m-PCR法诊断重症胰腺炎继发感染具有较高灵敏度,提示m-PCR技术对于诊断重症胰腺炎继发性感染有较好的临床价值,从而可指导临床抗生素的使用,缩短重症胰腺炎患者抗生素使用时间和住院天数,减少因抗生素过度使用导致的细菌耐药和二重感染的发生。本研究中,m-PCR对对轻症胰腺炎的继发感染的诊断敏感性稍低,但其特异性、准确度较高,这可能与轻症AP继发感染的发生率较低、真阴性个体数绝对值高有关,同时也与本研究样本量较少有关。
总之,AP患者存在肠道细菌移位是患者继发感染的主要感染源,在早期阶段通过干预如肠内营养,可对重症胰腺炎患者全身炎症反应综合征、多器官功能障碍综合征等并发症的发生发展起到一定的延迟和缓解作用,从而改善重症胰腺炎预后。m-PCR对于诊断重症胰腺炎并发细菌感染性具有较高的应用价值,对于准确评估患者感染状态具有重要的指导意义。
[1] 曹 锋,李 非.再论重症急性胰腺炎感染及预防性抗生素的合理应用[J].肝胆胰外科杂志,2011,23(1):77-79.
[2] 郭子皓,郝建宇.重症急性胰腺炎中抗生素的合理应用[J].中华消化杂志,2012,32(9):585-587.
[3] Wittau M,Mayer B,Scheele J,et al.Systematic review and meta-analysis of antibiotic prophylaxis in severe acute pancreatitis[J].Scand J Gastroenterol,2011,46(3):261-270.
[4] 万大平,刘栋云.螺旋CT扫描诊断重症急性胰腺炎合并感染的影像学意义[J].检验医学与临床,2014,11(14):2 000-2 001.
[5] 中华医学会消化病学分会胰腺疾病学组.中国急性胰腺炎诊治指南(草案)[J].中华内科杂志,2005,24(3):190-192.
[6] 余道军,童文娟,陈岳明,等.临床标本细菌基因组DNA提取方法探讨[J].中国微生态学杂志,2007,19(6):519-520,523.
[7] 孙 燕,杨兴菊,段红伟,等.重症急性胰腺炎患者腹腔感染的危险因素分析[J].中华医院感染学杂志,2014,24(5):1 217-1 219.
[8] 刘路培,刘明祥,罗 毅.重症胰腺炎患者感染的临床分析[J].中华医院感染学杂志,2015,25(17):4 000-4 002.
[9] Besselink M.Case on necrotizing acute pancreatitis:“infection is not found but patient is becoming worse” [M]//Cuesta MA,Bonjer HJ.Case studies of postoperative complications after digestive surgery.New York:Springer,2014:247-250.
[10]陶福正,陈仁辉,陈英姿,等.重症急性胰腺炎腹腔感染不同抗菌药物治疗方案的成本-疗效分析[J].中华医院感染学杂志,2015,25(9):2 004-2 006.
[11]王春友,赵玉沛.重视重症急性胰腺炎多学科综合治疗[J].中国实用外科学杂志,2012,32(7):517-519.
[12]雷若庆,王庆刚,张中文,等.基于全面考虑制定急性胰腺炎胰腺坏死感染与脓肿防治的整体方案[J].肝胆外科杂志,2012,20(2):150-151.
[13]李斌杰,赵二鹏,郑 云,等.重症急性胰腺炎并发胰腺感染的危险因素分析及防治措施[J].中国中西医结合外科杂志,2014,20(2):111-113.
[14]江明万,于 双,王晴雷.置管引流应用于重症急性胰腺炎继发腹腔感染的临床研究[J].中华医院感染学杂志,2015,25(5):1 119-1 121.
[15]沈绚丽,杨建锋,楼立兰.经皮穿刺腹腔置管引流治疗重症急性胰腺炎并发腹腔感染的效果分析[J].中华医院感染学杂志,2014,24(6):1 491-1 493.
[16]冯业晨,秦仁义.重症急性胰腺炎坏死并感染的外科手术治疗[J].国际外科学杂志,2015,42(6):371-372.
[17]高红梅,姚俊利,路玲,等.急性胃肠损伤分级在重症监护病房患者早期肠内营养支持中应用的临床研究[J].中华危重病急救医学,2014,26(4):214-218.
[18]梁新文,徐星莉,徐星榕.炎性指标联合检测诊断急性胰腺炎继发感染的价值[J].中华医院感染学杂志,2015,25(4):750-752.
[19]张绍云,王云慧,夏红强.重症急性胰腺炎感染期CD4+T淋巴细胞内三磷酸腺苷的表达及意义[J].中华医院感染学杂志,2015,25(4):738-740.
[20]吴礼文,李锋华,钱 进,等.CT 诊断感染性重症急性胰腺炎临床分析[J].广州医科大学学报,2015(3):90-92.
[21]罗裕锋,瞿 嵘,梁小仲.降钙素原动态监测在指导重症急性胰腺炎抗菌治疗中的意义[J].广西医学,2015(5):643-645.
[22]Fazili T,Endy T,Javaid W,et al.Role of procalcitonin in guiding antibiotic therapy[J].Am J Health Syst Pharm,2012,69(23):2 057-2 061.
[23]Markanday A.Acute phase reactants in infections:evidence-based review and a guide for clinicians[J].Open Forum Infect Dis,2015,2(3):ofv098.
[24]范 辉,徐伟松,刘玉峰,等.多重聚合酶链技术诊断重症急性胰腺炎继发感染的临床价值[J].中华胰腺病杂志,2015,15(5):310-314.
Establishment of a multiplex polymerase chain reaction system and its application value for diagnosis of infection secondary to acute pancreatitis
XUWei-song1,NIRun-zhou2
(1DepartmentofGastroenterology,theSecondPeople′sHospitalofNantong,Nantong226002,China;2DepartmentofGastroenterology,AffiliatedHospitalofNantongUniversity,Nantong226001,China)
Objective To establish a multiplex polymerase chain reaction(m-PCR),and to explore the application value of m-PCR for the diagnosis of infection secondary to acute pancreatitis(AP).Methods A total of 185 patients with AP were enrolled including 140 with mild acute pancreatitis(MAP) and 45 with severe acute pancreatitis(SAP).A m-PCR system specifically amplifying the target genes of 9 intestinal resident floras was established.Then the target genes of 9 intestinal resident floras in the peripheral blood were detected in all patients within 7-14 days of onset for diagnosis of secondary bacterial infection.The peripheral blood or puncture liquid of abdominal cavity was obtained for culture.The diagnostic efficacy of m-PCR for infection secondary to AP was assessed on the basis of golden criteria of culture result.Results The established m-PCR system could detect 9 intestinal resident floras at the same time.Thirty-four patients with SAP and 8 patients with MAP were diagnosed as secondary infection by m-PCR method.Twenty-six patients with SAP and 5 patients with MAP were diagnosed as secondary infection by culture method.The sensitivity,specificity,positive predictive value,negative predictive value and accuracy of m-PCR method for infection secondary to SAP were 92.3%,47.37%,70.59%,81.82% and 73.33% respectively.The sensitivity,specificity,positive predictive value,negative predictive value and accuracy of m-PCR method on the basis of culture result for infection secondary to MAP were 80%,97.04%,50%,99.24% and 96.43% respectively.Conclusion m-PCR is applicable for monitoring the secondary bacterial infection in patients with SAP.This method is accurate and convenient,and can be an approach for the diagnosis of secondary bacterial infection in patients with SAP.
Acute pancreatitis,Secondary infection,Multiplex polymerase chain reaction,Culture
江苏省南通市科技局社会事业科技创新与示范项目(HS13937)
徐伟松(1971~),男,本科,主任医师,研究方向:肝胰疾病基础与临床。
倪润洲(1957~),男,博士,主任医师、教授,研究方向:消化系疾病,E-mail:13951315559@163.com。
R 576.1
A
0253-4304(2016)11-1492-05
10.11675/j.issn.0253-4304.2016.11.04
2016-05-31
2016-08-07)
