心率变异性评价阵发性房颤患者自主神经功能状态▲
2016-02-17平海芹周三凤
邱 爽 杨 波 平海芹 周三凤 王 慧
(武汉大学人民医院心血管内科,武汉市 430060,E-mail:771297988@qq.com)
论著·临床研究
心率变异性评价阵发性房颤患者自主神经功能状态▲
邱 爽 杨 波 平海芹 周三凤 王 慧
(武汉大学人民医院心血管内科,武汉市 430060,E-mail:771297988@qq.com)
目的 通过心率变异性评价阵发性心房颤动患者自主神经功能状态。方法 阵发性心房颤动患者64例(心房颤动组)和健康体检者71例(对照组)均进行24 h动态心电图检查,记录两组心率变异性指标,包括时域分析指标连续24 h窦性RR间期的标准差(SDNN)、24 h内每5 min一段正常RR间期标准差的平均值(SDANN)、相邻RR间期差值的均方根(rMSSD)、RR间期序列中相邻RR间期差值大于50 ms的个数占所有RR间期个数的百分比(pNN50)以及频域分析指标高频成分(HF)、低频成分(LF)、高频与低频成分比值(HF/LF)。结果 心房颤动组24 h心率及总心搏数、SDANN、rMSSD、pNN50、HF、LF均显著高于对照组(P<0.05)。结论 阵发性房颤患者合并自主神经功能紊乱。
阵发性心房颤动;心率变异性;自主神经功能;24小时动态心电图
心房颤动是临床常见的心律失常,其患病率随年龄的增长而升高,50~59岁人群的发病率为0.5%,而80~89岁的发病率约为9%[1]。Haïssaguerre等[2]通过研究发现肺静脉与房颤的发生相关,这一研究结果具有重要意义,然而,在肺静脉中冲动起始的机制仍没有被阐明。有证据显示,肺静脉由自主神经支配[2-3]。动物实验中刺激迷走神经可缩短心房有效不应期及心房激动的波长,并增加心房有效不应期(atrial effective refractory period,AERP)的离散度,而进一步有关诱发房颤发生的研究表明肺静脉局灶性房颤的发生主要依赖于发作前迷走神经张力的增高[3]。心脏的自主性受损会导致夜间迷走神经张力降低,使交感神经在夜间活性增强,易发生不良心血管事件[4]。自主神经包括了交感神经及副交感神经,已有研究表明自主神经功能状态与房颤的发生、维持、复发及终止均密切相关[5]。心率变异性(heart rate variability,HRV)分析是可定性、定量评估自主神经功能的无创性检测方法,可反映自主神经对窦房结自律性的影响,因此被认为是评价心脏自主神经功能的理想指标。本研究主要通过24 h动态心电图分析HRV指标,探讨阵发性房颤患者与健康正常人HRV的差异从而评价阵发性房颤患者自主神经功能状态。
1 资料与方法
1.1 临床资料 选择2014 年1月至2015年8月在我院心内科住院的阵发性心房颤动患者64例(心房颤动组),纳入标准:符合2012年欧洲心脏病学会心房颤动治疗指南[6]中的阵发性房颤诊断标准。排除甲状腺功能亢进、严重感染、发热、精神障碍、起搏器植入术、合并室速、室颤、高度传导阻滞及持续性房颤的患者;排除电极脱落,记录时间过短及资料不全的患者。心房颤动组中合并高血压病史30例,合并冠心病史19例,合并扩张性心肌病史2例,合并肥厚型心肌病史1例。另71例健康体检者为对照组。两组的性别、年龄、体质指数比较,差异均无统计学意义(P>0.05),具有可比性。见表1。
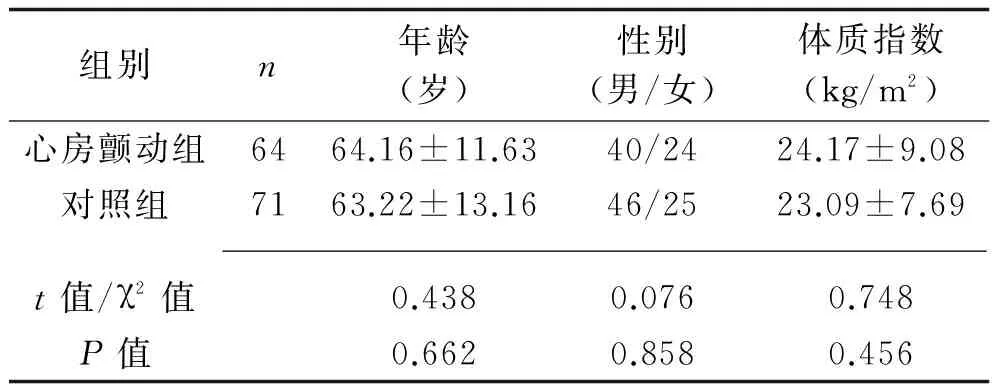
表1 两组临床资料比较(x±s)
1.2 24 h动态心电图检查及观察指标 动态心电图采用美国Mortara公司H-Scribe分析系统,所有研究对象均行24 h长程12通道心电图记录,经人工干预分析出正确的数据。记录24 h平均心率、总心搏数及心率变异性指标,HRV指标包括时域分析指标连续24 h窦性RR间期的标准差(standard deviation of all normal sinus RR intervals,SDNN)、24 h内每5 min一段正常RR间期标准差的平均值(standard deviation of the average normal sinus RR intervals for all 5-minute segments,SDANN)、相邻RR间期差值的均方根(root mean square of successive differences in normal-to-normal RR intervals,rMSSD)、RR间期序列中相邻RR间期差值大于50 ms的个数占所有RR间期个数的百分比(percentage of the difference between adjacent RR intervals greater than 50 ms,pNN50)以及频域分析指标高频成分(high frequency,HF)、 低频成分(low frequency,LF)、高频成分和低频成分的比值(HF/LF)。
1.3 统计学分析 采用SPSS 17.0软件进行统计学分析。服从正态分布的计量资料以(x±s)表示,两组之间比较用独立样本t检验;计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者心率及总心搏数比较 心房颤动组24 h平均心率及总心搏数均高于对照组(P<0.05)。见表2。

表2 两组患者心率及总心搏数比较(x±s)
2.2 两组HRV时域分析指标的比较 心房颤动组SDNN低于对照组,但差异无统计学意义(P>0.05)。心房颤动组SDANN、rMSSD及pNN50均高于对照组(P<0.05)。见表3。
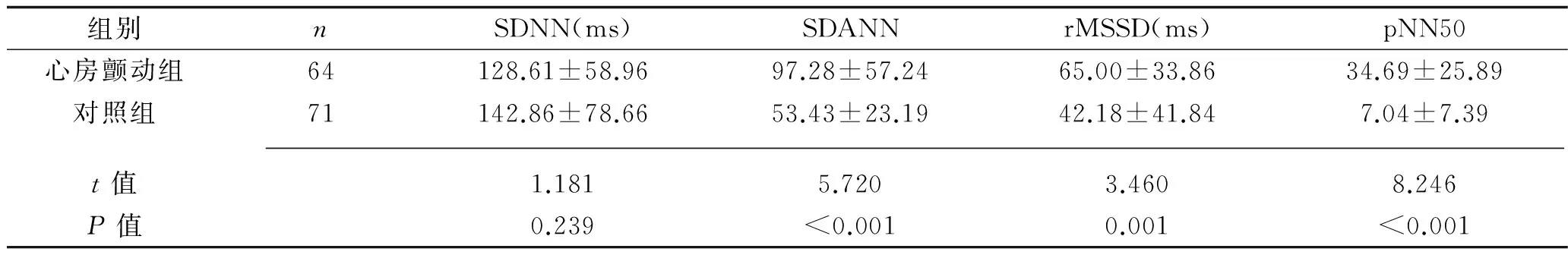
表3 两组HRV时域分析指标比较(x±s)
2.3 两组HRV频域分析指标 心房颤动组LF及HF高于对照组(P<0.05);心房颤动组LF/HF高于对照组,但差异无统计学意义(P>0.05)。见表4。
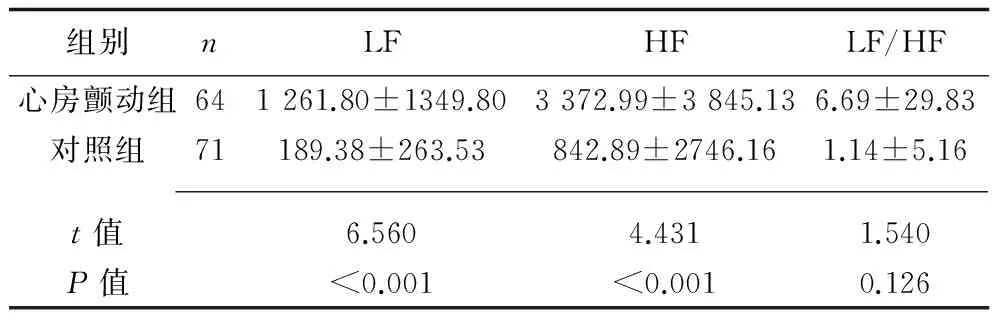
表4 两组HRV频域分析指标比较(x±s)
3 讨 论
HRV指标包括时域分析指标SDNN、SDANN、rMSSD、pNN50,以及频域分析指标HF、LF、HF/LF。HRV的各项评价指标有如下临床意义:(1)SDNN可反映心脏自主神经总张力大小以及心脏自主神经系统对心血管的整体调节,用于评价自主神经系统受损与恢复的总体程度。SDANN即24 h内每5 min一段窦性RR间期标准差的平均值。(2)rMSSD用于评价HRV短周期成分的指标,主要反映心-迷走神经张力以及迷走神经对心血管的调节功能。(3)pNN50可反映RR间期的瞬时变化,较敏感反映迷走神经的活动,代表了心脏迷走神经对心率的调节。(4)LF(低频谱能量0.04~0.15 HZ)多被认为与交感神经活动相关,而HF(高频谱能量0.15~0.4 HZ)反映迷走神经的张力,受呼吸活动影响。LF/HF比值反映交感神经和迷走神经张力的平衡状态。
本研究发现,阵发性房颤患者心率变异性时域分析指标SDANN、rMSSD、pNN50及频域分析指标HF、LF显著高于对照组(P<0.05),而两组SDNN及LF/HF指标无统计学意义(P>0.05),可能与本研究样本量较小有关。陈则君等[7]报告持续性房颤患者24 h心率变异性指标明显增高,而顾永伟等[8]报告阵发性房颤患者24 h心率变异性较健康对照组显著增高,与本研究结果基本一致,这表明房颤患者的HRV高于正常人。而HRV指标是反映自主功能对窦房结影响的间接测量指标,HRV改变是心脏自主神经功能紊乱最早信号,可反映心脏自主神经平衡功能状态。因此,提示阵发性房颤患者合并自主神经功能紊乱。
自主神经功能状态与阵发性房颤密切相关,迷走神经功能亢进时,窦房结细胞兴奋性降低,心房肌细胞自律性降低、传导性减低、不应期缩短,导致房性心律失常的发生[9-10]。心房颤动是心脏激动的起源、频率、节律、传导速度和传导顺序等的异常,自主神经系统活性的变化可以在房颤的发生中起重要作用。Coumel[11]提出自主神经张力与房颤的关系,首次将迷走神经和交感神经功能与房颤联系起来,并认为“迷走神经房颤”通常发生在没有结构性心脏病的年轻男性患者,往往发生在餐后和夜间,而“肾上腺素能房颤”通常是由身体或情绪压力引发,并经常出现在器质性心脏病患者中。Bissinger等[5]的研究表明自主神经病变影响房颤可能通过影响房间传导导致窦性冲动不均匀传播。自主神经系统的内在组成部分是由轴突和自主神经节(神经丛)嵌入位于心房和心室上的心外膜脂肪垫形成的网络[12]。神经节丛的一个重要组成部分位于靠近左心房肺静脉交界处,这个地区有丰富的自主神经支配。Scherlag等[13]的研究表明,刺激这个位置上的神经丛可以把肺静脉中的病灶活动转化为房颤。有学者推测,消除神经节丛,特别是在肺静脉心房交界处,可以提高房颤消融成功率[10]。Zimmermann等[14]发现患者起源于肺静脉局灶性异位冲动,导致持续发作的房颤主要依赖于自主神经张力的变化,在房颤的发生时明显转向迷走神经占优势。
综上所述,阵发性房颤患者合并自主神经功能紊乱,而消融自主神经系统在肺静脉心房交界处神经节丛,可提高房颤消融成功率,这为今后房颤消融术提供了新的方法。然而本研究纳入病例数较少,为单中心回顾性研究,且HRV指标受影响因素较多,评价自主神经功能状态特异性较弱,临床应用有一定局限性,在需要进一步的大样本、多中心、前瞻性研究,以阐明自主神经系统功能紊乱在阵发性房颤发生、发展及维持中的作用。
[1] Koide Y,Yotsukura M,Ando H,et al.Usefulness of P-wave dispersion in standard twelve-lead electrocardiography to predict transition from paroxysmal to persistent atrial fibrillation[J].Am J Cardiol,2008,102(5):573-577.
[2] Haïssaguerre M,Jaïs P,Shah DC,et al.Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins[J].N Engl J Med,1998,339(10):659-666.
[3] 杨永丽.房性心律失常心率变异性研究[D].济南:山东大学,2012.
[5] Bissinger A,Grycewicz T,Grabowicz W,et al.The effect of diabetic autonomic neuropathy on P-wave duration,dispersion and atrial fibrillation[J].Arch Med Sci,2011,7(5):806-812.
[6] 马长生.2012年欧洲心脏病学会心房颤动治疗指南更新解读[J].中国循环杂志,2013,27(z1):6-11.
[7] 陈则君.持续性心房颤动患者心率变异性分析[J].临床医学,2011,31(5):57-58.
[8] 顾永伟,王 晞,陈 葵,等.阵发性心房颤动的心率变异性分析[J].心血管康复医学杂志,2008,17(3):289-290.
[9] Huang CX,Zhao QY,Jiang H,et al.Experimental study of the vagus nerve on atrial electrical remodeling [J].J Electrocardiol,2003,36(4):295-300.
[10]Pappone C,Santinelli V,Manguso F,et al.Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation[J].Circulation,2004,109(3):327-334.
[11]Coumel P.Paroxysmal atrial fibrillation:role of autonomic nervous system[J].Arch Mal Coeur Vaiss,1994,87(3):55-62.
[12]Wit AL,Boyden PA.Triggered activity and atrial fibrillation[J].Heart Rhythm,2007,4(3 Suppl):S17-23.
[13]Scherlag BJ,Yamanashi W,Patel U,et al.Autonomically induced conversion of pulmonary vein focal firing into atrial fibrillation[J].J Am Coll Cardiol,2005,45(11):1 878-1 886.
[14]Zimmermann M,Kalusche D.Fluctuation in autonomic tone is a major determinant of sustained atrial arrhythmias in patients with focal ectopy originating from the pulmonary veins[J].J Cardiovasc Electrophysiol,2001,12(3):285-291.
Assessment of autonomic nervous function by heart rate variability in patients with paroxysmal atrial fibrillation
QIUShuang,YANGBo,PINGHai-qin,ZHOUSan-feng,WANGHui
(DepartmentofCardiology,RenminHospitalofWuhanUniversity,Wuhan430060,China)
Objective To assess the autonomic nervous function by heart rate variability in patients with paroxysmal atrial fibrillation.Methods A total of 64 patients with paroxysmal atrial fibrillation(AF group) and 71 healthy individuals(control group) underwent 24-hour dynamic electrocardiogram.The heart rate variability indices were recorded,including standard deviation of all normal sinus RR intervals(SDNN) within continuous 24 hours,standard deviation of the average normal sinus RR intervals for all 5-minute segments(SDANN) within 24 hours,root mean square of successive differences in normal-to-normal RR intervals(rMSSD),percentage of successive normal sinus RR intervals greater than 50 ms for the entire recording(pNN50) as well as frequency domain analysis of high frequency(HF),low frequency(LF) and HF/LF.Results The mean heart rate and total stroke for 24 hours in the AF group were more than those in the control group(P<0.05).The SDANN,rMSSD,pNN50,LF and HF in the AF group were significantly higher than those in the control group(P<0.05).Conclusion The patients with paroxysmal atrial fibrillation are complicated with autonomic nervous dysfunction. 【Key words】 Paroxysmal atrial fibrillation,Heart rate variability,Autonomic nervous function,24-hour dynamic electrocardiogram
湖北省基金重点项目(2014CFA061)
邱爽(1990~),女,在读硕士研究生,研究方向:心律失常的临床与研究。
杨波(1963~),男,博士,教授,研究方向:心律失常;E-mail:yybb112@whu.edu.cn。
R 541.7
A
0253-4304(2016)01-0023-03
10.11675/j.issn.0253-4304.2016.01.07
2015-11-01
2015-12-25)
