气管切开插管大鼠肺组织病理及肺泡灌洗液肺泡表面活性物质相关蛋白A浓度的变化情况▲
2016-02-17黄文川潘宇政黄李平张冉令朱翠香
黄文川 潘宇政 黄李平 张冉令 朱翠香
(广西医科大学第一附属医院中医科,南宁市 530021,E-mail:460755039@qq.com)
论著·基础研究
气管切开插管大鼠肺组织病理及肺泡灌洗液肺泡表面活性物质相关蛋白A浓度的变化情况▲
黄文川 潘宇政 黄李平 张冉令 朱翠香
(广西医科大学第一附属医院中医科,南宁市 530021,E-mail:460755039@qq.com)
目的 探讨气管切开插管大鼠肺组织病理及肺泡灌洗液肺泡表面活性物质相关蛋白A(SP-A)的变化情况。方法 将36只雄性SD大鼠采用随机数字表法分为空白对照组(A组)18只、气管切开插管模型组(B组)18只。于建立模型后24 h、72 h、168 h分别取各组大鼠6只,并取右肺组织行病理切片检查,进行Smith评分评估肺组织损伤情况;取左肺肺泡灌洗液检测SP-A浓度。结果 肺组织病理结果显示B组大鼠在建模后24 h、72 h、168 h均有不同程度的水肿、肺泡及间质炎症、出血、肺不张等肺组织损伤,各时间点Smith评分均明显高于A组(P<0.05),并随着时间的延长而增高(P<0.05)。B组大鼠肺泡灌洗液SP-A浓度在各时间点均明显高于A组(P<0.05),且随气管切开插管时间的延长而降低(P<0.05)。结论 气管切开插管可导致水肿、肺泡炎症、出血、肺不张等肺组织损伤及肺部固有免疫功能紊乱,SP-A有保护肺组织作用,气管切开插管早期SP-A代偿性增高,随后逐渐下降。
气管切开插管;肺组织;Smith评分;表面活性物质相关蛋白A;肺泡灌洗液;肺部感染;大鼠
气管切开插管紧急建立人工气道是治疗通气障碍、呼吸衰竭最有效的方法之一,为重型颅脑损伤、昏迷等急危重症常用的抢救手段。患者气管切开插管后,极易并发肺部感染,而肺部感染直接影响疾病的预后与进程。何国厚等[1]通过对132例气管切开患者进行回顾性分析后发现,肺部感染的发生率达63.64%(84/132)。另一项研究显示,气管切开患者的肺部感染率达79.49%(62/78),其中45例发生在气管切开后3~10 d,有2例直接死于肺部感染[2]。而有学者报告气管切开插管后肺部感染率高达100%[3]。因此,防治肺部感染对气管切开插管患者的治疗具有重要意义。气管切开后发生肺部感染的机制为气管切开插管后气道受损,呼吸道开放与外界直接相通,失去了鼻腔和口咽部湿化、加温及防御作用,各种病原体大量侵入所致[4]。近年来有学者发现气管切开后并发肺部感染亦与免疫功能紊乱有关。虽然气管切开插管在临床应用已久,但少有相关实验研究对气管切开插管引起的肺部病理及固有免疫变化进行分析。本实验通过建立大鼠气管切开插管模型,并在3个不同时间点取肺组织行病理检查及取肺泡灌洗液检测肺组织固有免疫因子肺泡表面活性物质相关蛋白A(surfactant-associated protein A,SP-A)浓度,为正确认识气管切开插管引起的病理及固有免疫改变提供参考,为气管切开插管并发症的临床防治提供参考。
1 材料与方法
1.1 实验动物 雄性SD大鼠36只,10周龄,质量250~300 g,购于广西医科大学实验动物中心[合格证号:SCXK(桂)2014-0002],实验前自由进水进食。采用随机数字表法分为A组(空白对照组)、B组(气管切开插管组),每组18只。
1.2 主要仪器与试剂 高速冷冻离心机(长沙英泰仪器有限公司,型号:英泰TDL5M)、数控超级恒温箱(宁波新芝生物科技股份公司,型号:宁波新芝sc-15)、Multiskan FC型酶标仪(赛默飞世尔仪器有限公司)、显微镜(Leica公司,型号:DMil)、移液枪(Eppendorf公司,规格:0.1~2.5 μl、0.5~10 μl、20~200 μl、100~1 000 μl、multi 12-channel 10~100 μl);SP-A酶联免疫吸附试剂盒(武汉优尔生商贸有限公司,批号:L150616441)、多聚甲醛(天津博迪化工股份有限公司,产品标准号:津Q/HG 3076-99)。
1.3 动物模型制备 B组大鼠术前禁食12 h,自由饮水。术前称体重后,麻醉前给予阿托品0.02 mg/kg肌肉注射,30 min后3%戊巴比妥钠30 mg/kg腹腔肌肉注射麻醉。待大鼠完全麻醉后,取仰卧位固定于动物手术操作台上,上切牙套线固定,充分暴露颈部。于颈前正中环状软骨下缘,下至胸骨上窝,剃除颈部鼠毛,医用碘伏消毒。纵行剪开大鼠颈部皮肤、皮下组织、筋膜,于白线处钝性分离各肌层至暴露白色的气管,暴露气管,如见甲状腺峡部可钝性分离并向上提起,用血管钳游离出气管。在气管上作一小倒“V”型切口后,将一次性硬膜外导管(斜面端)顺气管方向准确插入气管中一定深度(2~3 cm),切口外导管留20 cm,并绑线固定气管插管,缝合手术切口,碘伏消毒;用医用防水胶布将留在切口外的气管导管绕在大鼠脖颈一圈,固定,将多余的导管剪掉,保留1 cm于胶布外,以于机械通气。A组不做特殊处理,自由进食饮水。
1.4 取材 于造模后24 h、72 h、168 h每组分别取6只大鼠进行取材。采用3%戊巴比妥钠于腹部肌肉注射麻醉,麻醉完全后予仰卧位固定取材。取材时结扎并取右肺组织,用冰冻生理盐水进行冲洗以除去血液,置入4%多聚甲醛液中固定,过夜后送至广西医科大学实验中心制作病理切片。于左肺取肺泡灌洗液,用5 ml冰冻灭菌生理盐水灌洗,反复灌洗3次,回收3 ml左右;上述过程重复3次,共回收9 ml。4℃下2 400 r/min离心10 min,取上清,置于-20℃保存。
1.5 病理切片 观察采用苏木精-伊红(hematoxylin-eosin,HE)染色,用显微镜观察制好的肺组织病理切片,采用Smith评分方法[5]对肺水肿、肺泡及间质炎症、肺泡及间质出血、肺不张和透明膜形成分别进行半定量评分:无损伤0分,病变范围<25%为1分,病变范围25%~50%为2分,50%<病变范围≤75%为3分,病变范围>75%为4分,总肺损伤评分为上述各项之和。观察10个高倍镜视野,取其平均值。由两位病理科医师分别评分后取平均分。
1.6 测定SP-A 用SP-A酶联免疫吸附试剂盒检测SP-A浓度,按照试剂盒说明书进行操作:(1)实验前准备标准品、试剂及样品;(2)加样(标准品及样本)100 μl,37℃孵育2 h;(3)吸弃,加检测液A 100 μl,37℃孵育1 h;(3)洗板3次;(4)加检测液B 100 μl,37℃孵育30 min;(5)洗板5次;(6)加3,3,5,5-四甲基联苯胺底物溶液90 μl,37℃孵育20 min;(7)加终止液50 μl,立即用酶标仪检测450 nm A值;(8)绘制标准曲线,计算出样本浓度。
1.7 统计学分析 应用SPSS 16.0软件进行统计学分析,计量资料以(x±s)表示,比较采用t检验,多组均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组的肺组织Smith评分肺组织病理切片 B组大鼠在3个时段均存在不同程度的水肿、肺泡及间质炎症、出血、肺泡破坏等肺组织损伤,各时间点Smith评分均高于A组大鼠(P<0.05)。在24 h、72 h、168 h 3个时间点,B组大鼠Smith评分随着观察时间延长而增高(P<0.05)。见图1、图2及表1。

表1 两组不同时间点的肺组织Smith评分比较(x±s,分)
注:*B组内各时间点两两比较,P<0.05。

图1 A组肺组织光镜下表现( HE染色,×200)

图2 B组肺组织光镜下表现( HE染色,×200)
2.2 两组的SP-A比较 B组大鼠肺泡灌洗液SP-A浓度在3个时间点均明显高于A组(P<0.05)。B组大鼠SP-A浓度以24 h浓度最高,168 h最低,呈随气管切开插管时间的延长而不断降低的趋势(P<0.05)。见表2。
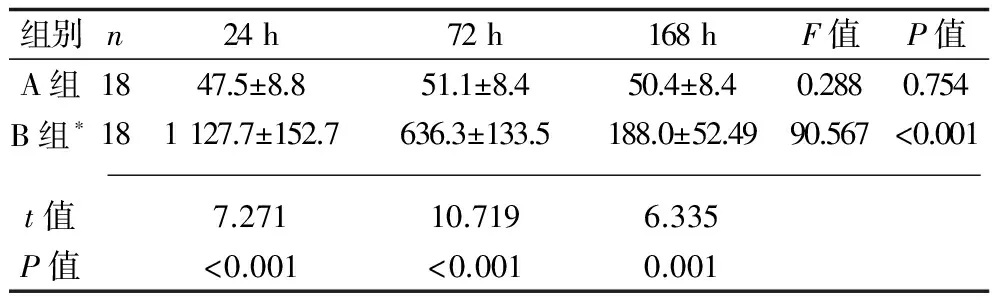
表2 两组不同时点SP-A浓度(x±s,pg/ml)
注:*B组内各时间点两两比较,P<0.05。
3 讨 论
气管切开插管能够及时解除患者的呼吸道梗阻,从而改善脑组织的缺氧,减轻脑水肿的发生,提高脑功能的恢复效果。早期进行气管切开可以降低格拉斯哥评分较低的脑外科患者与气管和支气管相关的并发症发生率[6]。由于实施气管切开后将患者正常呼吸道的解剖结构破坏,气体将不经过鼻内加温、湿化等处理直接进入下呼吸道,导致下呼吸道的水分丢失增多,受到一定的刺激,最终使患者发生咳嗽能力减弱、气道分泌物排出不畅、肺表面活性物质遭到破坏而发生肺部感染、缺氧加重等一系列并发症[7-8],严重影响患者的治疗效果及预后。因此气管切开插管是存在明显利弊的急救措施,故要严格把握气管切开的适应证,同时需进一步探索气管切开插管本身对机体的影响及其机制,以指导临床治疗。
气管切开插管极可能导致呼吸系统的某些病理改变,但在临床治疗中因主客观条件限制无法进行肺组织的病理检查,因此临床上对气管切开插管引起的病理改变的认识受到了很大限制。本研究结果显示,气管切开插管可引起大鼠肺泡破坏、炎症浸润、出血、水肿等病理损伤,且在24 h、72 h、168 h 3个时间点,Smith评分随着观察时间延长而增高(P<0.05),提示这种损伤随着气管切开插管时间的延长而逐步加重,这说明气管切开插管导致肺组织损伤,这种损伤与气管切开留置插管时间呈正相关。因此,临床上在应用气管切开插管时为避免或减轻肺组织损伤,应设法保护肺组织,防治炎症、出血、水肿等。
肺泡表面活性物质是由肺泡Ⅱ型上皮细胞合成和分泌的脂质和蛋白复合物,能减少肺气液界面表面张力,提高肺泡稳定性和防止呼气相肺泡塌陷[9]。SP-A是最早被发现的在肺泡Ⅱ型上皮细胞中高表达、信号最为丰富的蛋白质,它是肺表面活性物质的重要组分之一,占肺表面活性物质总量的50%以上,是肺部的固有免疫因子[10]。它在调节磷脂代谢及局部免疫防御方面意义重大,是反映Ⅱ型细胞功能的早期指标,也是判断患者肺损伤程度和预后的指标[11]。SP-A缺失或表达水平过低容易导致细菌和病毒感染[12]。本实验结果显示,气管切开插管大鼠肺泡灌洗液SP-A浓度明显高于正常大鼠(P<0.05),以24 h浓度最高,168 h最低,呈随气管切开插管时间的延长而浓度不断降低的趋势(P<0.05)。考虑与气道开放后固有免疫因子代偿性增多,随着不断消耗而逐渐下降有关。随着SP-A浓度的下降,肺组织炎症不断加重。这表明,SP-A能抑制气管切开插管后肺部炎症、出血等损伤,具有保护肺组织的作用;但随着气管切开留置插管时间的延长,SP-A浓度逐渐降低,对肺组织的保护功能逐渐下降。
综上所述,气管切开插管是为了抢救危重患者而采取的急救措施,但其本身亦可引发肺组织损伤,这种损伤程度与气管切开插管时间有关。SP-A具有保护肺组织作用。故临床上我们要严格掌握气管切开插管的适应证,在应用气管切开插管时要设法采取措施防治肺组织损伤,调节SP-A浓度。将来可能在气管切开插管后期使用人工合成的SP-A制剂,以增强肺部对细菌和病毒的抵抗力、降低感染率从而改善患者预后。
[1] 何国厚,符湘云,王恵芳,等.气管切开并发肺部感染相关危险因素的Logistic回归分析[J].中国感染控制杂志,2012,11(3):186-188,191.
[2] 周 雅.颅脑损伤气管切开肺部感染的护理干预对策[J].实用临床医药杂志,2011,15(8):52-53,56.
[3] 杜忠胜.重型颅脑损伤患者气管切开术后下呼吸道感染的防治[J].滨州医学院学报,2006,29(1):21-23.
[4] 张秀丽.气管切开患者ICU内肺部感染分析与护理对策[J].中国实用医药,2014,9(23):215-217.
[5] Smith KM,Mrozek JD,Simonton SC,et al.Prolonged partial liquid ventilation using conventional and high-frequency ventilatory techniques:gas exchange and lung pathology in an animal model of respiratory distress syndrome[J].Crit Care Med,1997,25(11):1 888-1 897.
[6] 石 柳.36例重型颅脑损伤患者行复杂气管切开术的预后分析[J].实用医院临床杂志,2014,11(4):159-161.
[7] 王 剑.重症监护室危重病人气管切开肺部感染的危险因素及对策[J].护理研究,2014,28(15):1 873-1 874.
[8] 杨 磊.重症监护室危重病人气管切开肺部感染分析及护理[J].全科护理,2013,11(9):805-806.
[9] 刘 钢,宋耀宗,于 晨,等.股骨干骨折合并脑损伤后大鼠肺脏炎性介质与SP-A变化的实验研究[J].医学综述,2014,20(7):1 280-1 282.
[10]Schicht M,Knipping S,Hirt R.et al.Detection of surfactant proteins A,B,C,and D in human nasal mucosa and their regulation in chronic rhinosinusitis with polyps[J].Am J Rhinol Allergy,2013,27(1):24-29.
[11]周佳磊,徐冬新,李 仪,等.TNF-α、SP-A在儿童不同程度肺炎中的表达和临床意义[J].中国现代医生,2014,52(18):145-147.
[12]Sano H,Kuroki Y.The lung collectins,SP-A and SP-D,modulate pulmonary innate immunity[J].Mol Immunol,2005,42(3):279-287.
Changes of lung tissue pathology and bronchoalveolar lavage fluid concentration of surfactant-associated protein A in rats with tracheostomy tube
HUANGWen-chuan,PANYu-zheng,HUANGLi-ping,ZHANGRan-ling,ZHUCui-xiang
(DepartmentofTraditionalChineseMedicine,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To explore the changes of lung tissue pathology and the bronchoalveolar lavage fluid(BALF) concentrations of surfactant-associated protein A(SP-A) in rats with tracheostomy tube.Methods Thirty-six male SD rats were divided into blank control group(Group A,n=18) and tracheostomy tube model group(Group B,n=18).Six rats were selected in each group at 24,72 and 168 hours after modeling separately.Then the right lung tissues were taken out for the pathological examination,and the Smith score was used to evaluate the injury of lung tissue.The BALF of left lung was collected for detecting the concentration of SP-A.Results The results of lung tissue pathology showed that the lung tissue injuries including edema,alveolar and interstitial inflammation,alveolar and interstitial hemorrhage,and atelectasis with different degrees existed in the rats of Group B at 24,72 and 168 hours after modeling.The Smith score of Group B was higher than that of Group A at each time point(P<0.05),and increased with the increase of observation time(P<0.05).The BALF concentration of SP-A in Group B was significantly higher than that in Group A at each time point(P<0.05),and decreased with the increase of tracheostomy tube time(P<0.05).Conclusion Tracheostomy tube might lead to lung tissue injuries including edema,alveolar and interstitial inflammation,alveolar and interstitial hemorrhage,atelectasis,and also lead to the disorder of pulmonary innate immune function.And SP-A owns a protective function for lung tissue.The level of SP-A has a compensatory increase in the early stage of tracheostomy tube and then gradually decreases.
Tracheostomy tube,Lung tissue,Smith score,Surfactant-associated protein A,Bronchoalveolar lavage fluid,Pulmonary infection,Rat
国家自然科学基金(81460687);广西壮族自治区卫生厅中医药科技专项(GZPT13-36)
黄文川(1989~),男,在读硕士研究生,研究方向:脑病及肺病。
潘宇政(1961~),男,硕士,副教授,研究方向:脑病及肺病,E-mail:pyz79298@sina.com。
通信作者:黄李平(1956~),女,硕士,教授,研究方向:脑病及肺病,E-mail:hlp65836@163.com。
R 653.1
A
0253-4304(2016)04-0449-04
10.11675/j.issn.0253-4304.2016.04.01
2015-12-22
2016-03-03)
