山竹果皮提取物对人肝癌细胞HepG2增殖及凋亡的影响▲
2016-02-17赖燕燕黄应雯黄丹玚伍兰岚罗彬尤李晓龙
赖燕燕 黄应雯 黄丹玚 伍兰岚 罗彬尤 李晓龙
(1 广西卫生职业技术学院细胞生物学与遗传学教研室,南宁市 530021,E-mail:yanyanlai630@outlook.com;2 广西中医药大学第一附院医院办公室,南宁市 530021;3 广西医科大学,南宁市 530021)
论著·基础研究
山竹果皮提取物对人肝癌细胞HepG2增殖及凋亡的影响▲
赖燕燕1黄应雯2黄丹玚3伍兰岚3罗彬尤3李晓龙3
(1 广西卫生职业技术学院细胞生物学与遗传学教研室,南宁市 530021,E-mail:yanyanlai630@outlook.com;2 广西中医药大学第一附院医院办公室,南宁市 530021;3 广西医科大学,南宁市 530021)
目的 探讨山竹提取物对人肝癌细胞HepG2增殖及凋亡的影响及其作用机制。方法 采用MTT法检测不同浓度山竹提取物对HepG2细胞增殖的影响;分别应用Annexin-V/PI双重染色、PI单染法检测山竹提取物对HepG2凋亡和细胞周期的影响;天冬氨酸特异性半胱氨酸蛋白酶-3(Caspase-3)试剂盒检测山竹提取物对HepG2细胞Caspase-3酶活化的影响。结果 不同浓度(100 μmol/L、200 μmol/L、400 μmol/L、600 μmol/L、800 μmol/L)山竹提取物均可抑制人肝癌细胞HepG2的增殖活性,且随着山竹提取物浓度及其作用时间的增加,细胞抑制率升高(P<0.05);山竹提取物浓度为256.67 μmol/L时可诱导人肝癌细胞HepG2出现早期凋亡,并且随着山竹提取物作用时间的增加,凋亡早期癌细胞的比率增高。细胞周期分析结果显示随着山竹提取物的浓度升高(0 μmol/L、200 μmol/L、400 μmol/L、600 μmol/L、800 μmol/L),G1期HepG2细胞比例升高,而S期细胞比例下降(P<0.05)。与对照组(0 μmol/L)比较,各浓度(200 μmol/L、400 μmol/L、600 μmol/L、800 μmol/L)山竹提取物组HepG2细胞的Caspase-3酶活性均升高(P<0.05),给药组的酶活力单位随给药浓度的增加而明显增加(P<0.05)。结论 山竹提取物对人肝癌细胞HepG2有抑制增殖和促进凋亡的作用,其作用机制可能与抑制HepG2细胞进入S期和激活Caspase-3有关。
肝癌;人肝癌细胞HepG2;山竹提取物;增殖;凋亡;细胞周期;天冬氨酸特异性半胱氨酸蛋白酶-3
肝癌在我国常见肿瘤中位居第2位,仅次于肺癌[1],而我国是全球肝癌发病率最高的国家,其发病率比西方国家高10倍以上。据统计,目前我国肝癌发病人数占全球发病人数的55%,而死亡的人数约占全世界肝癌死亡人数的45%[2]。手术切除是目前治疗早期肝癌唯一有效的方法,但大多数患者就诊时已为中晚期,手术疗效有限,因而寻找新的治疗方法尤为重要。在天然药物中寻找具有调控细胞增殖、凋亡的化合物单体或前体化合物,是目前国内外抗肿瘤药物研发的热点。
山竹又称山竹子、莽吉柿或凤果,是藤黄科藤黄属常绿乔木山竹的果实。山竹果皮性凉,味苦、涩,是泰国、缅甸、印度等东南亚国家的传统医药,山竹果皮研为细末内服,被广泛用于治疗腹痛、腹泻、痢疾、感染性创伤、化脓、慢性溃疡等疾病[3-4];外敷可起到消炎止痛的作用,用于治疗皮肤病,水、火烫伤尤为显效[5]。山竹果壳含有多种氧杂蒽酮衍生物,主要包括山竹提取物(75%~85%)和γ-倒捻子素(5%~15%),其药理作用成为了近年来的研究热点。近期有研究表明这些氧杂蒽酮表现出抗炎、抗肿瘤、抗氧化等多种生物活性,对多种细菌具有抗菌作用[6]。有学者通过研究发现山竹果皮提取物具有抗菌活性、细胞和生物毒性、酶抑制活性、抗病毒活性、杀伤癌细胞等作用[5,7-12]。但山竹提取物对肝癌HepG2细胞的作用及抗肿瘤机制目前尚未见报道。本研究通过探讨山竹提取物其对肝癌HepG2 细胞的作用及其可能的抗肿瘤机制,为进一步研究山竹提取物的药用价值以及其抗肿瘤作用提供参考。
1 材料与方法
1.1 材料与仪器 山竹果皮粉由广西中医药大学第一附属医院提供,人肝癌细胞HepG2由广西医科大学实验中提供;HyClone DMEM/高糖培养基[赛默飞世尔生物化学制品(北京)有限公司,批号:NXM0766],胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化液(北京索莱宝科技有限公司,批号:T1300-100),磷酸缓冲盐溶液(phosphate-buffered saline,PBS;武汉博士德生物工程有限公司,批号:AR0030),四甲基偶氮唑盐(methylthiazolyl tetrazolium,MTT)细胞增殖及细胞毒性检测试剂盒(碧云天生物技术研究所,批号:C0009),二甲基亚砜(dimethyl sulfoxide,DMSO;Amresco公司,批号:302A031),四季青无支原体胎牛血清(L浙江天杭生物科技有限公司,批号:130407),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(L联科生物科技有限公司,批号:2100512),细胞周期与细胞凋亡检测试剂盒(碧云天生物技术研究所,批号:C1052),天冬氨酸特异性半胱氨酸蛋白酶-3(cysteine-containing aspartate-specific proteases-3,Caspase-3)活性检测试剂盒(碧云天生物技术研究所,批号:C1115);酶标仪(Tecan.公司,型号:Sunrise),流式细胞仪(BD公司,型号:InfluxTM),显微镜(Olympus公司,型号:IX-51),台式离心机(Eppendorf公司,型号:5424)。
1.2 实验方法
1.2.1 山竹提取物的制备:取50 g的山竹果皮干燥粉末,溶于500 ml的85%乙醇,过夜(16 h),过滤取上清液;旋蒸至10 ml,用乙酸乙酯萃取,取上清液;过硅胶柱,用正己烷和乙酸乙酯(5 ∶1)洗脱;得到的液体烘干,用DMSO溶解,置于-20℃冰箱冷冻保存备用[13]。
1.2.2 细胞培养:对肝癌HepG2细胞进行体外培养,基础培养基为HyClone DMEM/高糖培养液,加入无支原体胎牛血清配置成含10%无支原体胎牛血清的培养液,在37℃、5% CO2、饱和湿度培养箱中培养,取对数生长期细胞用于实验。
1.2.3 MTT法检测山竹提取物对HepG2细胞的生长抑制作用:取对数生长期的HepG2细胞,调整细胞悬液浓度至1×105个/ml,接种于96孔板中,每孔100 μl,在37℃、5% CO2、饱和湿度培养箱中培养24 h,细胞贴壁后[14],药物处理组加入用培养液稀释的山竹提取物,使终浓度分别为100 μmol/L、200 μmol/L、400 μmol/L、600 μmol/L、800 μmol/L,每孔总量100 μl。同时设置阴性对照组(含有细胞的培养基、MTT溶液,不含药物)和空白对照组(含PBS及MTT溶液,不含药物)。各个药物处理组及阴性对照组每组设6个复孔。继续培养24 h、48 h、72 h后,每孔加入1 mg/ml MTT溶液20 μl,37℃孵育4 h后弃培养基,每孔加入150 μl DMSO振荡10 min,使结晶物充分溶解。用酶联免疫检测仪于490 nm波长处测定吸光度值(A值)。按下列公式计算抑制率:肿瘤细胞抑制率(%)=(药物处理组A 490 nm-空白组A 490 nm)/(阴性对照组A 490 nm-空白组A 490 nm)×100%。
1.2.4 Annexin V-PI 法检测山竹提取物对HepG2细胞凋亡的影响:取对数生长期的HepG2细胞,调整细胞悬液浓度1×106个/ml,每孔加入2 ml,均匀铺在6孔板中,在37℃、5% CO2、饱和湿度培养箱中培养48 h后,加入用培养液将山竹提取物稀释至256.67 μmol/L(即IC50浓度),每孔2 ml,分别培养0 h、24 h、48 h及72 h;将6 孔板中的各处理组HepG2细胞用0.25%胰蛋白酶-EDTA消化液消化,1 000 r/min离心5 min后 收集细胞; 用PBS 洗涤细胞2次(1 000 r/min,10 min),收集细胞;加入500 μl的结合缓冲液,吹打悬浮细胞; 加入5 μl Annexin V-FITC 混匀后,加入10 μl碘化丙啶(propidium iodide,PI),混匀;在室温、避光的条件下孵育5 min;在1 h内采用流式细胞仪进行检测细胞凋亡情况[15]。
1.2.5 PI单染法检测山竹提取物对细胞周期的影响:收集对数期HepG2细胞,调整细胞悬液浓度1×106个/ml,每孔加入2 ml,均匀铺在6孔板;5% CO2、37℃细胞培养箱内孵育,至细胞单层铺满孔底,小心吸去培养液,加入用培养液稀释的不同浓度梯度的山竹提取物(0 μmol/L、200 μmol/L、400 μmol/L、600 μmol/L、800 μmol/L),每孔2 ml,复孔6个,培养24 h;消化收集细胞(同Annexin V-PI法),用PBS洗1次(1 000 r/min,4 min),用100 μl PBS重悬,滴入预冷的75%乙醇400 μl,固定过夜(16 h)。离心弃液,用PBS洗1次(1 000 r/min,4 min),用400 μl PBS重悬细胞,加入PI染色液10 μl[碘化丙啶染色液配法:染色缓冲液3 ml+碘化丙啶染色液(20x)150 μl+RNase A(L50x)60 μl],室温黑暗孵育10 min,1 h内上机检测细胞周期。
1.2.6 Caspase-3的活性检测:收集对数期HepG2细胞,调整细胞悬液浓度1×106个/ml,每孔加入3 ml,均匀铺在6孔板;5% CO2、37℃细胞培养箱内孵育,至细胞单层铺满孔底,小心吸去培养液,加入用培养液稀释的不同浓度梯度的山竹提取物(200 μmol/L、400 μmol/L、600 μmol/L、800 μmol/L),每孔2 ml,复孔6个,培养24 h;消化收集细胞,用PBS洗1次(1 000 r/min,4 min),按每200万细胞加入100 μl裂解液,重悬细胞,冰浴裂解15 min,16 000~20 000 g/min离心15 min,转移上清液至冰浴预冷的试管;空白对照组(90 μl检测缓冲液+10 μl Ac-DEVD-pNA),样品组(80 μl检测缓冲液+10 μl Ac-DEVD-pNA+10 μl待测样品),37℃孵育2 h,颜色变化明显后上酶标仪机检测样品中Caspase 3催化产生的pNA产生的吸光度。
1.3 统计学分析 采用SPSS 17.0进行统计分析,计量资料以(x±s)表示,多组间均数比较采用单因素方差分析,组间两两比较采用q检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 山竹提取物对HepG2细胞的增殖抑制作用 不同浓度药物处理组分别培养24 h、48 h,72 h后,山竹提取物对HepG2细胞的增殖均具有抑制作用,且随着山竹提取物浓度和作用时间的增加,细胞抑制率升高(P<0.05);山竹提取物对HepG2细胞的生长有量-效、时-效关系。见表1。24 h、48 h、72 h的IC50值分别为294.90 μmol/L、256.67 μmol/L、178.59 μmol/L。
2.2 Annexin V-FITC/PI双染法检测细胞凋亡的结果 在双变量流式细胞仪的散点图上,左下象限是活细胞,为(FITC+/PI+);右上象限是非活细胞,即坏死细胞,为(FITC-/PI+);而右下象限为凋亡细胞,显现(FITC+/I-)在HepG2细胞组中,提示山竹提取物可引起肝癌细胞HepG2的凋亡。见图1。加入用培养液稀释至浓度为256.67 μmol/L(IC50浓度)的山竹提取物后,肝癌细胞HepG2出现明显早期凋亡;在0 h、24 h、48 h、72 h早期细胞凋亡率分别为0.05%、11.63%、55.98%、73.38%,随着山竹提取物作用时间的增加凋亡早期癌细胞的比率显著增高。

表1 不同浓度山竹提取物作用下HepG2细胞生长抑制率的比较(x±s,%)
注:相同时间点下不同浓度组间两两比较,*P<0.05;相同浓度下不同时间点两组间两两比较,●P<0.05。

A 0 h

B 24 h
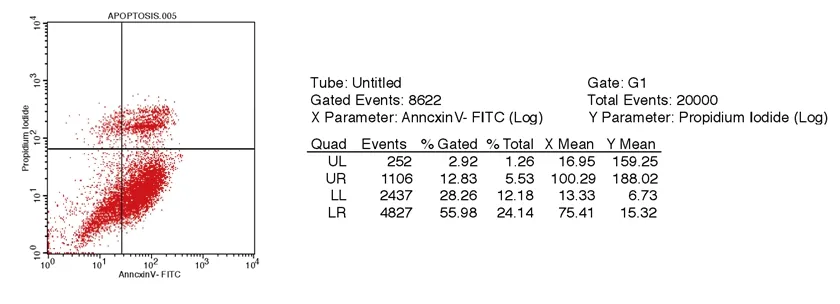
C 48 h

D 72 h
2.3 山竹提取物对细胞周期的影响 与对照组(山竹提取物浓度为0 μM)比较,各浓度山竹提取物组G1期细胞比例均升高,S期细胞比例均下降 (P<0.05),且随着药物浓度的提高,G1期细胞比例升高,同时S期细胞比例下降(P<0.05)。见表2。

表2 山竹提取物对HepG2细胞周期的影响(x±s,%)
注:G1期细胞组间两两比较,*P<0.05;●S期细胞组间两两比较,P<0.05。
2.4 Caspase-3的活性 Caspase-3的活性检测中吸光度越大,产生的pNA越多。Caspase 3酶活力单位的定义:即一个酶活力单位定义为当底物饱和时,在37℃可以剪切1 nmol Ac-DEVD-pNA产生1 nmol pNA的Caspase 3的酶量。故吸光度越大,Caspase 3酶活力越强。随着药物浓度的增加,405 nm的吸光度值越大,Caspase 3酶活力增强。与对照组(山竹提取物浓度为0 μM)酶活力单位比较,各浓度山竹提取物组HepG2细胞的Caspase-3酶活性均升高(P<0.05);给药组的酶活力单位随给药浓度的增加而明显增加(P<0.05)。见表3。

表3 山竹提取物对HepG2细胞Caspase-3活性的影响(x±s)
注:*与对照组比较,P<0.05,●不同浓度组间两两比较,P<0.05。
3 讨 论
肝癌是常见病和多发病,可分为原发性和继发性两大类。由于肝脏是人体最大的实质性器官,具有重要代谢功能,因此,肝脏一旦出现恶性肿瘤可危及生命。肝脏具有丰富的血流供应,与人体的重要结构如下腔静脉、门静脉、胆道系统等关系密切,而肝脏恶性肿瘤发病隐匿,侵袭性生长快速,其治疗甚为困难。手术切除是目前治疗早期肝癌唯一有效的方法,但大多数患者就诊时已为中晚期,手术疗效有限,因而寻找新的治疗方法尤为重要。在天然药物中寻找具有调控细胞增殖、凋亡的化合物单体或前体化合物,是目前国内外抗肿瘤药物研究的热点。国内外研究表明,山竹具有抗炎、抗肿瘤、抗氧化活性等作用,但是对其药理机制的研究却远远落后于对化学成分的研究。因此有必要对山竹及其有效成分的药理和毒理作用进行进一步的深入研究。
本实验结果显示山竹提取物能抑制HepG2细胞增殖并诱导其凋亡,随药物作用浓度的增大对细胞增殖抑制的影响逐渐增加(P<0.05),具有明显的浓度依赖性,且在一定浓度范围内具有时间依赖性。山竹提取物浓度为256.67 μmol/L时可诱导人肝癌细胞HepG2出现明显早期凋亡,并且随着药物作用时间的增加凋亡早期癌细胞的比率显著增高。以上结果说明了山竹提取物能抑制肝癌HepG2细胞的增殖和促使其凋亡。对细胞周期影响的分析结果显示,与对照组比较,随着药物浓度的提高,G1期细胞比例大幅升高,而同时S期细胞比例明显下降(P<0.05),提示山竹提取物抑制细胞进入S期从而导致G1期细胞比例大幅升高。
此外,对凋亡的执行者Caspase-3活性蛋白进行检测的结果显示,与对照组相比,各浓度山竹提取物组HepG2细胞的Caspase-3酶活性均升高(P<0.05)。提示经山竹提取物处理的HepG2细胞Caspase-3蛋白活性显著增加。细胞死亡主要有凋亡和坏死两种表现,两者之间主要的区别是死亡过程中细胞本身是否主动参与[16],本研究表明加入药物处理后,细胞的死亡是通过凋亡途径进行的。Caspase-3 是真核细胞中最常见的凋亡蛋白,也是研究最为透彻的半胱氨酸蛋白酶家族成员之一,大多数的细胞凋亡与其有关[17]。这些凋亡通路关键酶的激活可能是山竹提取物诱导HepG2细胞凋亡的重要原因。Caspase是一个含有半胱氨酸活性的胞浆蛋白酶家族,迄今至少发现14个成员,其目前发现的Caspase成员中与ced-3同源性最高的,是细胞凋亡过程中激活的关键酶,也是细胞凋亡的主要效应分子[18]。Caspase-3在多因素诱导的肝癌细胞凋亡中激活,促进Caspase-3活化和活性,能够加速肝癌细胞凋亡。然而,目前其活化分子机制尚不清楚,有待于进一步研究,从而为以Caspase-3为靶点的药物治疗提供坚实的理论基础[19]。
综上所述,山竹提取物对人肝癌细胞HepG2凋亡有诱导作用,且对肝癌细胞增殖有抑制作用,对肝癌治疗有一定价值;其作用机制可能与抑制HepG2细胞进入S期和激活Caspase-3有关,但尚需进一步的研究证实。
[1] 田学禄.肝癌治疗药物的研究新进展[J].中国药业,2009,18(24):64,Ⅰ-Ⅱ.
[2] 龚新雷,秦叔逵.原发性肝癌的分子靶向治疗研究新进展[J].临床肿瘤学杂志,2008,13(1):1-10.
[3] Gopalakrishnan G,Balaganesan B.Two novel xanthones from Garcinia mangostana[J].Fitoterapia,2000,71(5):607-609.
[4] Huang YL,Chen CC,Chen YJ,et al.Three xanthones and a benzophenone from Garcinia mangostana[J].J Nat Prod,2001,64(7):903-906.
[5] Sakagami Y,Iinuma M,Piyasena KG,et al.Antibacterial activity of alpha-mangostin against vancomycin resistant Enterococci(VRE) and synergism with antibiotics[J].Phytomedicine,2005,12(3):203-208.
[6] Moongkarndi P,Kosem N,Kaslungka S,et al.Antiproliferation,antioxidation and induction of apoptosis by Garcinia mangostana(mangosteen)on SKBR3 human breast cancer cell line[J].J Ethnopharmacol,2004,90(1):161-166.
[7] Chomnawang MT,Surassmo S,Nukoolkarn VS,et al.Antimicrobial effects of Thai medicinal plants against acne-inducing bacteria[J].J Ethnopharmacol,2005,101(1-3):330-333.
[8] Kaomongkolgit R,Jamdee K,Chaisomboon N.Antifungal activity of alpha-mangostin against Candida albicans[J].J Oral Sci,2009,51(3):401-406.
[9] Matsumoto K,Akao Y,Ohguchi K,et al.Xanthones induce cell-cycle arrest and apoptosis in human colon cancer DLD-1 cells [J].Bioorg Med Chem,2005,13(21):6 064-6 069.
[10]Suksamrarn S,Komutiban O,Ratananukul P,et al.Cytotoxic prenylated xanthones from the young fruit of Garcinia mangostana [J].Chem Pharm Bull(Tokyo),2006,54(3):301-305.
[11]Ryu HW,Cho JK,Curtis-Long MJ,et al.α-Glucosidase inhibition and antihyperglycemic activity of prenylated xanthones from Garcinia mangostana[J].Phytochemistry,2011,72(17):2 148-2 154.
[12]Ito C,Itoigawa M,Furukawa H,et al.Xanthones as inhibitors of Epstein-Barr virus activation[J].Cancer Lett,1998,132(1-2):113-117.
[13]赵 岩,刘金平,张连学,等.莽吉柿中几种双苯吡酮和蒽醌类成分的分离与鉴定[J].应用化学,2011,28(2):229-233.
[14]曾冰玲,鲁明明,李树基,等.α-及γ-倒捻子素对U87细胞、PC12细胞增殖的影响[J].数理医学杂志,2012,25(3):279-283.
[15]李运红,陈 敏,邹晓平,等.白藜芦醇对胃腺癌细胞株增殖和凋亡的影响[J],南京医科大学学报:自然科学版,2011,31(8):1 192-1 195,1 211.
[16]Sherr CJ.Cancer cell cycles[J].Science,1996,274(5 293):1 672-1 677.
[17]Cohen GM.Caspases:the executioners of apoptosis[J].Biochem J,1997,326(Pt 1):1-16.
[18]王新艳,李玉华,朱韫春,等.卵巢癌组织KLK11基因的表达意义[J].第四军医大学学报,2006,27(22):2 023-2 025.
[19]梁清清,石 英,李卫国.绿茶多酚诱导肝癌细胞凋亡时Caspase-3蛋白活性与mRNA的变化[J].安徽农业科学,2008,36(23):9 907-9 909,9 997.
Effects of mangosteen extract on proliferation and apoptosis of human hepatocellular carcinoma HepG2 cells
LAIYan-yan1,HUANGYing-wen2,HUANGDan-yang3,WULan-lan3,LUOBin-you3,LIXiao-long3
(1DepartmentofCytobiologyandGenetics,GuangxiMedicalCollege,Nanning530021,China;2OfficeofHospitalAffairs,theFirstAffiliatedHospitalofGuangxiUniversityofChineseMedicine,Nanning530021,China;3GuangxiMedicalUniversity,Nanning530021,China)
Objective To explore the effects of mangosteen extract on the proliferation and apoptosis of human hepatocellular carcinoma HepG2 cells and its mechanism.Methods Methylthiazolyl tetrazolium(MTT) assay was used to assess the effect of mangosteen extract on the proliferation and apoptosis of HepG2 cells with various concentrations.Annexin-V/PI double staining method and PI single staining method were used to determine the effect of mangosteen extract on the apoptosis and cell cycle of HepG2 cells respectively.Cysteine-containing aspartate-specific proteases-3(Caspase-3) kit was used to assess the effect of mangosteen extract on the Caspase-3 activation of HepG2 cells.Results The mangosteen extract with various concentrations(100 μmol/L,200 μmol/L,400 μmol/L,600 μmol/L and 800 μmol/L) could inhibit the proliferative activity of HepG2 cells,and the inhibitory rate of the cells increased with the increasing concentration of drug and duration of drug action(P<0.05).The mangosteen extract with the concentration of 256.67 μmol/L could induce early apoptosis in HepG2 cells,and the ratio of the cells in early apoptotic stage increased significantly with the increasing duration of drug action.Cell-cycle analysis revealed that the ratio of HepG2 cells in the G1 phase increased and the ratio of the cells in the S phase reduced with the increasing mangosteen extract concentration(0 μmol/L,200 μmol/L,400 μmol/L,600 μmol/L and 800 μmol/L)(P<0.05).Compared to the control group(0 μmol/L),the Caspase-3 activities of HepG2 cells in the groups with different mangosteen extract concentrations(200 μmol/L,400 μmol/L,600 μmol/L and 800 μmol/L) increased(P<0.05),and the Caspase-3 activities of HepG2 cells increased with the increasing mangosteen extract concentration(P<0.05).Conclusion Mangosteen extract can inhibit the proliferation and promote the apoptosis of human hepatocellular carcinoma HepG2 cells.The mechanism may be related to the inhibition of HepG2 cells entrance into S phase and activation of Caspase-3.
Hepatocellular carcinoma,Human hepatocellular carcinoma HepG2 cells,Mangosteen extract,Proliferation,Apoptosis,Cell cycle,Cysteine-containing aspartate-specific proteases-3
广西医科大学青年科学基金项目(GXMUYSF09);实验室开放课题(02610212063)
赖燕燕(1974~),女,硕士,讲师,研究方向:肿瘤与天然药物的研究。
李晓龙(1984~),男,硕士,讲师,研究方向:肿瘤及肿瘤治疗,E-mail:xlonglee.chn@outlook.com。
R 735.7
A
0253-4304(2016)04-0452-05
10.11675/j.issn.0253-4304.2016.04.02
2015-11-16
2016-02-16)
