进出口动物中新霉素ELISA检测方法的建立
2016-02-16孙明君张金玲郑小龙
孙明君,邱 芳,张金玲,郑小龙*
(1.山东出入境检验检疫局检验检疫技术中心,青岛266002;2.潍坊出入境检验检疫局,潍坊261000)
进出口动物中新霉素ELISA检测方法的建立
孙明君1,邱 芳1,张金玲2,郑小龙1*
(1.山东出入境检验检疫局检验检疫技术中心,青岛266002;2.潍坊出入境检验检疫局,潍坊261000)
摘 要:应用碳二亚胺法合成人工抗原得到卵清蛋白偶联新霉素,通过方阵试验确定最佳抗原包被浓度与抗体稀释倍数,以新霉素质量浓度对数为横坐标、抗体抑制率为纵坐标绘制标准曲线,建立了进出口食用动物中新霉素ELISA快速检测技术,并对建立的方法进行了回收率和特异性试验。结果表明,建立的检测方法包被人工合成抗原的最适稀释度为1∶200,抗体的最佳稀释度为1∶2 000,半数抑制浓度(IC50)为6.99ng/mL;该方法的最低检测限达40ng/mL,与庆大霉素、卡那霉素、链霉素、托普霉素、阿米卡星、双氢链霉素的交叉反应率均小于0.1%,平均加标回收率83.77%。标准曲线在1.5~40ng/mL范围内是线性的,相关系数为0.987,标准曲线方程为y=-37.66x+94.592;与常规液相检测方法相比操作简单、快速。本研究建立了一种快速、高效、特异的新霉素ELISA检测方法。
关键词:进出口食用动物;新霉素;酶联免疫吸附试验;检测方法
新霉素是氨基糖苷类抗生素,对革兰氏阴性和阳性菌均有很好的抑杀作用。在畜牧和水产中,该类抗生素不但被广泛用于防制各种动物疾病,而且常常添加到饲料中[1],用于促进动物生长发育。氨基糖苷类抗生素的作用机理主要是抑制蛋白质的合成,其在动物性食品中残留可能会引起过敏,长期使用可能还会引起耳和肾脏毒性等比较严重的毒副作用。中国长期存在滥用、不合理使用抗生素饲料添加剂的情况,动物性食品中抗生素残留问题十分严重,不仅给消费者带来健康上的损害,而且阻碍中国动物产品的出口。近几年,中国不断加强食用动物中抗生素使用的监督管理,除了制定、修订法律法规,还不断对残留的限量做出规定,以最大限度地减少食品安全对人类健康的威胁。
目前国内相关标准检测新霉素残留的方法主要有高效液相色谱法(HPLC)、液相色谱-质谱法(LC-MS)和高效快速的免疫方法[2]。一般先用ELISA方法进行筛选,对可疑样品再用质谱法进行确认。商艳红等[3]用ELISA检测方法测定了鸡肉组织中新霉素残留,与其他6种氨基糖苷类抗生素均未出现交叉反应,鸡肉组织样本的添加回收率均在71.8%~97.8%。Wang等[4]用ELISA检测动物源食品中的新霉素,猪肉、鸡肉、鱼和牛奶中的检测限是5μg/kg,肾脏中是10μg/kg,鸡蛋中是20μg/kg;回收率为75%~105%,对其他氨基糖苷类抗生素均没有发现交叉反应。Jin等[5]用单克隆抗体直接竞争ELISA方法测定动物牛奶和血浆中的新霉素,没有对其他氨基糖苷类抗生素发生交叉反应,说明抗体具有较高的特异性,在血浆和牛奶中的检测限分别是3.61、2.73ng/mL,50~200ng/mL水平的加标回收率是87%~108%。黄耀凌等[6]建立了牛奶中链霉素残留的快速筛选检测方法,检测限可达20μg/mL,200μg/mL质量浓度的空白奶样添加回收率为60%~110%。现行标准中基本是动物屠杀后组织中药物残留的检测,单纯靠动物屠宰后的残留检测并不能满足进口活体动物中药物残留的检测,而药物经动物体内代谢后会在血液和尿液中残留,所以亟待建立一种针对活体动物血液和尿液中药物残留的检测方法。因此,本试验在以往试验的基础上建立针对进出口活体动物的血液和尿液中新霉素残留的检测方法,以期有效解决中国进出口食用动物中新霉素的快速检测等问题。
1 材料与方法
1.1试剂与仪器
硫酸新霉素标准品购自Dr.Ehrenstorfer公司;碳二亚胺购自Aldrich公司;卵清蛋白(OVA)购自Sigma公司;牛血清白蛋白(BSA)购自Amresco公司;新霉素多抗(绵羊源)购自Abnova公司;驴抗绵羊HRP酶标二抗购自Abbkine公司;透析袋;吐温-20、碳酸钠、磷酸氢二钠、磷酸二氢钠、氯化钠、氢氧化钠、磷酸氢二钾、磷酸二氢钾均为国产分析纯;Millipore纯水仪(Milli-Q)、96孔酶标板(Biofil)、酶标仪(infinite M200)、洗板机(BioRAD1575)、8道微量移液器(Eppendorf)、离心机(Eppendorf5810)、涡旋混匀器(IKA-MS2)、pH计(Mettler Toledo)均由山东省出入境检验检疫局检验检疫技术中心动检实验室提供。
1.2溶液
包被缓冲液:0.05mol/L的碳酸盐缓冲液(CBS)(pH 9.6);洗涤缓冲液:含0.05%Tween-20的0.1mol/L的PBS缓冲液(pH 7.6);稀释缓冲液:含0.1mol/L的PBS缓冲液(pH 7.6);封闭缓冲液:含2%的BSA溶液;底物液:0.3%过氧化氢;显色剂液:用pH 5.0的乙酸钠-柠檬酸缓冲液配制0.2g/L的四甲基联苯胺溶液;终止液:2mol/L的H2SO4溶液。
1.3人工抗原的合成
卵清蛋白偶联新霉素(OVA-NEO):称取20mg NEO和20mg OVA溶于PBS溶液(0.01mol/L,pH 7.4),搅拌均匀(20min),称70mg EDC加入到上述混合液中,搅拌反应4h,然后进行透析(20℃条件下用0.01mol/L PBS透析3d,12h换一次透析液),透析结束之后,4℃保存。
SDS-PAGE鉴定:5%浓缩胶、10%分离胶、浓缩胶电压70V、分离胶电压85V、上样量20μL,考马斯亮蓝染色5~6h后,置洗脱液中过夜脱色[7-8]。
1.4样品的制备与保存
用一次性无菌注射器采集静脉血10mL置于抗凝血试管中;直接采集食用动物排泄的尿液于50mL离心管中。所采集食用动物的血液、尿液置于4℃下保存备用,长期存放置于-18℃。
1.5测定步骤
取50μL血液或尿液样品,加1.2mL PBS缓冲液,混匀;4 000r/min离心5min;每孔取50μL上清来检测[9-10]。ELISA测定根据待测样品数量和标准样品(每个样品2个平行),决定微孔的使用量;每孔100μL含有OVA偶联新霉素抗原包被板4℃过夜;将微孔内液体垂直倒掉,加入250μL洗涤缓冲液,轻轻晃动后垂直倒掉,再重复洗涤微孔3次,在滤纸上用力垂直磕掉残留在壁上的液体;每孔加250μL 2%BSA,37℃封闭2h;洗板;每孔中加入50μL标准溶液或待测样品溶液;在每孔中加入50μL辣根酶标记物和50μL抗体,混匀;室温(22.5±2.5)℃避光孵育30min;洗板;每孔加入50μL底物和50μL显色剂液,充分混合并在室温(22.5±2.5)℃下暗处孵育15min;加入100μL的终止液终止反应,充分混合后30min内于450nm处测量吸光度值[11]。
1.6抗原包被浓度与抗体量的确定
方阵试验确定包被抗原最适包板量和新霉素抗体的最适稀释倍数,即用包被液对合成抗原按照1∶10、1∶50、1∶100、1∶200、1∶500、1∶1 000、1∶2 000、1∶5 000稀释,每个稀释度1行,每孔加100μL,包被板于4℃过夜后,每孔加入300μL洗液洗板3次,拍干,然后加2%BSA 250μL,封膜,37℃培养箱中封闭2h。将新霉素多抗用PBS按照1∶100、1∶200、1∶500、1∶1 000、1∶2 000、1∶5 000、1∶10 000、1∶20 000、1∶50 000、1∶100 000、1∶200 000稀释,按顺序每个稀释度加1列(最后一列为PBS空白对照孔),每孔加100μL,室温放置30min。倒掉孔中液体,用洗液每孔300μL洗板3次,拍干。然后每孔加入1∶2 000PBS稀释的HRP偶联物,每孔100μL,室温放置30min;倒掉孔中液体,用洗液每孔300μL洗板3次,拍干。每孔加入底物100μL,室温避光反应15min后,每孔加入100μL终止液,酶标仪450nm读数[12]。
1.7标准曲线和最低检测限的确定
采用竞争ELISA法,以上述方阵法确定的适宜包被浓度和抗体稀释度为基础,将新霉素标准品稀释成不同质量浓度(0、1.5、3.0、6.0、12.0、36.0ng/mL),每孔点样50μL做竞争ELISA,以新霉素质量浓度的对数作为横坐标,抗体的抑制率为纵坐标绘制标准曲线,并确定其检测限[13]。
1.8抗体特异性的考察
分别配制相应浓度庆大霉素、卡那霉素、链霉素、托普霉素、阿米卡星、双氢链霉素,每孔分别加50μL,与等量的抗体稀释液进行竞争反应,以新霉素的IC50与类似物IC50浓度之比计算交叉反应率,交叉反应率愈低说明抗体的特异性愈高[14-15]。
1.9回收率与方法准确性
分别对绵羊血和猪尿液进行添加,添加浓度为37.50、125.00、250.00、375.00、500.00、750.00ng/mL。人工添加NEO到PBS空白液中,使其在PBS中的终浓度为10、20ng/mL,以板内误差及板间误差来表示该方法的准确度。
1.10方法的不确定度
参照JJF 1059-1999测量不确定度评定与表示、CANS-GL06化学分析中不确定度的评估指南,ELISA检测进出口食用动物中新霉素含量过程中不确定度的来源,主要包括测量重复性、样品吸取体积、样品前处理加样体积、ELISA检测过程中标准溶液和标准曲线拟合。
1.11不同方法的比较
分别用本方法、试剂盒方法和液相色谱质谱联用(LC-MS)方法对同一批新霉素的添加样品进行测定并对数据进行比较。
2 结果与分析
2.1人工合成抗原的鉴定
OVA和BSA分子质量分别为66.5、45.0ku,相比NEO 908u分子质量很大,因此偶联成功时并不能有很明显的分开条带,偶联成功后仅增加几百道尔顿,只能呈现出拖尾现象,因此通过SDS-PAGE图若能够观察到拖尾现象就能够说明偶联成功。由图1可知,OVA-NEO偶联物有明显的拖尾现象,表明OVA-NEO的分子质量大于OVA,证明NEO与OVA已成功偶联[16-17]。

图1 合成抗原蛋白电泳结果Fig.1 Results of synthetic antigen protein electrophoresis
2.2新霉素包被抗原及抗体稀释度的确定
方阵滴定选择D值在1.0左右的包被抗原浓度及抗体稀释度作为最佳工作浓度[18],结果见表1。由表1可知,包被抗原的最佳稀释度为1∶200,新霉素抗体的最佳稀释度为1∶2 000。
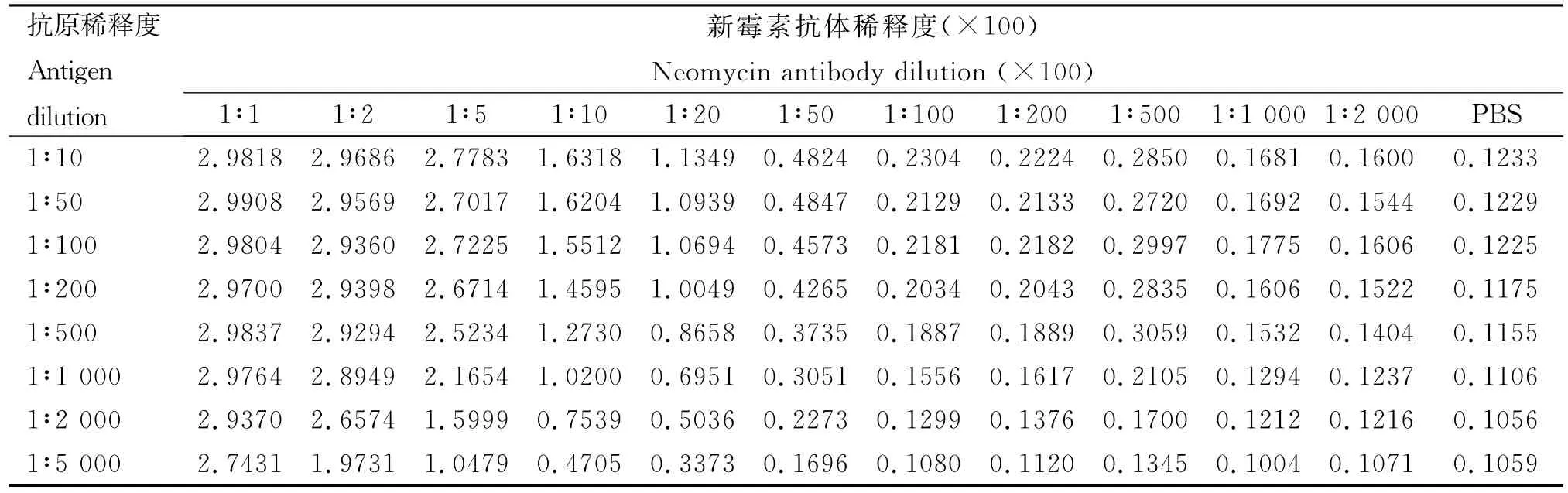
表1 方阵法确定试剂的最佳工作浓度Table 1 Square method to determine the best working concentration reagent
2.3竞争标准曲线的绘制
将6个浓度的新霉素标准溶液(0、1.5、3、6、12、36ng/mL)按限量法测定步骤测得相应的D值。以0浓度的吸光度D值为分母,其他标准浓度的D值为分子的比值,再乘以100%,获得吸光度的百分比。以此吸光度百分比为纵坐标,对应的5个新霉素标准浓度对数值为横坐标,在半对数坐标上绘制标准曲线(图2)。该定标模型在1.5~40ng/mL范围内是线性的,在标准曲线中获得待测溶液中新霉素含量。标准品检测范围为1.5~36ng/mL,拟合方程为y=-37.66x+94.592,R2=0.987,IC50为6.99ng/mL,IC15可达2.97ng/mL,最低检测限为40ng/mL,灵敏度较高[19]。
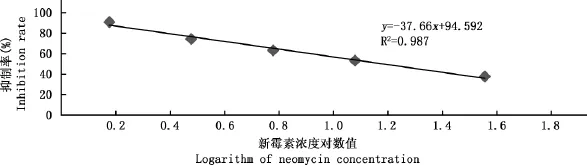
图2 新霉素标准曲线Fig.2 Standarding curve of neomycin
2.4特异性
通过竞争试验观察新霉素与6种类似物交叉反应率。由表2可知,抗体与类似物庆大霉素、那卡霉素、链霉素、托普霉素、阿米卡星和双氢链霉素的交叉反应率均<0.1%,表明试验获得抗体的特异性比较高。

表2 方法的特异性Table 2 The specificity of the method
2.5加标回收率与方法准确性
2.5.1加标回收率 对样本进行添加回收试验,分为绵羊血和猪尿液两组基质,每种基质分别做样本空白、37.50、125.00、250.00、375.00、500.00、 750.00ng/mL的新霉素添加,每个样本3个平行,两组基质各做一个试剂空白,结果见表3。由表3可知,该方法测得样品中新霉素的平均回收率为83.77%,实际检测浓度与添加浓度接近。
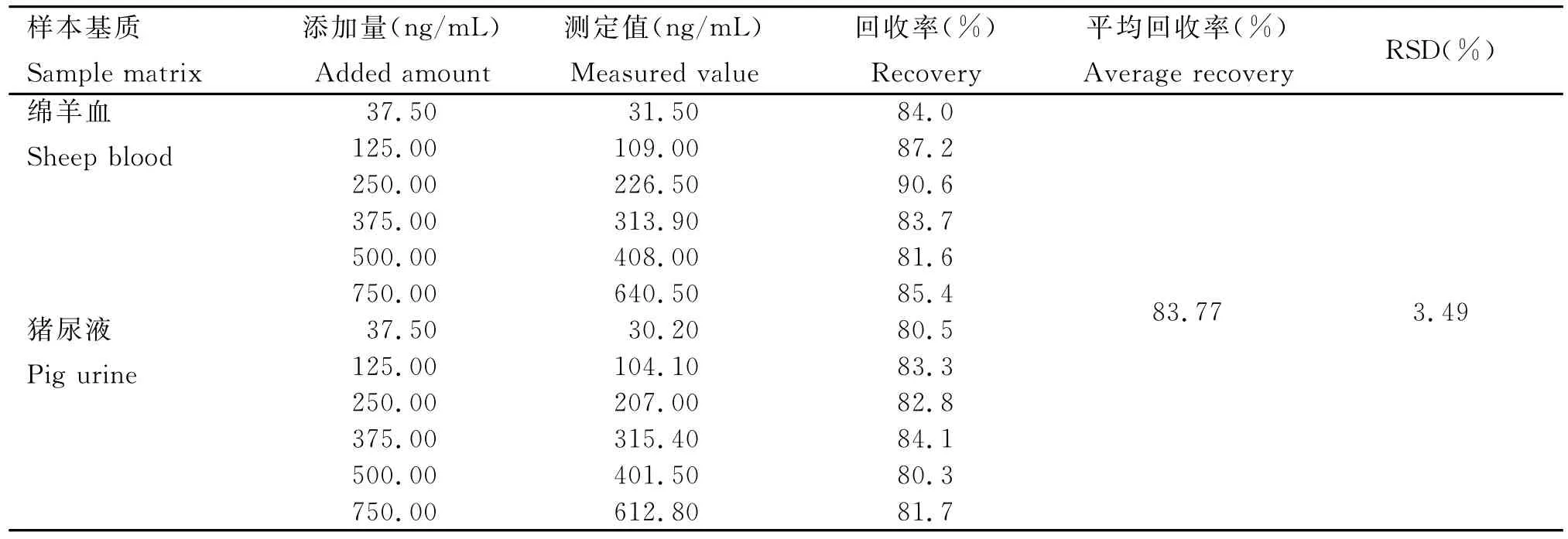
表3 不同样品基质中新霉素添加回收率及相对标准偏差Table 3 Samples of different matrix of neomycin add recoveries and relative standard deviation
2.5.2方法准确性 板内测定为同一酶标板上同一样本若干孔的平均值,板间测定为不同酶标板上几次测定结果的平均值,本试验中,板内误差和板间误差均取3次测定的平均值,结果见表4。由表4可知,NEO添加浓度为10ng/mL时,3次重复测定的板内变异系数为0.50%,板间变异系数为5.23%;NEO添加浓度为20ng/mL时,3次重复测定的板内变异系数为1.36%,板间变异系数为3.72%;说明该方法的稳定性较好。其中B/B0为样品吸光度值与空白吸光度值的百分比,也就是抑制浓度百分比。
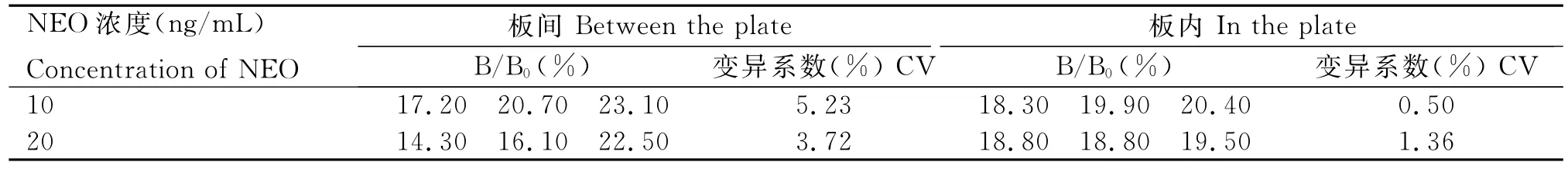
表4 方法准确性考查Table 4 The accuracy test of the method
2.6不确定度分析
以猪尿液作为样品基质,分别将重复性测量、样品吸取、前处理过程加样体积、ELISA检测过程中标准溶液和标准曲线拟合作为不确定度分量进行考查,并将不确定度分量合成标准不确定度,得到合成标准不确定度为:0.4826ng/mL;置信水平为95%,包含因子k=2,ELISA检测猪尿液中新霉素的扩展不确定度为0.9496ng/mL[20]。ELISA检测猪尿液中新霉素的不确定度分析结果见表5。

表5 ELISA检测猪尿中新霉素的不确定度分析Table 5 The uncertainty analysis of ELISA to detect neomycin in pig urine
2.7不同方法比较
选取猪尿液和绵羊血作为样品基质,分别添加100、200、500ng/mL新霉素标准品,编号1~3为尿液基质,编号4~6为血液基质,添加浓度按编号顺序由小到大,所测定的数值见表6。由表6可知,3种方法中LC-MS方法得到的数值与添加值最接近,虽然LC-MS方法在定量方面更准确,但是在大规模筛查方面本方法与试剂盒方法在操作和用时上显然优于LC-MS方法。而本方法得到的数值虽然与试剂盒方法相近,但测定相同样品的RSD小于试剂盒方法,表明所得数值分布更加均匀稳定,因此本方法在大规模筛查中有一定优势。
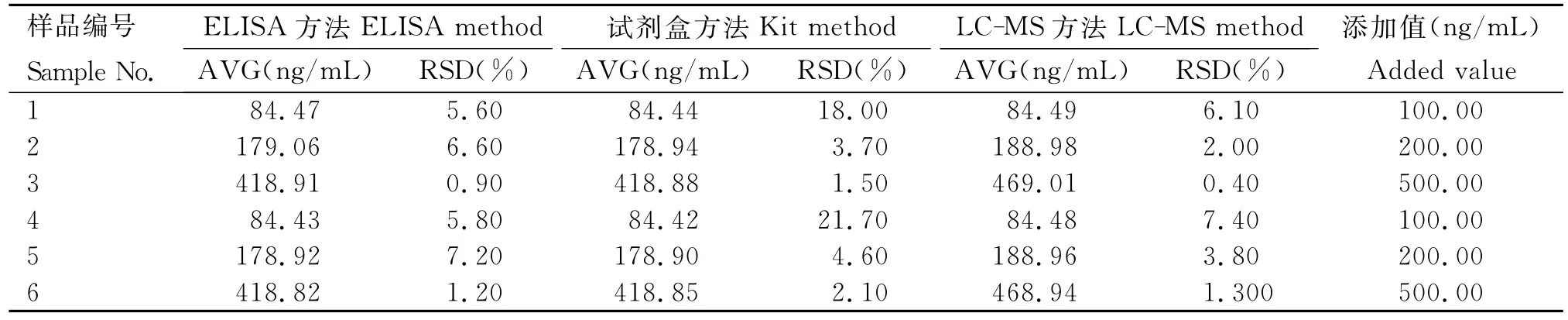
表6 3种方法检测样品中不同添加浓度的NEOTable 6 Detection of NEO in the samples with different added concentrations by three kinds of method
3 讨 论
试验建立了快速检测进出口食用动物中新霉素残留的竞争ELISA方法。成功合成抗原并确定了新霉素包被抗原及抗体最佳工作浓度,试验结果表明,该检测方法的最低检测限可达40ng/mL,检测范围为1.5~36.0ng/mL,与6种化学结构类似物交叉反应小,抗体特异性较好,样品平均加标回收率为83.77%,板间、板内变异系数均小于5%。多次试验数据表明,该方法灵敏度高、稳定性好且具有ELISA检测法微量、高效、经济和方便的特点,可用于进出口食用动物中新霉素残留的大批量、快速检测。
由于氨基糖苷类抗生素具有毒副作用,各国对氨基糖苷类等各种抗生素的残留限量作了很严格的规定。要发展对外贸易,就必须加大对抗生素残留的检测。液相色谱作为目前主要的检测方法,发挥着重要的作用,但动物样品基质中含有大量的蛋白质和脂类物质等多种复杂的成分,往往会降低样品的检测限和回收率等。高效快速的免疫方法,其检测的准确性对于进出口食用动物中抗生素的快速检测十分重要,相信今后ELISA法能够更好地应用于氨基糖苷类的定量分析。
4 结 论
本试验建立了测定进出口食用动物中新霉素残留量的ELISA法,对绵羊血、猪尿液中新霉素检测限达到40ng/mL;特异性试验结果表明,该方法对其他氨基糖苷类无交叉反应,具有良好的特异性。综上所述,本试验建立了灵敏、快速、特异的新霉素ELISA检测方法,该方法在进出口动物检验检疫中具有重要的应用价值。
参考文献:
[1] 刘晓冬,林 洪,江 洁.动物源性食品中氨基糖苷类抗生素检测技术的研究进展[J].安徽农业科学,2010,38(8):4128-4132.
[2] 滕 慧,张亚雄.新霉素研究进展[J].三峡大学学报(自然科学版),2008,30(2):95-98.
[3] 商艳红,陈义强,吴小平,等.鸡组织中新霉素残留的ELISA检测方法的研究[J].中国兽医杂志,2007,43(7):90-91.
[4] Wang S,Xu B,Zhang Y,et al.Development of enzyme-linked immunosorbent assay(ELISA)for the detection of neomycin residues in pig muscle,chicken muscle,egg,fish,milk and kidney[J].MeatScience,2009,82(1):53-58.
[5] Jin Y,Jang J,Leem,et al.Development of ELISA and immunochromatographic assay for the detection of the detection of neomycin[J].ClinicaChimicaActa,2006,364(1-2):260-266.
[6] 黄耀凌,刘智宏,叶 妮,等.ELISA法检测牛奶中链霉素残留量[J].中国乳品工业,2007,35(2):54-56.
[7] 刘沙洲,黄 非,王丽丽,等.新霉素酶联免疫检测方法的研究-新霉素抗体的制备[J].食品科技,2007,3:208-211.
[8] 刘宣兵,滕 蔓,张改平,等.新霉素单克隆抗体的制备及其免疫学特性鉴定[J].华北农学报,2009,24(4):80-83.
[9] 刘维红,厉 磊.酶联免疫吸附法测定猪肉中的盐酸克伦特罗[J].安徽农学通报,2008,14(19):227-229.
[10] 肖小华,周 思,李攻科.莱克多巴胺ELISA快检技术样品前处理方法研究[J].食品安全质量检测学报,2012,3(5):485-488.
[11] 孙明君,郑小龙,孙 涛,等.进出口食用动物、饲料中盐酸克伦特罗ELISA检测方法的建立[J].黑龙江畜牧兽医,2015,11(上):278-281.
[12] 徐乃丰,胥传来,匡 华,等.新霉素的直接竞争酶联免疫分析法[J].食品科学,2011,32(10):212-217.
[13] 邢广旭,王方雨,胡骁飞,等.新霉素快速半定量ELISA试剂盒的研制与应用[J].核农学报,2013,27(6):811-816.
[14] 王爱萍,李发弟,胡骁飞,等.新霉素阻断ELISA试剂盒的研制与应用[J].畜牧兽医学报,2011,42(6):857-864.
[15] 焦 奎,张书圣.酶联免疫分析技术及应用[M].北京:化学工业出版社,2004.
[16] 张改平,刘宣兵,彩鸿翔,等.新霉素人工抗原的合成与鉴定[J].中国饲料,2008,17:38-41.
[17] 周群标,桑亚新,王 丽,等.动物性食品中盐酸克伦特罗ELISA检测方法的建立及应用[J].中国食品学报,2011,11(6):158-161.
[18] 刘沙洲,桑小雪,欧阳华学,等.新霉素ELISA检测方法的建立[J].食品科学,2011,32(14):227-231.
[19] 方结红,张明洲,李 艳,等.动物组织中新霉素残留快速检测方法[J].中国计量学院学报,2009,20(3):211-213.
[20] 肖 静,赵健亚,许世勇,等.ELISA检测饲料中莱克多巴胺的不确定度分析[J].中国饲料,2012,7:38-39.
(责任编辑 秦 彤)
中图分类号:S859.2
文献标识码:A
文章编号:1671-7236(2016)12-3163-07
doi:10.16431/j.cnki.1671-7236.2016.12.012
收稿日期:2016-05-11
基金项目:CNCA检验检疫行业标准制定计划项目(2014B369)
作者简介:孙明君(1986-),男,辽宁铁岭人,硕士生,兽医师,研究方向:食品农产品质量安全,E-mail:522302003@qq.com
通信作者:*郑小龙(1979-),男,山东平邑人,硕士,高级兽医师,研究方向:动物疫病检测,E-mail:zhengxl612@163.com
Establishment of ELISA Detection Method for Neomycin in Import and Export Animal
SUN Ming-jun1,QIU Fang1,ZHANG Jin-ling2,ZHENG Xiao-long1*
(1.InspectionandQuarantineTechnologyCenterofShandongEntry-exitInspectionandQuarantineBureau,Qingdao266002,China;2.WeifangEntry-exitInspectionandQuarantineBureau,Weifang261000,China)
Abstract:This experiment used carbodiimide get egg albumin synthesis of artificial antigens coupling neomycin,through square test to determine the best antigen packaged concentration and antibody dilution ratio,mass concentration logarithm of neomycin as abscissa,inhibition rate of antibody as the ordinate drawing standard curve,established ELISA fast detection techniques of neomycin in edible animal for import and export.Methods of recovery and specific test had been done in further research.Results showed that the test dilution ratio of optimum synthetic antigen was 1∶200,the best dilution multiple of antibodies was 1∶2 000,half inhibitory concentration(IC50)was 6.99ng/mL;The minimum detection limit of the method was 40ng/mL,and cross reaction rate of gentamicin,kanamycin,streptomycin,tobramycin,amikacin and dihydrostreptomycin were less than 0.1%,the average of recovery rate was 83.77%.The range of standarding curve in 1.5~40ng/mL was linear,the correlation coefficient was 0.987,the equation of standarding curve was y=-37.66x+94.592;Compared with HPLC method,the operation was simple and fast.The test results showed that the enzyme-linked immunosorbent method of detecting neomycin was rapid,efficient and specific.
Key words:import and export food animals;neomycin;enzyme-linked immunosorbent assay(ELISA);detection method
