H9和H6亚型禽流感病毒二重RT-PCR检测方法的建立
2016-02-16谢芝勋宋德贵谢志勤罗思思谢丽基黄娇玲
李 丹,谢芝勋,宋德贵,李 孟,谢志勤,罗思思,谢丽基,黄 莉,范 晴,黄娇玲
(1.广西师范大学生命科学学院,桂林541000;2.广西壮族自治区兽医研究所,广西兽医生物技术重点实验室,南宁530001)
H9和H6亚型禽流感病毒二重RT-PCR检测方法的建立
李 丹1,谢芝勋2*,宋德贵1,李 孟2,谢志勤2,罗思思2,谢丽基2,黄 莉2,范 晴2,黄娇玲2
(1.广西师范大学生命科学学院,桂林541000;2.广西壮族自治区兽医研究所,广西兽医生物技术重点实验室,南宁530001)
摘 要:试验旨在建立可同时鉴别检测H9和H6亚型禽流感病毒(avian influenza virus,AIV)的二重RT-PCR方法。根据GenBank中H9和H6亚型AIV的HA基因保守序列,分别设计2对特异性引物,优化引物浓度与退火温度等条件,建立了可同时鉴别检测H9和H6亚型AIV的二重RT-PCR检测方法。用该法对H9和H6亚型AIV混合感染样品、H9亚型AIV单一感染样品和H6亚型AIV单一感染样品进行扩增,结果均得到对应的目的条带,而对其余亚型AIV及其他禽病病原体均未扩增出特异性条带。该法对H9和H6亚型AIV的检测下限均为5×104拷贝/μL。本研究建立的二重RT-PCR检测方法特异性强、敏感性高、稳定性和重复性良好,可同时鉴别检测H9与H6两种亚型AIV,为H9与H6亚型AIV的监测提供技术支撑。
关键词:禽流感病毒;H9亚型;H6亚型;二重RT-PCR
禽流感病毒(avian influenza virus,AIV)属于正黏病毒科、A型流感病毒属。根据AIV表面的血凝素蛋白(hemagglutinin,HA)和神经氨酸酶蛋白(neuraminidase,NA)抗原的差异可划分为18种HA亚型(H1~H18)和10种NA亚型(N1~N10)[1-4]。另外,根据病毒对鸡致病性的强弱又可将其分为低致病性禽流感病毒(low pathogenic avian influenza,LPAIV)和高致病性禽流感病毒(highly pathogenic avian influenza,HPAIV)[5]。长期以来,因为LPAIV造成的家禽损失较小而往往被人们忽视和轻视。近年来研究结果表明,LPAIV可通过基因重组进而造成人类流感的大流行,其中H9与H6亚型AIV就是这类LPAIV中较重要的两个亚型。有研究结果表明,近年来新出现的可感染人的H7N9、H10N8、H6N1和H5N6亚型流感病毒的部分基因来自H9N2亚型禽流感病毒[6-9]。1997年香港地区发现的感染人的高致病性H5N1亚型AIV的7个基因来源于H6亚型禽流感,这表明低致病性H6亚型AIV有可能为H5亚型HPAIV提供内部基因[10]。2013年5月,中国台湾地区发现了首例H6N1亚型AIV直接感染人的病例[11]。另外,血清学抗体调查结果表明H9与H6亚型AIV都可感染人[12-13]。因此,H9与H6亚型AIV对人类公共卫生安全具有重要意义,引起了广泛的关注。
病毒分离鉴定是AIV检测的一种经典方法,但该方法存在检测周期较长的缺点。目前检测AIV的方法主要是血清学和分子生物学方法,而血清学方法需要标准阳性血清,具有一定的局限性[14]。分子生物学检测方法具有快速准确等优点,特别是多重PCR具有操作简便、特异性强、敏感性高、省时省力等特点而得到了广泛应用[15]。近年来,广西动物疫病病原生物学与诊断重点实验室对广西地区的低致病性禽流感进行了持续的流行病学监测,研究结果表明H6与H9亚型AIV在家禽中较常见且有混合感染的情况存在[16]。H9与H6亚型AIV混合感染具有相似的临床症状且传统的检测方法费时,难以及时准确的得到诊断结果。因此,本研究旨在建立一种可同时检测H9与H6亚型AIV的二重RT-PCR检测方法,以期快速准确的鉴别两种亚型AIV,为感染人的禽流感亚型的监测提供技术支撑,具有重要的公共卫生意义。
1 材料与方法
1.1材料
1.1.1毒株 H1N7、H3N2、H6N1、H6N2、H6N8、H9N2及H9N6亚型AIV毒株、新城疫病毒(NDV)、鸡传染性支气管炎病毒(IBV)、鸡毒支原体(MG)、禽呼肠孤病毒(ARV)及鸡传染性喉气管炎病毒(ILTV)均由广西动物疫病病原生物学与诊断重点实验室保存;H2N3、H4N5、H8N4、H10N3、H11N3、H12N5、H13N5亚型AIV毒株均由香港大学惠赠;H5N2、H7N2、H14N5、H15N9、H16N3亚型AIV的RNA均由美国宾夕法尼亚州立大学惠赠。
1.1.2试剂 SPF鸡胚购自北京梅里亚公司;MLV反转录酶、dNTP和RNA酶抑制剂、DL2000 DNA Marker、pMD18-T载体均购自TaKaRa公司;DNA/RNA抽提试剂盒、2×TransTaq-T PCR SuperMix、胶回收试剂盒和质粒抽提试剂盒均购自北京全式金生物技术有限公司。
1.2方法
1.2.1引物设计与合成 根据GenBank中H9和H6亚型AIV的HA基因序列,运用DNAStar软件进行比对,比较出保守序列,以鸡源H9N2亚型AIVHA基因(登录号:KU762372.1)和鸭源H6N8亚型HA基因(登录号:JX304762.1)为参考序列,运用Primer Premier 5.0软件,设计筛选出2对特异性引物,并通过BLAST验证。引物由北京六合华大基因有限公司合成。引物序列见表1。
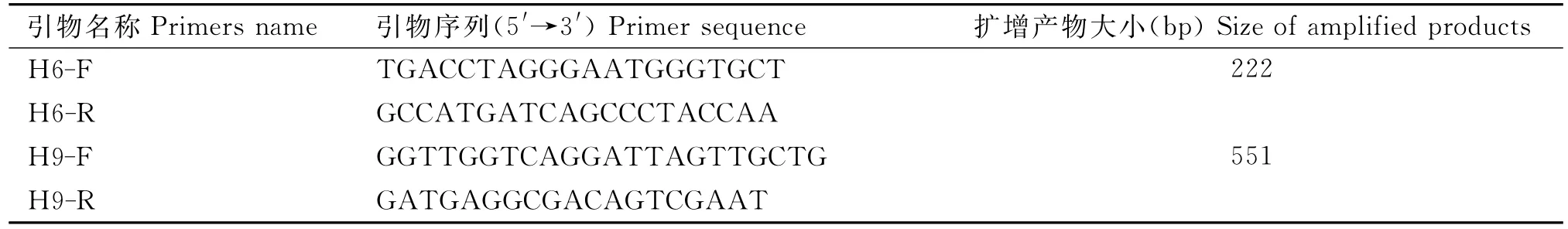
表1 引物序列Table 1 Sequences of primers
1.2.2病毒RNA/DNA提取与RNA反转录 参照DNA/RNA抽提试剂盒使用说明书对试验中所用到的AIV、NDV、ARV和IBV的RNA及ILTV的DNA进行抽提,抽提后的DNA/RNA用33μL DEPC水溶解。RNA病毒抽提产物参照反转录酶说明书进行反转录合成cDNA,所有产物置于-30℃保存。
1.2.3二重RT-PCR反应体系及条件的优化二重PCR反应体系25μL:2×TransTaq-T PCR SuperMix 12.5μL,H9与H6亚型AIV cDNA共2μL作为模板,引物H9-F、H9-R、H6-F和H6-R(25pmol/μL)各加入0.1~1.0μL,10个梯度进行引物浓度的优化,最后用超纯水补至25μL。根据试验效果对退火温度及时间进行优化,最终确定最佳的反应体系及条件。
1.2.4特异性试验 运用所建立的二重RTPCR检测方法按照优化好的反应条件对H1N7、H2N3、H3N2、H6N1、H6N2、H6N8、H8N4、H9N2、H9N6、H10N3、H12N5、H13N5、H14N1、H15N5、NDV、ARV、IBV和ILTV的RNA/DNA进行检测,验证该方法的特异性。
1.2.5标准品的制备 参考文献[17]的方法,用HA全长基因的引物,分别以H9N2与H6N2为模板进行RT-PCR扩增,得到其HA基因全长目的片段,并将这两个基因片段分别连接到pMD18-T载体上。将含有H9与H6亚型AIV的HA基因片段序列的重组载体分别命名为H9-T和H6-T。用质粒抽提试剂盒提取H9-T和H6-T的质粒,并用NanoDrop ND-1000微量核酸检测仪对其进行浓度测定,根据分子质量和核酸浓度计算对应的拷贝数,将H9-T与H6-T等拷贝数混合,并进行10倍倍比稀释,以得到H9-T与H6-T质粒DNA浓度均为5× 109至5×101拷贝/μL的标准品。
1.2.6敏感性试验 运用所建立的H9和H6亚型AIV二重RT-PCR的检测方法对H9-T与H6-T质粒浓度为5×109至5×101拷贝/μL的样品进行特异性扩增,检测该方法的敏感性。
1.2.7稳定性和重复性试验 取H9、H6亚型AIV的cDNA及同一批PCR检测试剂于-30℃冰箱放置1和2个月,进行PCR检测。两次试验各做3个重复。扩增产物经1.5%琼脂糖凝胶电泳鉴定,验证该方法的稳定性和重复性。
1.2.8临床样品检测 运用建立的二重RTPCR检测方法对活禽市场采集的120份鸡、鸭咽喉及泄殖腔拭子进行检测,同时将病料处理后接种SPF鸡胚进行病毒分离鉴定,并进行HA基因全长的测定。将上述结果进行比较,验证二重RT-PCR的检测结果。
2 结果与分析
2.1二重RT-PCR条件的优化
通过对H9与H6亚型AIVHA基因2种引物浓度的测定及扩增温度时间等的优化,最终确定二重PCR最佳反应体系25μL:2×TransTaq-T PCR SuperMix 12.5μL,H9与H6亚型AIV cDNA共2μL,引物H9-F和H9-R(25pmol/μL)各0.5μL,引物H6-F及H6-R(25pmol/μL)各0.8μL,超纯水补至25μL。最终优化的反应条件为:94℃预变性3min;94℃变性30s,53℃退火45s,72℃延伸1min,共35个循环;72℃延伸5min,最后4℃结束反应。
2.2特异性试验
由图1可知,本试验建立的二重RT-PCR方法对H9及H6亚型AIV混合感染样品检测出2条特异性的条带,分别为551bp(H9亚型)及222bp(H6亚型);对H6N1、H6N2、H6N8亚型AIV检测结果仅出现1条特异性条带,片段大小为222bp;对H9N2与H9N6亚型AIV进行扩增也均只检测出1条特异性条带,片段大小为551bp;对其他亚型AIV和常见的禽病病原体均未扩增出任何条带,结果表明该方法具有良好的特异性。
2.3敏感性试验
由图2可知,运用本试验建立的二重RT-PCR方法针对5×109至5×101拷贝/μL的H9与H6亚型的AIV质粒模板进行扩增,结果显示,对浓度为5×109至5×104拷贝/μL的H9与H6亚型的AIV均有2条明显的特异性扩增条带出现,片段大小分别为551、222bp;对浓度≤5×103拷贝/μL的H9与H6亚型AIV均无扩增条带。由此可见,该法最低能检测到质粒模板量为5×104拷贝/μL的H9与H6亚型AIV。

图1 特异性试验结果Fig.1 The results of specificity test
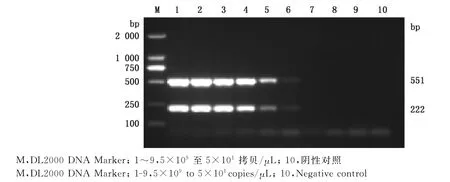
图2 敏感性试验结果Fig.2 The results of sensitivity test
2.4稳定性和重复性试验
由图3可知,运用本试验建立的二重RT-PCR方法对-30℃冰箱中放置1和2个月的H9、H6亚型AIV的cDNA及同一批PCR检测试剂进行检测,结果显示,对H9与H6亚型AIV仍能扩增出2条明显的特异性条带,片段大小分别为551、222bp,结果表明该方法稳定性和重复性良好。

图3 稳定性和重复性试验结果Fig.3 The results of repeatability and stability test
2.5 临床样品检测
运用该方法对广西动物疫病病原生物学与诊断重点实验室从南宁活禽市场采集的120份鸡和鸭口腔及泄殖腔的棉拭子样品进行检测,结果显示有6份样品为H9与H6亚型AIV阳性,阳性率为5%, 33份样品能扩增出551bp的目的条带,为H9Nx AIV,15份样品能扩增出222bp的目的条带,为H6Nx AIV,部分临床样品检测结果见图4。上述结果与病毒分离鉴定和HA基因测序结果100%相符,表明该方法具有一定的实用性。
Thanksgiving falls on the fourth Thursday of November, a different date every year.The President must proclaim that date as the official celebration.

图4 部分临床样品检测结果Fig.4 The detection results of some clinical samples
3 讨 论
H9与H6亚型AIV虽然为LPAIV,但有调查研究结果表明在部分地区健康青年体内检测到了H9与H6亚型AIV的抗体,这一结果表明H9与H6亚型禽流感在部分人群中存在隐性感染的情况[12-13]。近年来,有研究证实这两种LPAIV还为HPAIV提供内部基因[6-7],甚至出现了这两种亚型禽流感直接跨越种间屏障传染给人的案例[11,18-19],对公共卫生安全构成了极大的危害,从而引发了对这两种AIV研究的广泛关注。
近年来,广西动物疫病病原生物学与诊断重点实验室对广西地区家禽和野禽中不同亚型的LPAIV进行持续的流行病学监测,发现家禽和野禽感染H9与H6亚型LPAIV的比例较高,这与赵国等[20]对华东地区LPAIV的监测结果基本一致。H9与H6亚型毒株是否为广西地区流行的LPAIV提供内部基因尚不清楚,还有待于进一步深入调查与研究。目前,对于H9与H6亚型AIV的混合感染迫切需要一种能快速有效地检测和鉴别H9与H6亚型AIV的方法,为LPAIV流行病学的监测及研究两种AIV的遗传变异情况提供技术支撑。
传统的病原学分离鉴定与血清学检测方法操作相对复杂、耗时长且检测敏感度低,相对而言多重RT-PCR鉴于其方便快捷、灵敏度高等优点得到了更多的关注[15,21]。本研究成功建立了H9与H6亚型AIV二重RT-PCR检测方法,该方法一管的检测便可确定H9与H6亚型AIV的感染,也可确定单一H9或H6亚型AIV的感染,且其对H9及H6 AIV的检测下限均为5×104拷贝/μL,与罗思思等[14]、徐倩等[22]所建立的只能单独检测H9或H6亚型AIV的检测方法相比更为简便、快速。运用该方法针对H9与H6亚型AIV的HA基因都能扩增出与设计相符的特异性片段,针对其他亚型AIV及其他禽类疾病的扩增结果均为阴性,表明其特异性强;对该方法进行敏感性试验,最低可检测出5× 104拷贝/μL的H9与H6亚型AIV的模板量,表明其敏感性高。针对该方法进行稳定性和重复性试验的结果显示对同一批样品所做的3次重复性试验均能得到明显的目的条带,而试验样品在-30℃储存一段时间后再用于样品检测,其检测的效果并未发生改变,表明该方法稳定性和重复性良好。临床样品检测结果与血凝抑制试验的鉴定结果相符,表明其具有一定的实用性。
4 结 论
本试验建立了可同时鉴别检测H9和H6亚型AIV的二重RT-PCR方法,该方法特异性强、敏感性高、稳定性和重复性良好,为H9与H6亚型AIV的快速鉴别诊断提供了一种更为有效的检测方法。
参考文献:
[1] Tong S,Zhu X,Li Y,et al.New world bats harbor diverse influenza A viruses[J].PLoSPathog,2013,9(10):e1003657.
[2] Webster R G,Air G M,Metzger D W,et al.Antigenic structure and variation in an influenza virus N9 neuraminidase[J].JVirol,1987,61(9):2910-2916.
[3] Xie Z,Xie L,Zhou C,et al.Complete genome sequence analysis of an H6N1avian influenza virus isolated from Guangxi pockmark ducks[J].JVirol,2012,86(24):13868-13869.
[4] 罗思思,谢芝勋,谢志勤,等.H6N1亚型禽流感病毒二重荧光RT-PCR检测方法的建立[J].中国畜牧兽医,2016,43(2):326-332.
[5] 甘孟侯.禽流感[M].北京:北京农业大学出版社,2002.
[6] Liu D,Shi W,Shi Y,et al.Origin and diversity of novelavian influenza A H7N9viruses causing human infection:Phylogenetic,structural,and coalescent analyses[J].Lancet,2013,381(9881):1926-1932.
[7] Chen H,Yuan H,Gao R,et al.Clinical and epidemiological characteristics of a fatal case of avian influenza A H10N8virus infection:A descriptive study[J].Lancet,2014,383(9918):714-721.
[8] Liu D,Shi W,Gao G F.Poultry carrying H9N2act as incubators for novel human avian influenza viruses[J].Lancet,2014,383(9920):869.
[9] Xu W,Li X,Bai T,et al.A fatal case of infection with a further reassortant,highly pathogenic avian influenza(HPAI)H5N6virus in Yunnan,China[J].InfectGenetEvol,2016,40:63-66.
[10] Chin P S,Hoffmann E,Webby R,et al.Molecular evolution of H6influenza viruses from poultry in Southeasterm China:prevalence of H6N1influenza viruses possessing seven A/Hong Kong/156/97(H5N1)-like genes in poultry[J].JVirol,2002,76(2):507-516.
[11] Yuan J,Zhang L,Kan X Z,et al.Origin and molec-ular characteristics of a novel 2013avian influenza A(H6N1)virus causing human infection in Taiwan[J].ClinInfectDis,2013,57(9):1367-1368.
[12] 陈妍梅,葛万运,黄 川,等.广西健康青年H9、H6亚型禽流感病毒血清抗体调查[J].中国热带医学,2008,6:985-986.
[13] 梁 庆,李景东,陈煜生,等.潮汕地区健康青年H9、H6、H5亚型甲型流感病毒血清抗体调查[J].汕头大学医学院学报,2003,2:107-108.
[14] 罗思思,谢芝勋,谢志勤,等.H6N1亚型禽流感病毒二重RT-PCR检测方法的建立[J].畜牧与兽医,2015,47(8):24-27.
[15] 刘志杰,李如举,曾智勇,等.多重PCR反应的影响因素及其优化[J].黑龙江畜牧兽医,2011,13:26-28.
[16] Peng Y,Xie Z X,Liu J B,et al.Epidemiological surveillance of low pathogenic avian influenza virus(LPAIV)from poultry in Guangxi province,Southern China[J].PLoSOne,2013,8(10):e77132.
[17] Hoffmann E,Stech J,Guan Y,et al.Universal primer set for the full-length amplification of all influenza A viruses[J].ArchVirol,2001,146(12):2275-2289.
[18] Fusaro A,Monne I,Salviato A,et al.Phylogeography and evolutionary history of reassortant H9N2viruses with potential human health implications[J].J Virol,2011,85(16):8413-8421.
[19] 范胜涛.野鸟禽流感监测及哺乳动物跨种传播能力评估[D].北京:北京协和医学院,2014.
[20] 赵 国,刘晓文,钱忠明,等.2002—2009年中国华东地区家禽低致病性禽流感的病原学检测与分析[J].中国农业科学,2011,44(1):153-159.
[21] 刘婷婷,谢芝勋,宋德贵,等.H3亚型禽流感病毒巢式PCR检测方法的建立[J].中国畜牧兽医,2014,41(11):85-89.
[22] 徐 倩,谢芝勋,谢丽基,等.禽流感病毒H9N2亚型三重PCR检测方法的建立[J].中国畜牧兽医,2014,41(11):58-62.
(责任编辑 董晓云)
中图分类号:S852.65
文献标识码:A
文章编号:1671-7236(2016)12-3101-06
doi:10.16431/j.cnki.1671-7236.2016.12.003
收稿日期:2016-04-25
基金项目:国家“万人计划”领军人才专项(2016-37-88);广西科技项目(2013GXNSFDA019015、AD163800009、14123001-8);广西水产畜牧局科研项目(桂渔牧科201204930、201452001)
作者简介:李 丹(1990-),女,广西桂林人,硕士生,研究方向:微生物学,E-mail:1176231278@qq.com
通信作者:*谢芝勋(1963-),二级研究员,硕士生导师,研究方向:预防兽医学,E-mail:xiezhixun@126.com
Development of a Duplex RT-PCR Assay for Detection of H9and H6Subtype AIV
LI DAN1,XIE Zhi-xun2*,SONG De-gui1,LI Meng2,XIE Zhi-qin2,LUO Si-si2,XIE Li-ji2,HUANG Li2,FAN Qing2,HUANG Jiao-ling2
(1.CollegeofLifeSciences,GuangxiNormalUniversity,Guilin541000,China;2.GuangxiKeyLaboratoryofVetrinaryBiotechnology,GuangxiVeterinaryResearchInstitute,Nanning530001,China)
Abstract:This experiment was aimed to develop a method for simultaneous detection of H9and H6subtype avian influenza virus(AIV).Two pairs of specific primers were designed according to the conserved regions sequences of H6and H9AIVHAgene,a duplex RT-PCR simultaneous detection of H9and H6subtype AIV was developed by optimizing the PCR system such as the concentration of different primers and annealing temperature.It showed that all samples could be amplified specific bands from H9subtype AIV single infection samples or H6subtype AIV single infection samples,and the samples mix infection these two subtypes AIV.No specific bands of the same sizes were amplified from genomic materials of other avian pathogens.The detection limit of the duplex RT-PCR was 5×104copies/μL.It suggested that this duplex RT-PCR assay was a specific,sensitive,stable and repeatable method for detection of H9and H6subtype of AIV,and could provide technical support for the monitoring of H9and H6subtype AIV.
Key words:avian influenza virus;H9subtype;H6subtype;duplex RT-PCR
