异烟肼致大鼠肝损伤使组蛋白H4低乙酰化
2016-02-15朱凌妍李玉红田慎谦冯福民
朱凌妍,李玉红,任 琦,田慎谦,王 悦,牛 琛,史 哲,冯福民
(华北理工大学公共卫生学院,河北省煤矿卫生与安全重点实验室,河北唐山 063000)
异烟肼致大鼠肝损伤使组蛋白H4低乙酰化
朱凌妍,李玉红,任 琦,田慎谦,王 悦,牛 琛,史 哲,冯福民
(华北理工大学公共卫生学院,河北省煤矿卫生与安全重点实验室,河北唐山 063000)
目的 探讨组蛋白H4乙酰化表达水平与异烟肼致大鼠肝损伤的关系。方法 成年SD大鼠ig给予异烟肼55 mg·kg-1,每天1次,连续3,7,10,14,21或28 d后处死。HE染色观察肝组织病理改变;比色法检测肝组织超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量;Western蛋白印迹法检测肝组织组蛋白H4K5和H4K8乙酰化水平;ELISA法检测肝组织组蛋白乙酰化酶(HAT)和去乙酰化酶(HDAC)活性。结果 与正常对照组相比,连续给异烟肼后肝组织中总SOD活性呈下降趋势,在28 d时最低(P<0.05);MDA含量于14 d后处于高水平状态(P<0.05);肝组织组蛋白H4K5和H4K8呈低乙酰化水平(P<0.05),至14 d时达到最低值(P<0.05)后略有升高。异烟肼处理3 d,即可见HAT活性显著降低(P<0.05),HDAC活性显著升高(P<0.05),至21 d时HAT和HDAC活性基本恢复至正常对照组水平。结论 异烟肼引起大鼠肝组织中组蛋白H4K5和H4K8呈低乙酰化状态,提示组蛋白H4低乙酰化可能参与异烟肼致大鼠肝损伤。
异烟肼;药物性肝损伤;组蛋白H4;组蛋白乙酰化
异烟肼作为WHO推荐的一线抗结核药物,最主要的不良反应为抗结核药物性肝损伤(anti-tuber⁃closis drug-induced liver injury,ADLI)[1]。在肝损伤的过程中,异烟肼的终极代谢产物肼和乙酰肼直接与肝细胞发生氧化应激反应,可能是引发ADLI的重要因素[2-3]。氧化应激反应可干扰组蛋白修饰的状态,影响疾病的发生发展[4-5]。组蛋白乙酰化作为组蛋白的主要修饰形式由组蛋白乙酰化酶(his⁃tone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)共同调控,前者激活基因,后者则抑制转录[6-8]。组蛋白H4是核心组蛋白成员之一,常在赖氨酸K5,K8,K16和K20位点发生乙酰化修饰。研究发现,组蛋白H4K5和H4K8乙酰化往往与基因转录有关[9]。随着组蛋白H4与肝脏疾病关系研究的深入,发现其乙酰化状态的改变参与了机体氧化应激和炎症等反应过程[10-11]。本研究分析异烟肼致大鼠肝损伤过程中氧化应激反应下组蛋白H4乙酰化的状态,旨在探索组蛋白H4乙酰化程度与异烟肼致大鼠肝损伤的关系。
1 材料与方法
1.1 试剂和仪器
异烟肼购自沈阳红旗制药有限公司(生产批号:1404022);兔抗乙酰化组蛋白H4K5和H4K8单抗、兔抗组蛋白H4单抗均购自美国Abcam公司;辣根过氧化物酶标记的抗兔IgG二抗购自西安晶彩生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)活性测试盒和丙二醛(malondial⁃dehyde,MDA)含量测试盒购自南京建成生物工程研究所;HAT和HDAC活性ELISA试剂盒购自北京冬歌博业生物科技有限公司。HITACHI 7600-020型全自动生化分析仪,日本日立公司;Bio-Rad电泳槽、半干式转膜仪,美国Bio-Rad公司;Fluro⁃Chem HD2凝胶成像系统,美国Proteinsimple公司;CA94089型连续光谱酶标仪,美国Molecular Devices分子仪器公司。
1.2 动物和分组
9周龄健康成年SPF级SD大鼠96只,体质量258~365g,雌雄各半,购自北京华阜康生物科技有限公司,动物许可证编号:SCXK(京)2009-0004,饲养于华北理工大学医学实验动物中心屏障实验室,饲养环境许可证编号:SYXK(冀)2010-0038。动物实验符合动物伦理委员会的规定(审批号:14-016)。依据随机分组法将大鼠分为异烟肼组48只和正常对照组48只。异烟肼组ig给予异烟肼55 mg·kg-1(参照成人用药量换算),每天1次,连续3,7,10,14,21或28 d后处死;正常对照组给予等体积蒸馏水,并在相同的时间点处死。各组每个时间点8只大鼠。
摘取大鼠肝后过肝门横切部分肝组织,4%多聚甲醛固定,常规脱水,包埋,切片,HE染色,光学显微镜下观察肝细胞病理学变化。根据肝组织损伤程度以半定量方法表示。1分:肝细胞淤血,出血;1分:肝细胞水样变;1分:炎症细胞浸润;3分:肝细胞坏死;计算大鼠肝组织损伤分值[12],进行统计学分析。
1.3 肝组织中SOD活性和MDA含量的检测
使用SOD活性测试盒及MDA含量检测试剂盒进行检测。取适量肝组织制成10%肝组织匀浆,考马斯亮蓝方法定量蛋白含量。
1.4 肝组织中组蛋白H4K5和H4K8乙酰化蛋白水平的检测
采用Western蛋白质印迹法测定。称取大鼠肝组织80~100 mg加入10倍体积的预冷RIPA裂解缓冲液,并将苯甲基磺酰氟按100∶1加入组织裂解液中,超声组织匀浆,4℃,12 000×g离心10 min,取上清,BCA试剂盒蛋白质定量。经15%聚丙烯酰胺凝胶电泳分离蛋白,然后利用半干式转膜仪将胶上的蛋白质转到PVDF膜上。5%脱脂奶粉室温下封闭1.5 h,分别用兔抗乙酰化H4K5和H4K8单抗(1∶10 000)和兔抗H4(1∶1000)单抗4℃孵育过夜,随后室温孵育二抗1.5 h,凝胶成像系统显像。用目的蛋白条带与内参蛋白H4条带积分吸光度值表示目的蛋白的相对表达水平。
1.5 肝组织中HAT和HDAC活性的检测
称取肝组织,加入适量的生理盐水制成1:5组织匀浆,800×g离心10 min,取上清,HAT和HDAC活性严格按照ELISA试剂盒说明书操作。
1.6 统计学分析
实验结果数据以x±s表示,采用SPSS 17.0统计软件包进行统计分析。正态性检验后做方差齐性检验,HAT和HDAC活性、H4K8和H4K5水平比较采用两因素析因方差分析,单独效应分析采用单因素方差分析,组间多重比较采用LSD法,各时间点异烟肼组和正常对照组比较采用独立样本t检验分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 异烟肼对大鼠肝组织病理变化的影响
大鼠肝组织HE染色光学显微镜下观察(图1),正常对照组肝细胞形态正常,排列规则,结构完整。异烟肼致大鼠3 d组未见明显的病理学改变;7 d和10 d组可见肝细胞肿胀,有轻微炎症细胞聚集;14,21和28 d组肝细胞胞浆疏松化,大部分呈碎片状坏死,汇管区和坏死灶有大量的炎症细胞浸润,肝索消失。表明异烟肼致大鼠肝损伤造模成功,能直观反映出肝损伤的发生。表1为半定量分析结果,随给药时间的延长,异烟肼引起的肝组织损伤逐渐加重。

Fig.1 Effect of isoniazid(INH)on liver histopathologi⁃cal changes in SD rats(HE staining,×200).The rats were ig given INH 55 mg·kg-1once daily for 3,7,10,14,21 or 28 d,respectively.A:normal control group;B-G:INH-treated for 3,7,10,14,21 and 28 d,respectively.The black arrows indicate inflammatory cells infiltration;the white arrow indicates liver cell swelling and hepatic cords disappeared.
2.2 异烟肼对大鼠肝组织SOD活性和MDA含量的影响
与正常对照组相比,给予异烟肼后各个时间点大鼠肝SOD活性总体降低(P<0.05),在28 d组下降至最低(F=3.318,P=0.013)。肝组织中MDA含量在14,21和28 d显著升高(P<0.05)(图2),提示异烟肼的代谢产物作用于大鼠肝细胞,使肝细胞发生了过氧化反应。

Tab.1 Effect of INH on score of liver injury of rats
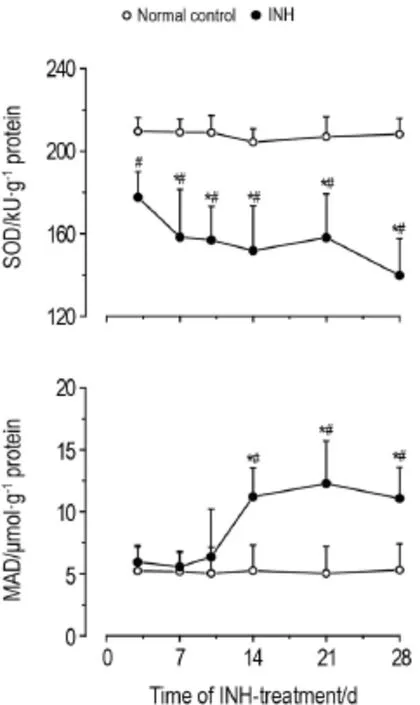
Fig.2 Effect of INH on superoxide dismutase(SOD) activity and malondialdehyde(MDA)content in liver tissue of rats.See Fig.1 for the rat treatment.SOD activity and MDA content were detected by colorimetric method.±s,n=8. *P<0.05,compared with the 3 d group(SOD)or the 10 d group (MDA);#P<0.05,compared with corresponding normal control group.
2.3 异烟肼对大鼠肝组织组蛋白H4K5和H4K8乙酰化水平的影响
图3结果表明,与正常对照组相比,异烟肼组大鼠肝组织组蛋白H4K5和H4K8呈低乙酰化水平(F值分别为141.69和50.41,均P<0.001);在不同的给药天数后,大鼠肝组织中组蛋白H4K5和H4K8皆发生不同程度去乙酰化过程(F=2.41,P=0.043;F=2.45,P=0.04),乙酰化水平下降;经析因分析发现,异烟肼因素和时间因素存在交互效应,表明随着给药时间的延长,异烟肼及其代谢产物干扰了组蛋白H4K5和H4K8的乙酰化状态,加速肝损伤的发生。正常对照组两指标的变化在各时间点均无明显差异。

Fig.3 Effect of INH on global histone H4K5(A)/H4K8(B)acetylation levels in liver tissue of SD rats detected by Western blotting.See Fig.1 for the rat treatment.H4K5ac and H4K8ac:acetylated H4K5/H4K8.IA:integrated absorbance. B1 and B2 were the semi-quantitative results of A1 and A2,respec⁃tively.±s,n=8.*P<0.05,compared with corresponding normal control group;#P<0.05,compared with the 14 d group.
2.4 异烟肼对大鼠肝组织HAT和HDAC活性的影响
图4结果可见,与正常对照组相比,异烟肼组大鼠肝组织HAT呈低活性状态(P<0.05),HDAC呈高活性状态(P<0.05)。异烟肼处理3 d,HAT活性即显著降低(P<0.05),HDAC活性显著升高(P<0.05),至21 d时HAT和HDAC活性基本恢复至正常对照组水平。正常对照组两指标在各时间点均无显著变化。异烟肼因素和时间因素存在交互效应,表明随着给药时间的延长,HAT和HDAC蛋白动态表达的失衡,影响组蛋白H4K5、H4K8的乙酰化状态。结果提示,异烟肼可能通过干扰HAT和HDAC的活性影响组蛋白H4乙酰化的状态。

Fig 4.Effect of INH on histone acetyltransferase(HAT)and histone deacetylase(HDAC)activities in liver tissue of SD rats detected by ELISA.See Fig.1 for the rat treatment.x±s,n=8.*P<0.05,compared with corre⁃sponding normal control group;#P<0.05,compared with the 21 d group.
3 讨论
本研究结果表明,异烟肼诱导肝损伤大鼠模型的肝组织中组蛋白H4呈低乙酰化状态,与正常对照组相比HAT活性较低,HDAC活性增强,表明组蛋白H4低乙酰化状态可能参与到异烟肼致肝损伤。
研究报道,组蛋白H4乙酰化修饰所引起的染色质结构改变与真核生物基因的表达调控密切相关[13],是基因转录的一个重要因素,也是一些疾病发生发展的诱因之一。有关肝相关疾病的研究表明,组蛋白H3和H4乙酰化的改变与酒精性肝损伤有关[14-16];组蛋白H4乙酰化状态在肝细胞肝癌的发病机制中充当了重要的角色;在乙型肝炎病毒相关肝功能衰竭中,循环组蛋白H3和H4作为内源性损伤相关分子对肝细胞的损伤发挥着作用[17]。本研究结果表明,连续给予异烟肼使大鼠出现肝损伤,且在28 d内呈逐渐加重状态。光学显微镜下观察发现,在异烟肼的刺激下大鼠肝细胞损伤逐渐严重,由轻微的炎症细胞出现到大量聚集,并出现碎片状坏死及肝索消失。在此期间与正常对照组相比,异烟肼处理组组蛋白H4K5和H4K8呈现明显的低乙酰化状态。据报道,高水平的氧化应激反应可抑制整体组蛋白乙酰化程度[4]。本研究结果表明,随着给异烟肼时间的延长,大鼠肝组织中SOD活性呈下降趋势,而MDA含量在14 d之后一直处于较高水平,提示异烟肼的代谢产物作用于大鼠肝细胞造成了氧化损伤。同时组蛋白H4K5和H4K8乙酰化程度呈逐渐降低的趋势,于14 d处于最低水平状态,提示异烟肼药物代谢过程可能影响了组蛋白H4乙酰化状态,推测其或参与到肝损伤的发生过程中。
组蛋白的乙酰化修饰是一个动态可逆的过程,由HAT和HDAC共同调节,HAT通过将乙酰辅酶A上的乙酰基转移到组蛋白氨基端特定的赖氨酸残基上完成乙酰化修饰。HAT和HDAC通过乙酰化调控一系列转录因子的活性,参与疾病异常基因的表达[6]。许多证据提示,上述机制的失调参与了肝病的发生发展过程。在酒精性肝病的研究中认为,乙醇在肝中的代谢过程需要乙酰辅酶A参与,大量的乙醇代谢会改变乙酰辅酶A的正常表达,进而或影响组蛋白乙酰化状态,而引致酒精性肝损伤[18]。本研究结果表明,异烟肼的代谢过程同样需要乙酰辅酶A的参与。异烟肼处理3 d即可见HAT活性降低,HDAC活性增强,异烟肼可能通过影响HAT与HDAC间的平衡改变了组蛋白H4的乙酰化状态。
综上所述,组蛋白H4在异烟肼的刺激下呈低乙酰化状态,可能参与到异烟肼致大鼠肝损伤的过程中。对于组蛋白H4低乙酰化与异烟肼致大鼠肝损伤的关系仍需更深入的研究论证,为今后的ADLI预防性治疗提供更详尽的依据。
参考文献:
[1]Jaswal A,Sinha N,Bhadauria M,Shrivastava S,Shukla S.Therapeutic potential of thymoquinone against anti-tuberculosis drugs induced liver damage[J].Environ Toxicol Pharmacol,2013,36(3):779-786.
[2]Boelsterli UA,Lee KK.Mechanisms of isoniazidinduced idiosyncratic liver injury:emerging role of mitochondrial stress[J].J Gastroenterol Hepatol,2014,29(4):678-687.
[3]Enriquez-Cortina C,Almonte-Becerril M,Clavijo-Cornejo D,Palestino-Domínguez M,Bello-Monroy O,Nuño N,et al.Hepatocyte growth factor protects against iso⁃niazid/rifampicin-induced oxidative liver damage[J].Toxicol Sci,2013,135(1):26-36.
[4]Berthiaume M,Boufaied N,Moisan A,Gaudreau L. High levels of oxidative stress globally inhibit gene transcription and histone acetylation[J].DNA Cell Biol,2006,25(2):124-134.
[5]Mann DA.Epigenetics in liver disease[J].Hepatology,2014,60(4):1418-1425.
[6]Gräff J,Tsai LH.Histone acetylation:molecular mnemonics on the chromatin[J].Nat Rev Neurosci,2013,14(2):97-111.
[7]Yun MY,Wu J,Workman JL,Li B.Readers of histone modifications[J].Cell Res,2011,21(4):564-578.
[8]Li B,Carey M,Workman JL.The role of chromatin during transcription[J].Cell,2007,128(4):707-719.
[9]Wang W,Meng ZQ,Shi FX.Modification and bio⁃logical role of histone[J].Hereditas(遗传)2012,34(7):810-818.
[10] Shahbazian MD,Grunstein M.Functions of sitespecific histone acetylation and deacetylation[J].Annu Rev Biochem,2007,76(76):75-100.
[11]Wang Y,Yang Y,Luo Y,Yin Y,Wang Q,Li Y,et al.Aberrant histone modification in peripheral blood B cells from patients with systemic sclerosis[J].Clin Immunol,2013,149(1):46-54.
[12]Guan TM,Liu DC,Wang JF,Cai S,Lin MJ,Lu RR,et al.Protective effect of extract from fruit ofClausena lansium(Lour.)Skeels against acute alcohol-induced hepatotoxicity in mice[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志)2012,26(6):829-834.
[13]Pote N,Alexandrov T,Le Faouder JA,Leger T,Mebarki M,Belghiti J,et al.Imaging mass spec⁃trometry reveals modified forms of histone H4 as new biomarkers of microvascular invasion in hepa⁃tocellular carcinomas[J].Hepatology,2013,58(3):983-994.
[14]Holownia A,Mroz RM,Wielgat P,Jakubow P,Jablonski J,Sulek J,et al.Histone acetylation and arachidonic acid cytotoxicity in HepG2 cells overexpressing CYP2E1[J].Naunyn Schmiede⁃bergs Arch Pharmacol,2014,387(3):271-280.
[15]Zheng X,Gai XH,Ding FH,Lu ZT,Tu KS,Yao YM,et al.Histone acetyltransferase PCAF upregulated cell apoptosis in hepatocellular carcinoma via acetylating histone H4 and inactivating AKT signaling[J].Mol Cancer,2013,12(1):2418-2419.
[16]Gupta M,Ansell SM,Novak AJ,Kumar S,Kaufmann SH,Witzig TE.Inhibition of histone deacetylase overcomes Rapamycin-mediated resistance in diffuse large B-cell lymphoma by inhibiting Aktsignaling through mTORC2[J].Blood,2009,114(14):2926-2935.
[17] Jiang X,Gao L.Study on the injury effects and mechanisms of circulating histones on the hepatocytes of patients with hepatitis B virus-related liver failure[J].Chin J Infect Dis(中华传染病杂志),2014,32(7):420-424.
[18]Park PH,Miller R,Shukla SD.Acetylation of his⁃tone H3 at lysine 9 by ethanol in rat hepatocytes[J].Biochem Biophys Res Commun,2003,306(2):501-504.
Hypoacetylation of histone H4 during isoniazid-induced liver injury in rats
ZHU Ling-yan,LI Yu-hong,REN Qi,TIAN Shen-qian,WANG Yue,NIU Chen,SHI Zhe,FENG Fu-min
(Hebei Provincical Key Laboratory of Occupational Health and Safety for Coal Industry,School of Public Health,North China University of Science and Technology,Tangshan 063000,China)
OBJECTIVE To investigate the relationships between acetylated histone H4 and isoniazid-induced liver injury in rats.METHODS Adult SD rats were ig given isoniazid 55 mg·kg-1once daily for 3,7,10,14,21 or 28 d,respectively.Pathological examination of liver tissue was observed by HE staining.The activity of superoxide dismutase(SOD)and content of malondialdehyde(MDA)of liver tissue were detected by biochemical method.Western blot was used to measure the expressions of acetylated H4k5/H4k8 in the liver.The activities of histone acetyltransferase(HAT)and histone deacet⁃ylase(HDAC)of liver tissue were detected by ELISA.RESULTS Compared with the control group af⁃ter isoniazid was ig given continuously,SOD activity in liver tissue showed a downward trend and was the lowest on the 28thday(P<0.05),while MDA content reached a high level after 14 d(P<0.05).Acety⁃late level of histone H4 at Lys5and Lys8was lower(P<0.05)and reached the lowest level on the 14thday(P<0.05),and then became a slightly higher.Three days after isoniazid was ig given,the liver activities of total HDAC increased(P<0.05)and HAT decreased significantly(P<0.05),but the activities of both returned to normal on the 21stday.CONCLUSION Isoniazid inhibits acetylation of histone H4 at Lys5and Lys8,which suggests that hypoacetylation of histone H4 may be involved in isoniazid-induced acute liver injuries in rats.
isoniazid;drug-induced liver injury;histone H4;histone acetylation
FENG Fu-min,Tel:13931482536,E-mail:fm_feng@sina.com
R978.3
A
1000-3002-(2016)11-1192-06
10.3867/j.issn.1000-3002.2016.11.010
Foundation item:The project supported by Natural Science Foundation of Hebei Province(H2016209300)
2016-02-27接受日期:2016-11-10)
(本文编辑:齐春会)
河北省自然科学基金(H2016209300)
朱凌妍,女,硕士研究生,主要从事传染病防治研究;冯福民,教授,博士生导师,主要从事传染病防治研究。
冯福民,Tel:13931482536,E-mail:fm_feng@ sina.com
