信号传导及转录激活子3通路参与卷烟烟气凝集物诱导永生化人支气管上皮细胞的恶性转化
2016-02-15袁娜娜陈余清张佳秀周继红王效静朱茂祥潘秀颉杨陟华顾永清
袁娜娜,李 伟,陈余清,张佳秀,洪 磊,蒋 鹏,周继红,王效静,朱茂祥,潘秀颉,杨陟华,顾永清
(蚌埠医学院1.第一附属医院呼吸与危重症医学科,安徽呼吸系病临床基础省级实验室,3.生物化学与分子生物学教研室,安徽蚌埠 233004;2.阜阳市第二人民医院呼吸内科,安徽阜阳 236015;4.军事医学科学院放射与辐射医学研究所,北京 100850)
信号传导及转录激活子3通路参与卷烟烟气凝集物诱导永生化人支气管上皮细胞的恶性转化
袁娜娜1,2,李 伟1,陈余清1,张佳秀1,洪 磊1,蒋 鹏1,周继红3,王效静1,朱茂祥4,潘秀颉4,杨陟华4,顾永清4
(蚌埠医学院1.第一附属医院呼吸与危重症医学科,安徽呼吸系病临床基础省级实验室,3.生物化学与分子生物学教研室,安徽蚌埠 233004;2.阜阳市第二人民医院呼吸内科,安徽阜阳 236015;4.军事医学科学院放射与辐射医学研究所,北京 100850)
目的 检测肺鳞癌组织、鳞状细胞不典型增生组织和癌旁组织中磷酸化信号传导及转录激活子3(pSTAT3)蛋白的表达,比较其表达与吸烟的关系;探讨STAT3通路在烟草诱导细胞恶性转化过程中的作用。方法 免疫组化法检测288例肺鳞癌组织、108例鳞状细胞不典型增生组织、112例癌旁组织中pSTAT3蛋白的表达,比较其表达与吸烟的相关性。构建卷烟烟气凝集物(CSC)诱导第10,20,30,40,50,60及70代细胞(P10,P20,P30,P40,P50,P60及P70)永生化人支气管上皮细胞(BEP2D)恶性转化模型。从血清抗性及锚着独立性等方面对CSC诱导各代BEP2D细胞的恶性转化特征进行鉴定。Western蛋白印迹法检测CSC诱导各代BEP2D细胞中pSTAT3的表达。MTT法和流式细胞术分别检测JSI-124 0.25~10 μmol·L-1对P70细胞存活及凋亡的影响。JSI-124处理CSC诱导P70 24 h后检测存活蛋白表达的变化。结果 pSTAT3蛋白在肺鳞癌组织中表达高于鳞状细胞不典型增生和癌旁组织(P<0.05);pSTAT3在目前吸烟者中的表达均高于曾经吸烟者和从不吸烟者(P<0.05),且随着吸烟指数增加两者表达水平逐渐升高(P<0.01)。随着转化代数的增高,细胞血清抗性增加,锚着独立性增强,P30细胞以后尤为明显。pSTAT3在正常对照组和乙醇对照组中弱表达,且两者之间无显著性差异;CSC诱导的各组BEP2D细胞中,pSTAT3的表达均显著高于正常对照组和乙醇对照组(P<0.05),并随细胞代数的增高而增高。JSI-124抑制P70细胞增殖、促进P70细胞凋亡呈浓度及时间依赖性。JSI-124 1 μmol·L-1作用P70细胞24 h后,存活蛋白表达显著降低(P<0.05)。结论 STAT3信号通过调控存活蛋白表达抑制细胞凋亡,参与烟草诱导永生化人支气管上皮细胞的恶性转化。
信号传导及转录激活子3;卷烟烟气凝集物;永生化人支气管上皮细胞
吸烟是肺癌发生的重要危险因素[1]。点烟后可产生4-甲基亚硝胺基-3-吡啶-1-丁酮〔4-(methylni⁃trosamino)-1-(3-pyridyl)-1-butanone,NNK)、尼古丁和多环芳烃等70多种致癌物[2]。研究表明,卷烟烟气中的致癌物可活化丝裂原活化蛋白激酶(mito⁃gen-activated protein kinase,MAPK)[3],丝苏氨酸蛋白激酶蛋白激酶B/哺乳动物西罗莫司(雷帕霉素)靶蛋白〔protein kinase B/mammalian target of sirolimus(Rapamycin),Akt/mTOR〕[4-5]及酪氨酸激酶Janus激酶/信号传导及转录激活子3(Janus kinase/signal transducer and activator of tran⁃scription 3,JAK/STAT3)[6]等信号通路,导致细胞增殖异常和凋亡障碍等,从而诱发癌症的发生发展。STAT3是白细胞介素6/酪氨酸激酶和表皮生长因子受体等多个致癌性酪氨酸激酶信号通路汇聚的焦点,其磷酸化表达与肺癌和胃癌等多种肿瘤细胞的异常增殖密切相关[2,7]。Guo等[8]报道,尼古丁和NNK能上调非小细胞肺癌细胞株中磷酸化STAT3(pSTAT3)表达,进而增强其生长潜能。通过对靶基因的调控,STAT3参与肿瘤的免疫逃逸、细胞凋亡、增殖分化、血管新生及侵袭转移等活动[9-12]。Nagpal等[13]发现,STAT3活化是烟草相关的口腔鳞癌发生的早期事件。Liu等[6]发现,即STAT3水平在烟草凝集物作用支气管上皮细胞24 h显著增高。目前,烟草致癌机制研究多采用短期诱导细胞模型,本研究利用卷烟烟气凝集物(ciga⁃rette smoke condensate,CSC)长期诱导的细胞模型观察STAT3通路在烟草诱导支气管上皮细胞恶性转化过程中的作用并通过组织研究加以验证。
1 材料与方法
1.1 试剂和主要仪器
LHC-8无血清培养基和胎牛血清购自美国Gibco公司;HAM′S/F-12培养基购自美国HyClone公司;鼠抗人STAT3单克隆抗体、兔抗人磷酸化Y705单克隆抗体和兔抗人存活蛋白单克隆抗体购自美国Abcam公司;STAT3特异性抑制剂JSI-124购自美国Calbiochem公司;兔抗β肌动蛋白IgG多克隆抗体和山羊抗小鼠单克隆二抗和山羊抗兔单克隆二抗均购自中国武汉博士德公司;逆转录试剂盒购自美国Thermo公司;PCR试剂盒购自中国天根生化科技有限公司;AnnexinⅤ-FITC细胞凋亡检测试剂盒购自中国碧云天生物公司;引物由中国上海生工生物工程有限公司合成。芙蓉王香烟购自湖南中烟工业公司常德卷烟厂。PCR仪、UV凝胶成像系统购于美国Bio-Rad公司。Flour Chem FC3型多功能凝胶成像分析系统购于美国Protein Simple公司。Alpha View图像分析软件为美国Al⁃pha公司产品。
1.2 临床组织样本检测
1.2.1 组织标本
收集蚌埠医学院第一附属医院病理科2008.1-2013.7经纤支镜活检(84例)和手术切除肺鳞癌标本(204例)共288例、癌旁正常组织标本112例,气管镜活检鳞状细胞不典型增生标本108例。所有患者采集标本前均未经放疗、化疗、靶向治疗及免疫治疗。所有标本均有完整的临床病理资料如性别、年龄、吸烟状况、吸烟指数、有无淋巴结转移、临床分期、组织学分级。所有确诊肺癌患者的临床分期情况根据影像学资料(胸部CT、PET-CT和全身骨ECT等)、临床体格检查及EBUS-TBNA等综合评价。参照相关文献[14]将吸烟者按吸烟状况不同分为从不、曾经和现在吸烟者。从不吸烟者定义为终生吸烟剂量<100支;戒烟>1年者为曾经吸烟者;目前吸烟者是指目前仍吸烟者或着戒烟<1年者。吸烟指数是指每天吸烟的包数(1包=20支)和吸烟年数的乘积。本研究获得了蚌埠医学院第一附属医院伦理委员会批准,同时标本采集得到了患者的知情同意。
1.2.2 免疫组化染色检测肺鳞癌组织、鳞状细胞不典型增生组织及癌旁组织中pSTAT3蛋白的表达
对所有石蜡包埋标本,4 μm连续切片。石蜡切片经脱蜡,水化,PBS冲洗,滴加一抗50 μL(阴性对照采用PBS代替一抗),4℃过夜,PBS冲洗;滴加二抗,37°C孵育30 min,PBS冲洗,DAB显色,蒸馏水洗,复染(苏木精染色,1%盐酸分化,自来水冲洗),脱水,透明,封片。采用双盲法,由2名病理科医师分别观察切片。采用半定量积分法[14]判定结果,首先按照着色强度评分:标本无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;再按照阳性细胞在所观察细胞中所占比例评分:阳性细胞数≤10%为1分,11%~50%为2分,51%~75%为3分,≥75%为4分。每张切片最后的得分为两次评分的乘积(1~12分),≥3分为阳性,<3分为阴性。
1.3 细胞实验
1.3.1 永生化人支气管上皮细胞(immortalized human bronchial epithelial cells,BEP2D)的培养
由美国国立癌症研究所Hatris教授提供,由美国哥伦比亚大学放射生物研究中心Dr.Hei TK处引进,军事医学科学院放射与辐射医学研究所朱茂祥教授馈赠。该细胞是经人乳头状瘤病毒(human palilloma-viruses 18,HPV-18)转染的正常成人支气管上皮细胞(normal adult human bronehiall epithelia cells,NHBE),均具有无限增殖能力,但无恶性转化的表型特征。细胞用LHC-8无血清培养液,在37℃,5%CO2饱和湿度条件下细胞培养箱培养,细胞传代时,用含0.25%胰酶和0.02%EDTANa2的PBS液消化。2 d换液1次,每5~6 d传代。
1.3.2 CSC的提取及细胞染毒液的配制
实验运用HRH-SM120型单通道吸烟机,条件设定为:抽吸支数为1支,抽吸时间为20 s,抽吸周期为30 s,连接2个密封的玻璃收集管,第1管内装有5 mL 95%乙醇,第2管内装有5 mL LHC-8培养液,点烟(焦油标识量为每支11 mg,尼古丁量为每支1.2 mg),将卷烟的主流烟气连续导入玻璃收集管。按照设定的条件,连续点燃10支烟,待最后1支烟吸完,玻璃管内气体变淡以后,将2个玻璃管中的收集液混在一起,充分混匀后分装在2 mL冻存管中,收集的CSC浓度为每支烟1 mL,作为母液放液氮中储藏备用。
卷烟烟气经过95%乙醇(有机相)和LHC-8培养液(无机相),分别溶解烟气中的有机和无机成分,采用LHC-8稀释到染毒所需浓度后进行细胞染毒,这样CSC在一定程度上代表了主流烟气中的主要成分[14]。
1.3.3 细胞染毒
从液氮罐中取出CSC母液,待其完全融化,用0.22 mm过滤器过滤原液后,使用LHC-8培养液把CSC原液分次稀释至实验浓度,加入待染毒细胞的培养瓶中。在37℃,5%CO2饱和湿度条件下细胞培养箱培养24 h,经PBS洗涤细胞后,换用不含CSC的LHC-8培养液继续培养,直至细胞长满后传代,即完成一代细胞的染毒,每染毒10代留取细胞株,分别为第10代(P10),P20,P30,P40,P50,P60和P70。实验同时设BEP2D细胞(正常对照组)和乙醇5 mL·L-1处理组(乙醇对照组),共9组细胞。
1.3.4 血清抗性
常规消化指数生长期的1.3.3中9组细胞,用LHC-8培养液梯度稀释成单个细胞悬液后,精确计数;分别以每皿300个细胞接种到60 mm平皿中,每组设6个平行样,其中3个皿加入5.0 mL含10%胎牛血清的LHC-8培养液,另外3个皿加入5.0 mL不含血清的LHC-8培养液;在37℃,5%CO2和95%湿度环境下静止培养6 d;终止培养后无水甲醇固定,姬姆萨染色,冲洗晾干后显微镜下计数各平皿克隆数,按下式计算接种效率:接种效率(PE)(%)=(克隆数/接种细胞数)×100%;血清抗性= 10%血清培养时PE/无血清培养时PE。
1.3.5 锚着独立性
利用LHC-8培养液配制1.4%的琼脂糖,高温高压灭菌,41℃水浴锅中保温,加入预温的LHC-8培养液将其稀释为0.7%琼脂糖,以每皿3 mL 0.7%琼脂糖倒进60 mm培养皿中,铺制底层,待其凝固后备用。常规消化指数生长期1.3.3中的9组细胞,制备相应细胞培养液悬液。与保温的0.7%琼脂糖1∶1混匀,稀释为0.35%细胞琼脂混合液,加在培养皿0.7%琼脂糖胶上(细胞密度为每皿1.5×104),待细胞琼脂混合液凝固后,每皿中加入2 mL LHC-8培养液。每组设5皿;在5%CO2,37℃和饱和湿度环境下培养,3 d换液1次;4周后镜下计数,细胞>50个或直径>75 mm的克隆数,按以下公式计算克隆形成率(clone form efficiency,CFE),CFE(%)=(克隆数/接种细胞数)×100%。
1.3.6 RT-PCR检测CSC诱导BEP2D细胞恶性转化过程中STAT3和存活蛋白mRNA表达
采用TRIZOL A+法提取细胞总RNA。按照Thermo逆转录试剂盒合成cDNA。以新合成的cDNA为模板,建立PCR反应体系,STAT3 PCR反应步骤如下:94℃3 min,(94℃30 s,53.5℃30 s,72℃25 s)×26循环,72℃10 min,4℃5 min。存活蛋白PCR反应步骤如下:94℃3 min,(94℃30 s,53.5℃ 30 s,72℃ 25 s)×26循环,72℃10 min,4℃5 min。β肌动蛋白PCR反应步骤如下:94℃3 min,(94℃30 s,63.2℃30 s,72℃25 s)×30循环,72℃10 min,4℃5 min。数据采用Alpha View图像分析软件分析。以目的条带和β肌动蛋白吸光度值的比值表示目的基因的相对表达水平。
引物由生工生物工程有限公司合成。STAT3(86 bp)上游引物为5′-AGGAGGCGTCACTTTCACTT-3′,下游引物为5′-GCTGCTGCTTTGTG⁃TATGGT-3′;存活蛋白(139 bp)上游引物为5′-GCACCACTTCCAGGGTTTAT-3′,下游引物为5′-CTCTGGTGCCACTTTCAAGA-3′;β肌动蛋白(205 bp)上游引物为5′-TGACGTGGACATCCG⁃CAAAG-3′,下游引物为5′-CTGGAAGGTGGA⁃CAGCGAGG-3′。
1.3.7 Western蛋白印迹检测CSC诱导BEP2D细胞恶性转化过程中STAT3,pSTAT3和存活蛋白表达
收集各组细胞,用RIPA裂解液提取全细胞蛋白。经SDS-PAGE后半干转至PVDF膜,封闭液封闭1.5 h,加入一抗(STAT3,pSTAT3,存活蛋白,β肌动蛋白一抗用一抗稀释液分别以1∶5000,1∶15 000,1∶7500和1∶400稀释),4℃过夜;加山羊抗兔或鼠二抗(1∶4000),孵育90 min。ECL显影,凝胶成像仪下照相,以β肌动蛋白为内参,Alpha View图像分析软件目的条带和内参条带的吸光度值,以目的蛋白和β肌动蛋白积分吸光度值比值表示目的蛋白的相对表达水平。
1.3.8 MTT法检测细胞存活
用胰酶消化指数生长期的CSC染毒后P70 BEP2D细胞,用LHC-8培养液稀释成细胞悬液,准确计数;以每孔6×l03细胞接种于3块96孔培养板中,每孔体积200 μL,边缘孔用PBS填充,另外设置调零孔,只加培养液不加细胞;将培养板放入CO2孵箱中,在5%CO2,37℃和饱和湿度条件下静止培养24 h;以稀释成不同浓度的STAT3特异性抑制剂JSI-124(0,0.25,0.5,1,1.25和5 μmol·L-1)对P70细胞分别处理24,48和72 h,每个浓度设4个平行样,终体积保持200 μL;待每块板JSI-124处理时间分别达到24,48和72 h后,每孔加入20 μL MTT溶液(5 g·L-1),继续孵育4 h。终止培养,小心吸去各组每孔液体,每孔加入150 μL DMSO,避光置摇床上低速振荡10 min,使结晶物充分溶解。酶联免疫检测仪490 nm处测定各孔吸光值(absorbance,A490nm)计算各组细胞存活抑制率。细胞存活抑制率(%)=〔1-(实验组A490nm-调零组A490nm)/(DMSO对照组A490nm-调零组A490nm〕×100%。
1.3.9 流式细胞术检测细胞凋亡
将处于指数生长期的P70细胞分别加入JSI-124 0.5,1和5 μmol·L-1分别培养24,48和72 h;并分别将培养液吸出至离心管内,1000×g离心5 min,弃上清,收集已悬浮的发生凋亡或坏死的细胞;PBS洗涤培养瓶中贴壁细胞一次,加入适量胰酶细胞消化液消化细胞。室温孵育至轻轻吹打可以使贴壁细胞吹打下来时,将消化终止液加入培养瓶中,稍混匀以终止胰酶消化;将细胞混合液加入到之前的离心管中,1000×g离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数;取1×105重悬的细胞,1000×g离心5 min,弃上清,加入195 μL AnnexinⅤ-FITC结合液轻轻重悬细胞;再加入7 μL AnnexinⅤ-FITC,轻轻混匀;最后加入6 μL碘化丙啶染色液,轻轻混匀。室温避光孵育15 min,孵育过程中可重悬细胞2~3次以改善染色效果。随后置于冰浴中。1 h内进行流式细胞仪检测。
1.4 统计学分析
实验结果数据表示为x±s,采用SPSS19.0统计软件进行统计学分析,计数资料采用χ2检验,用χ2线性趋势检验检测组间是否存在线性关系。两变量相关性采用Spearman相关分析检测,均作双侧检验。计量资料两组之间比较采用两独立样本t检验,多组之间比较采用单因素方差分析,若总体均数有差异,进行组间两两比较的q检验。P<0.05作为差异具有统计学意义的界值。
2 结果
2.1 pSTAT3蛋白在鳞状细胞不典型增生组织和肺鳞癌组织中表达及与吸烟程度的关系
图1结果显示,pSTAT3蛋白阳性表达主要定位于细胞核和细胞浆,在肺鳞癌细胞中高表达,而在正常支气管上皮细胞中低表达或者不表达。表1结果显示,pSTAT3蛋白在正常支气管上皮组织、鳞状细胞不典型增生组织和肺鳞癌组织中阳性表达率分别为2.7%(3/112),37.0%(40/108),55.6%(160/288),差异具有统计学意义(P<0.05)。随着支气管上皮组织癌变过程的变化,pSTAT3蛋白的表达呈逐渐增高趋势(χ2=94.464,P<0.05)。表2和表3结果显示,pSTAT3蛋白在肺鳞癌中表达与吸烟状况和吸烟指数有关(P<0.05)。曾经吸烟者和现在吸烟者中pSTAT3表达水平高于从不吸烟者(χ2=36.754,P<0.05)。随着吸烟指数增高,pSTAT3表达量逐渐升高(χ2=83.751,P<0.05)。
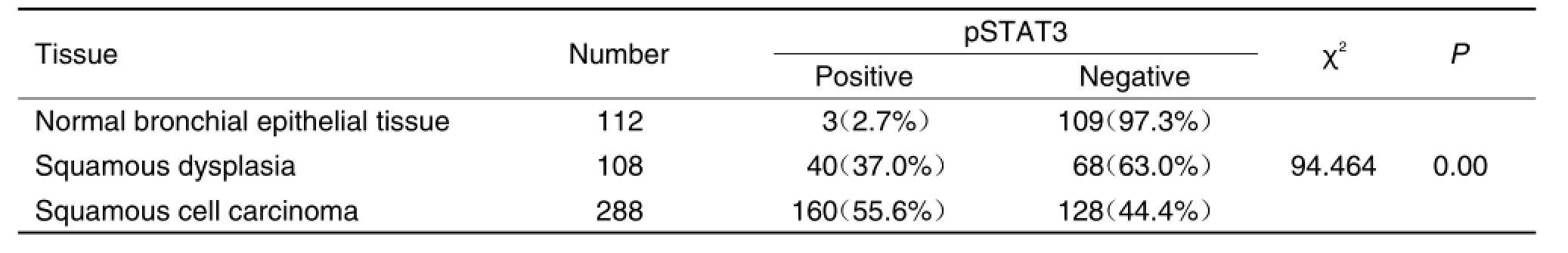
Tab.1 Expression of pSTAT3 in normal bronchial epithelial tissue,squamous dysplasia and squamous cell car⁃cinoma of lungs

Tab.2Relationships between incidence of pSTAT3 protein and smoking status in patients with lung squamous cell carcinoma

Tab3.Relationships between incidence of pSTAT3 pro⁃tein and smoking index in patients with lung squa⁃mous cell carcinoma
2.2 CSC诱导及传代次数对细胞血清抗性的影响
在有血清的条件下,正常对照组及乙醇对照组细胞生长明显受抑制,而CSC诱导各代细胞则有更高的接种效率。同正常对照及乙醇对照组相比,P30,P40,P50,P60和P70细胞均出现显著的对血清促分化能力的抗性(P<0.05)(表4)。

Tab.4 Effect of cigarette smoke condensate(CSC)induction and times of passage on plating efficiency and resistance to serum-induced terminal differentiation
2.3 CSC诱导及传代次数对细胞锚着独立性的影响
图2和表5结果显示,P10和P20细胞锚着独立性还较低,P30代以后细胞,锚着独立性显著升高,且所形成克隆形态明显增大,其克隆形成率与正常和乙醇对照组比较明显增加(P<0.05)。
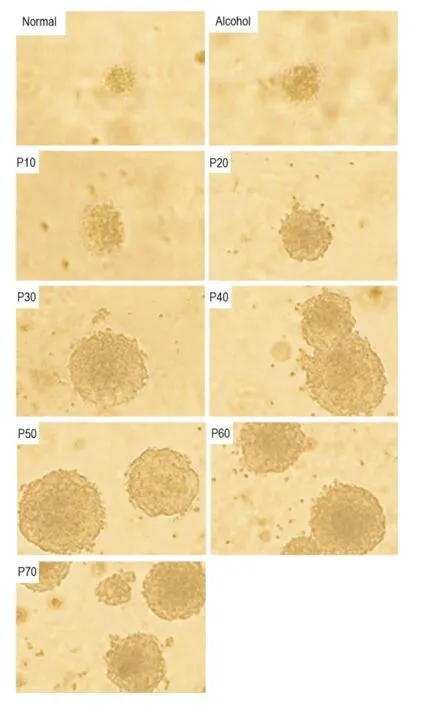
Fig.2 Effect of CSC induction and times of passage on clone morphology in soft agar(×200).

Tab.5 Effect of CSC induction and times of passage on clone morphology in soft agar
2.4 CSC诱导及传代次数对存活蛋白的mRNA水平的影响
图3结果显示,存活蛋白mRNA在正常对照组及乙醇对照组中不表达,在P20,P30,P40,P50,P60及P70细胞中表达呈逐渐增高趋势。

Fig.3 Effect of CSC induction and times of passage on level of survivin mRNA.B was the semi-quantitative re⁃sult of A.IA:integrated absorbance.±s,n=9.*P<0.05,com⁃pared with normal group;#P<0.05,compared with alcohol group.
2.5 CSC诱导及传代次数对pSTAT3和存活蛋白表达的影响
图4结果显示,STAT3蛋白在各组细胞中表达的总体均数无显著性差异。STAT3磷酸化水平在正常对照组和乙醇对照组中最低,两组之间无差异。在CSC诱导各组BEP2D细胞中显著高于正常对照组和乙醇对照组(P<0.05)。STAT3磷酸化水平在各组间随染毒代数的增加而增加。存活蛋白在正常对照组和乙醇对照组中不表达,在P20,P30,P40,P50,P60和P70细胞中表达呈逐渐增高趋势。
2.6 JSI-124抑制P70细胞增殖
图5结果显示,当以同一浓度JSI-124处理P70细胞24,48和72 h,JSI-124对细胞的抑制率随时间增加而增高。当不同浓度(0.25,0.5,1.0,1.25,5.0和10 μmol·L-1)JSI-124处理P70细胞同一时间时,JSI-124对细胞的抑制率随浓度增加而增高。说明JSI-124抑制P70细胞存活呈浓度依赖性(r24h= 0.933,P<0.01;r48h=0.97,P<0.01;r72h=0.968,P<0.01;n=18)及时间依赖性,r0.25μmol·L-1=0.811,P<0.01;r0.5μmol·L-1=0.813,P<0.01;r1μmol·L-1=0.87,P<0.01;r1.25μmol·L-1=0.912,P<0.01;r5μmol·L-1=0.971,P<0.01;r10μmol·L-1=0.97,P<0.01;n=9)。

Fig.4 Effect of CSC induction and times of passage on expression of STAT3(A),pSTAT3(B)and survivin(C)protein.±s,n=9.*P<0.05,compared with normal group;#P<0.05,compared with alcohol group.

Fig.5 Effect of JSI-124 on P70 cell survival by MTT assay.±s,n=18(for different time);n=9(for different concentration).
2.7 JSI-124促进P70细胞凋亡
图6结果显示,当不同浓度JSI-124处理P7024h时,P70的总凋亡率分别是(6.8±0.8)%(0 μmol·L-1),(10.2±0.6)%(0.5μmol·L-1),(12.8±0.9)%(1μmol·L-1)和(17.0±1.5)%(5μmol·L-1),表明P70的总凋亡率随处理浓度的增加而增加(P<0.05)。图7结果显示,当处理时间不同,浓度为1 μmol·L-1,P70细胞的总凋亡率分别是(6.5±0.6)%(0 h),(12.8±0.9)%(24 h),(28.2±0.8)%(48 h)和(51.2±1.3)%(72 h),表明P70的总凋亡率随处理时间的增加而增加(P<0.05)。说明JSI-124促进P70凋亡呈浓度(r=0.961,P<0.01,n=12)及时间(r=0.968,P<0.01,n=12)依赖性。

Fig.6 Effect of JSI-124 on apoptosis of P70 treated for 24 h.

Fig.7 Effect of JSI-124 1 μmol·L-1on apoptosis of P70 for different length of time.
2.8 JSI-124对P70细胞存活蛋白和STAT3基因和蛋白表达的影响
图8和图9结果显示,与正常对照组相比,JSI-124 1 μmol·L-1作用P70细胞24 h,STAT3 mRNA及蛋白表达无显著变化,但pSTAT3蛋白表达下降(P<0.05),存活蛋白mRNA及蛋白表达均下降(P<0.05)。

Fig.8 Effect of JSI-124 on mRNA level of STAT3(A)and survivin(B)in P70 by RT-PCR.Lane 1:JSI-124 1 μmol·L-1;Lane 2:JSI-124 0 μmol·L-1.C was the semi-quanti⁃tative result of A and B.±s,n=3.*P<0.05,compared with normal control(0)group.

Fig.9 Effect of JSI-124 on STAT3,pSTAT3 and survivin protein in P70 by Western blotting(A).B was the semiquantitative result of A.±s,n=3.*P<0.05,compared with normal control(0)group.
3 讨论
本研究发现,随着支气管上皮组织癌变程度增加,pSTAT3蛋白表达呈逐渐增高趋势,在肺鳞癌组织中表达最高。提示pSTAT3在肺鳞癌发生中起着重要作用,这在食管癌和宫颈癌研究中也有类似的报道。pSTAT3表达与患者吸烟暴露密切相关。肺鳞癌中pSTAT3蛋白表达与吸烟状态和吸烟剂量呈正相关,且曾经吸烟者和现在吸烟者中pSTAT3表达均高于不吸烟者者,此外随着吸烟指数增加其表达水平逐渐升高。结合早期研究[15],证实了STAT3通路在烟草相关的头颈部肿瘤中发挥至关重要作用,提示pSTAT3参与烟草诱导肺癌过程。
STAT3在早期胚胎发育、器官形成和许多正常组织分化中发挥关键性作用。pSTAT3是STAT3的活化形式,具有生物学活性。有研究证实,持续活化的STAT3能促使v-Src转染的小鼠成纤维细胞发生恶性转化,并在裸鼠体内形成肿瘤,阻断STAT3则会阻止Src对该细胞的恶性转化;pSTAT3的过表达能增加乳头状瘤细胞的迁移和侵袭[16];在良性前列腺上皮细胞株中导入持续活化的STAT3基因会导致细胞出现恶性表型[17];阻断黑色素瘤细胞中STAT3信号能抑制该细胞增殖及诱导该细胞凋亡[18];说明pSTAT3在细胞恶性转化方面起着重要的作用。
进一步模拟人吸烟的过程,通过有机相和无机相分别凝集浓缩烟气中的各种化合物,建立CSC诱导BEP2D细胞慢性恶性转化模型。BEP2D细胞是无血清条件下培养的细胞系,一般在有血清的条件下,由于血清的诱导分化作用,细胞总体生长状态会受到抑制,致使细胞接种效率下降[19]。由于CSC对细胞遗传性状的作用,CSC诱导细胞对血清的诱导分化作用呈现明显的抗性,因此可在含血清培养液中生长。本研究中CSC诱导细胞随着诱导代数增加血清抗性增强,提示转化细胞对环境的选择性和依赖性逐渐降低,生存能力增加,逐步具有转化的趋势。锚着独立实验是检测在低密度条件下所转化细胞在半固体琼脂上形成克隆的能力,是评价转化细胞发生癌变程度的重要标准[20]。由于具有锚着独立性生长能力,转化细胞和肿瘤细胞对细胞间通讯及血清的依赖性降低,能在低密度条件下在半固体琼脂上形成克隆。此外,转化干细胞在软琼脂中的生长能力较为接近细胞在体内实际的生长状态(表现立体空间结构),因此也是转化细胞能否在体内接种生长的一种反映。本研究中CSC诱导细胞随转化代数增加锚着独立性增高。值得一提的是P30细胞以后,锚着独立性显著升高,且所形成克隆形态明显增大,P70细胞最为明显,说明CSC诱导细胞具备了一定的恶性化趋势。在CSC诱导BEP2D细胞恶性转化过程中,与细胞对照组相比,CSC染毒组STAT3的表达无明显差异,而STAT3随细胞染毒代数升高而逐渐升高,提示STAT3活化是烟草诱导支气管上皮细胞癌变的早期事件,抑制pSTAT3活性可能是一种预防烟草相关肺癌的有效策略。
JSI-124作为高选择性JAK/STAT3抑制剂,具有易穿过细胞膜和酪氨酸激酶抑制功能[21]。有研究证明,JSI-124能直接有效地抑制STAT3磷酸化水平,阻断JAK/STAT3信号传导[22]。本研究选取细胞恶性表型较为明显的P70作为对象,使用JSI-124观察其对细胞生物学特性及相关基因的影响。
JSI-124抑制P70细胞增殖、促进P70细胞凋亡,均呈时间及浓度依赖性。作为IAP家族最强的凋亡抑制因子,存活蛋白在分化成熟的正常组织中均不表达,而在绝大部分恶性肿瘤中高表达[23],被认为是个重要的潜在肿瘤预测因子。本研究在CSC诱导BEP2D细胞恶性转化过程中发现,存活蛋白在正常对照组和乙醇对照组中均不表达,在P10,P30,P40,P50,P60和P70细胞中表达逐渐升高,P70细胞最高,显示细胞抗凋亡能力随着染毒代数增加而增强。抑制pSTAT3可显著降低存活蛋白基因及蛋白水平的表达。说明在CSC诱导BEP2D细胞恶性转化过程中,STAT3信号调控存活蛋白表达,抑制细胞凋亡,促进细胞恶性转化。
综上所述,STAT3信号通过调控存活蛋白表达抑制细胞凋亡,参与烟草诱导人支气管上皮细胞的恶性转化。本研究结果为阐明吸烟诱发肺癌的分子机制提供实验依据,并为高危人群的早期干预提供靶点。
[1]IARC Working Group on the Evaluation of Carcino⁃genic Risks to Humans.Tobacco smoke and involuntary moking[J].IARC Monogr Eval Carcinog Risks Hum,2004,83:1-1438.
[2]Pancotti F,Roncuzzi L,Maggiolini MA.Caveolin-1 silencing arrests the proliferation of metastatic lung cancer cells through the inhibition of STAT3 signaling[J].Cell Signal,2012,24(7):1390-1397.
[3]Cheng A,Guo J,Henderson-Jackson E,Kim D,Malafa M,Coppola D.IκB kinase ε expression in pancreatic ductal adenocarcinoma[J].Am J Clin Pathol,2011,136(1):60-66.
[4]Tsurutani J,Castillo SS,Brognard J,Granville CA,Gills JJ,Sayyah J,et al.Tobacco components stimulate Akt-dependent proliferation and NF-kappa B-dependent survival in lung cancer cells[J].Car⁃cinogenesis,2005,26(7):1182-1195.
[5]West KA, Brognard J, Clark AS, Linnoila IR,Yang X,Swain SM,et al.Rapid Akt activation by nicotine and a tobacco carcinogen modulates the phenotype of normal human airway epithelial cells[J].J Clin Invest,2003,111(1):81-90.
[6]Liu XD.STAT3 activation inhibits human bronchial epithelial cell apoptosis in response to cigarette smoke exposure[J].Biochem Biophys Res Commun,2007,353(1):121-126.
[7]You W,Tang Q,Zhang C,Wu J,Gu C,Wu Z,et al.IL-26 promotes the proliferation and survival of human gastric cancer cells by regulating the bal⁃ance of STAT1 and STAT3 activation[J].PLoS One,2013,8(5):e63588.
[8]Guo J,Kim D,Gao J,Kurtyka C,Chen H,Yu C,et al.IKBKE is induced by STAT3 and tobacco car⁃cinogen and determines chemosensitivity in nonsmall cell lung cancer[J].Oncogene,2013,32(2):151-159.
[9]Liu Y,Lv L,Xiao W,Gong C,Yin J,Wang D,et al.Leptin activates STAT3 and ERK1/2 pathways and induces endometrial cancer cell prolifera⁃tion[J].J Huazhong Univ Sci Technol Med Sci,2011,31(3):365-370.
[10]Kang SH,Yu MO,Park KJ,Chi SG,Chung YG. Activated STAT3 regulates hypoxia-induced angio⁃genesis and cell migration in human glioblastoma[J].Neurosurgery,2010,67(5):1386-1395.
[11]Yu H,Pardoll D,Jove R.STATs in cancer inflam⁃mation and immunity:a leading role for STAT3[J].Nat Rev Cancer,2009,9(11):798-809.
[12]Xiong A,Yang Z,Shen Y,Zhou J,Shen Q.Tran⁃scription factor STAT3 as a novel molecular target for cancer prevention[J].Cancers(Basel),2014,6(2):926-957.
[13]Nagpal JK,Mishra R,Das BR.Activation of Stat-3 as one of the early events in tobacco chewingmediated oral carcinogenesis[J].Cancer,2002,94(9):2393-2400.
[14]Li W,Chen Y,Zhang J,Hong L,Yuan N,Wang X,et al.IKBKE Upregulation is positively associated with squamous cell carcinoma of the lungin vivoand malignant transformation of human bronchial epithelial cellsin vitro[J].Med Sci Monit,2015,21:1577-1586.
[15]Leong PL,Andrews GA,Johnson DE,Dyer KF,Xi SA,Robbins PD,et al.Targeted inhibition of Stat3 with a decoy oligonucleotide abrogates head and neck cancer cell growth[J].Proc Natl Acad Sci USA,2003,100(7):4138-4143.
[16]Chan KS,Sano S,Kataoka K,Abel E,Carbajal S,Beltran L,et al.Forced expression of a constitu⁃tively active form of Stat3 in mouse epidermis enhances malignant progression of skin tumors induced by two-stage carcinogenesis[J].Oncogene,2008,27(8):1087-1094.
[17]Huang HF,Murphy TF,Shu P,Barton AB,Barton BE.Stable expression of constitutively-acti⁃vated STAT3 in benign prostatic epithelial cells changes their phenotype to that resembling malig⁃nant cells[J].Mol Cancer,2005,4(1):2.
[18]Tang GS,Cai JM,Ni J,Xiang YS,Cui JG,Zhu D,et al.Effects of STAT3 antisense oligodeoxynucle⁃otides on apoptosis and proliferation of mouse mel⁃anoma cell line B16[J].Chin J Cancer(癌症),2006,25(3):269-274.
[19]Zhou H,Calaf GM,Hei TK.Malignant transformation of human bronchial epithelial cells with the tobaccospecific nitrosamine,4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone[J].Int J Cancer,2003,106(6):821-826.
[20]Li HZ,Gu YP,Miki J,Hukku BA,Hei TK,Rhim JS. Malignant transformation of human benign prostate epithelial cells by high linear energy transfer alphaparticles[J].Int J Oncol,2007,31(3):537-544.
[21]Ishdorj G,Johnston JB,Gibson SB.Inhibition of constitutive activation of STAT3 by curcurbitacin-I(JSI-124)sensitized human B-leukemia cells to apoptosis[J].Mol Cancer Ther,2010,9(12):3302-3314.
[22]Mcfarland BC,Gray GK,Nozell SE,Hong SW,Benveniste EN.Activation of the NF-kB pathway by the STAT3 inhibitor JSI-124 in human glioblastoma cells[J].Mol Cancer Res,2013,11(5):494-505.
[23]Kawasaki H,Toyoda M,Shinohara H,Okuda J,Watanabe I,Yamamoto T,et al.Expression of survivin correlates with apoptosis,proliferation,and angiogenesis during human colorectal tumorigenesis[J].Cancer,2001,91(11):2026-2032.
STAT3 signaling pathway participates in malignant transformation of Immortalized human bronchial epithelial cells induced by cigarette smoke condensate
YUAN Na-na1,2,LI Wei1,CHEN Yu-qing1,ZHANG Jia-xiu1,HONG Lei1,JIANG Peng1,ZHOU Ji-hong3,WANG Xiao-jing1,ZHU Mao-xiang4,PAN Xiu-jie4,YANG Zhi-hua4,GU Yong-qing4
(1.Department of Respiratory Disease,the First Affiliated Hospital,Provincial Key Laboratory of Respiratory Disease in Anhui,3.Department of Biochemistry and Molecular Biology,Bengbu Medical Colloge,Bengbu 233004,China;2.Department of Respiratory Disease,No.2 People′s Hospital of Fuyang,Fuyang 236015,China;4.Institute of Radiation Medicine,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTIVE To detect the expression of pSTAT3 protein in lung specimens of squa⁃mous cell carcinoma,squamous dysplasia and normal bronchial epithelial tissues,analyze the rela⁃tionship between its expression and smoking,and to explore the role of STAT3 signaling in the process of lung cancer induced by smoking.METHODS pSTAT3 protein expression was assessed by immunohistochemistry in 288 samples of lung specimens of squamous cell carcinoma,108 samples of squamous dysplasia and 112 samples of normal bronchial epithelial tissues.The relationship between its expression and smoking was analyzed.Immortalized human bronchial epithelial cells induced by CSC were divided to 9 groups.Malignant transformation was assessed by resistance to serum-induced terminal differentiation and anchorage-independence growth.pSTAT3 protein expression was detected by Western blotting.The proliferation and apoptosis of P70 treated with JSI-124 0.25-10 μmol·L-1were explored by MTT assay and flow cytometry,respectively.Survivin expression in P70 treated with JSI-124 was detect⁃ed by reverse transcription PCR and Western blotting,respectively.RESULTS Expression of pSTAT3 protein showed a significant upward trend from normal bronchial epithelial tissues were compared to squamous dysplasia and lung specimens of squamous cell carcinoma.pSTAT3 expression wa closely relate to the smoking exposure of patients.With the increase in transformation generation,the resis⁃tance to serum-induced terminal differentiation and anchorage-independence growth were enhanced,especially after P30.pSTAT3 protein expression in normal untreated control and alcohol-treated control groups had no significant difference.pSTAT3 protein expression in BEP2D induced by CSC was higher than that in the two control groups(P<0.05)and their expression increased gradually with the increase in transformation generation.JSI-124 inhibited proliferation and promoted apoptosis in a concentrationand time-dependent manner.The expression of survivin mRNA and protein in P70 treated with JSI-124 1 μmol·L-1was significantly higher than that in DMSO group(P<0.05).CONCLUSION STAT3 signaling may participate in the malignant transformation of human bronchial epithelial cells induced by tobacco by inhibiting apoptosis of cells through regulation of survivin.
STAT3;cigarette smoke condensate;immortalized human bronchial epithelial cells
CHEN Yu-qing,E-mail:bbmccyq@126.com
R994.6
A
1000-3002-(2016)11-1182-10
10.3867/j.issn.1000-3002.2016.11.009
Foundation item:The project supported by National Natural Science Foundation of China(81172213);Natural Science Foundation of Anhui Province(1408085MH14);Key Laboratory Performance Assessment Subsidy Program of Anhui Province(1506c085013);Key Project of Natural Science Research Project in Higher Education of Anhui(KJ2016A487);and Key Laboratory Project on Department of Science and Technology of Anhui Province(12010402127)
2015-12-28接受日期:2016-07-04)
(本文编辑:乔 虹)
国家自然科学基金面上项目(81172213);安徽省自然科学基金面上项目(1408085MH14);安徽省重点实验室绩效考核补助项目(1506c085013);安徽省高校自然科学研究项目重点项目(KJ2016A487);安徽省科技攻关项目(12010402127)
袁娜娜,女,硕士研究生,住院医师,主要从事烟草相关肺癌研究。
陈余清,E-mail:bbmccyq@126.com
