30835例新生儿听力和基因联合筛查实践研究
2016-02-15张晚霞孙慧红马丽霞李一辰
张晚霞 孙慧红 马丽霞 李一辰
首都医科大学附属北京妇产医院,北京妇幼保健院(北京 100026)
·临床研究·
30835例新生儿听力和基因联合筛查实践研究
张晚霞 孙慧红 马丽霞 李一辰
首都医科大学附属北京妇产医院,北京妇幼保健院(北京 100026)
目的通过新生儿听力和耳聋基因联合筛查及听力学诊断结果分析,进一步明确联合筛查的意义。方法以2013年7月至2015年6月间出生普通产科出生活产新生儿为研究对象,出生48小时后进行新生儿听力初筛,同时采集足跟血进行耳聋基因筛查。初筛未通过者42天回产院复筛。复筛仍未通过者及耳聋基因筛查未通过者均于3月龄转诊至6家儿童听力障碍诊治机构接受听力诊断性检测和遗传咨询服务。通过对采集的联合筛查及听力诊断数据信息加以统计分析,开展研究。结果30835例新生儿接受了听力和耳聋基因的联合筛查,联合筛查率占同期活产新生儿的97.6%,联合筛查推广和执行力度较为充分,社会认同度高。其中听力两步筛查未通过率1.51%,。耳聋基因筛查未通过率4.73%。联合筛查显示耳聋基因筛查未通过群体中听力筛查的未通过率(3.8%)高于基因筛查通过者(1.4%),P<0.001,提示听力筛查和耳聋基因筛查未通过者互为联合筛查的高危人群。1457例耳聋基因筛查未通过者中GJB2基因突变者占比最高(55.4%),其235delC位点突变最为常见(72.5%),其次是SLC26A4基因(34.3%)。线粒体12s rRNA基因突变共74例(5.1%)。1457例中共发现纯合和复合杂合突变5例,4例明确听力损失。单杂合突变1452例,检出不同程度听力损失14例。结论实践证明新生儿听力和耳聋基因联合筛查可行性强,临床应用易于推广。新生儿听力和耳聋基因筛查联合开展,相互裨益,是目前防聋筛查的最佳模式。
新生儿;听力筛查;耳聋基因;联合筛查
新生儿听力筛查在北京市已开展20余年,筛查转诊运行和管理模式完善,防聋成果显著。但是,普遍开展的新生儿听力筛查对迟发性、渐进性的听力损失患儿和药物敏感性聋患儿却不能早期发现,已渐成听力学家们的隐忧[1],幸运的是近年来逐渐兴起并已规模化的耳聋基因筛查对此能发挥其积极的作用[2]。北京市在全国率先启动了新生儿听力和耳聋基因联合筛查的惠民项目,历史性的将新生儿听力筛查工作推上了新台阶。我院自2012年起开始新生儿听力和耳聋基因的联合筛查,在实践中不断磨合和改进联合筛查流程,取得良好的社会效应。本文旨在通过对其中3万例联合筛查及诊断资料的数据分析,进一步阐述联合筛查的意义所在。
1 资料与方法
1.1 研究对象
于2013年7月1日至2015年6月30日期间在北京妇产医院普通产科住院分娩的活产新生儿中,选取自愿接受听力和耳聋基因联合筛查者作为本次研究对象,筛查前由家长签署知情同意书。
1.2 听力筛查方法
本院普通产科新生儿听力筛查采用初筛和复筛两步筛查法进行。初筛于出生48小时后进行,使用瞬态耳声发射仪(TEOAE),未通过者于42天回院复筛。复筛联合使用TEOAE和自动听觉脑干反应(AABR),凡任一项筛查未通过者,均视为复筛未通过。复筛未通过结果会书面通知家长,并要求家长于3月龄内将孩子转诊至北京市指定6家儿童听力障碍诊治机构接受进一步诊断性听力检测,明确听力损失情况并尽早采取适宜治疗干预措施。
1.3 耳聋基因筛查方法
耳聋基因筛查采用晶芯®九项遗传性耳聋基因检测试剂盒(微阵列芯片法),进行常见4个耳聋基因9个热点突变位点的检测,即GJB2基因的35 del G、176 del 16、235 del C和299 del AT 4个位点,GJB3基因的538 C>T位点,SLC26A4基因的2168 A>G和IVS7-2 A>G,线粒体12s rRNA基因的1494 C>T和1555 A>G。新生儿于生后3天(与遗传代谢病采血时间同时)采集足跟血,在特制带信息页的滤纸卡上制成2个8mm直径圆形血斑,送至指定6家儿童听力障碍诊治机构的耳聋基因筛查实验室完成检测。初检结果经复核后向家长短信发布,并建立网络信息查询平台。对耳聋基因筛查结果显示“未通过”者,家长可通过查询获知咨询就诊方式,接受后续咨询服务。6家儿童听力障碍诊治机构在接诊时,会同时依据该儿童的耳聋基因筛查和新生儿听力筛查结果,给出后续咨询诊断的合理建议。其中耳聋基因筛查“未通过”指4个基因的9个位点出现任一位点的杂合突变,反之则为“通过”。
1.4 资料收集方法
新生儿听力筛查数据信息下载自经筛查机构、区妇幼和市级妇幼三级核实的“北京市妇幼保健网络信息系统”之“新生儿听力筛查”模块。耳聋基因筛查数据信息下载自“新生儿耳聋基因筛查数据库”,该数据库为北京市耳聋基因筛查官方信息管理系统。筛查未通过儿童的听力诊断取自3月龄至1岁间的随诊结果,信息部分(47例)来自北京市指定的6家儿童听力障碍诊治机构录入“北京市妇幼保健网络信息系统”的听力诊断信息,部分(6例)来自电话追访。
1.5 统计方法
使用spss19.0作为统计分析软件工具,采用频数、百分比和χ2检验等统计方法进行数据统计分析,组间χ2检验采用双侧检验,以P<0.05表示差异有统计学意义。
2 研究结果
2.1 新生儿听力和耳聋基因联合筛查率
北京妇产医院2013年7月1日至2015年6月30日期间共出生活产新生儿31590例,其中30835例同时接受了听力和耳聋基因联合筛查,联合筛查率97.6%。
2.2 听力筛查结果
30835例中,初筛未通过1563例(5.1%),其中1368例(87.5%)接受复筛,复筛未通过465例(34.0%)。经听力学诊断,最终发现听力损失患儿53例,其中双耳听力损失极重度2例、重度4例、中度13例、轻度20例,单耳听力损失极重度4例,中度3例,轻度7例。经两步筛查,新生儿听力损失检出率1.72‰。
2.3 耳聋基因筛查结果
30835例中,筛查未通过1457例(4.73%),其中纯合和复合杂合突变共5例,包括GJB2基因176 del 16和235 del C复合杂合突变1例,GJB3纯合1例,SLC26A4基因的IVS7-2 A>G位点纯合3例。单位点杂合突变1452例(因有多位点杂合突变病例,按突变位点分别计数为1465例),包括GJB2基因806例,GJB3基因88例,SLC26A4基因497例,12s rRNA基因74例。
2.4 新生儿听力和耳聋基因联合筛查结果见(表1)。
联合筛查结果显示,基因筛查结果正常的29378例中,新生儿听力筛查通过28881例,未通过率1.4%,而基因筛查未通过的1457例中,听力筛查通过1392例,未通过率3.8%,经卡方检验,两者差异有显著统计学意义(χ2=59.5,P<0.001)。
2.4.1 GJB2基因筛查未通过儿童的听力筛查及诊断情况
GJB2基因筛查未通过共807例,占基因筛查未通过总例数的55.4%,其中176 del 16和235 del C复合杂合突变1例(0.1%),35 del G位点7例(0.87%),176 del 16位点36例(4.5%),235 del C位点585例(72.5%),299 del AT位点178例(22.1%)。其中1例复合杂合突变病例新生儿听力筛查未通过,3月龄听力诊断显示双耳重度听力损失,结合基因筛查结果,确诊先天性聋。单杂合突变病例共42例未通过新生儿听力筛查,未通过率5.2%。1岁期间的听力诊断发现5例双耳轻至中度听力损失患儿,均为235 del C位点突变病例。
2.4.2 听力与SLC26A4基因联合筛查结果
SLC26A4基因筛查未通过共500例,占基因筛查未通过总例数的34.3%,其中IVS7-2 A>G位点纯合突变3例,杂合突变411例,2168 A>G位点杂合突变86例。纯合突变病例中1例通过新生儿听力筛查,另2例未通过,听力检测显示为双耳轻度听力损失。且3例均于9月龄前确诊前庭大水管综合症并得到有效干预。497例杂合突变病例中共有11例未通过听力筛查,未通过率2.2%。听力检测发现8例双耳听力损失患儿(轻度2例,中度2例,重度4例)。
2.4.3 听力与GJB3基因联合筛查结果
GJB3基因538 C>T位点筛查未通过89例,纯合1例,杂合突变88例,且均通过新生儿听力筛查。2.4.4听力与线粒体12s rRNA基因联合筛查结果
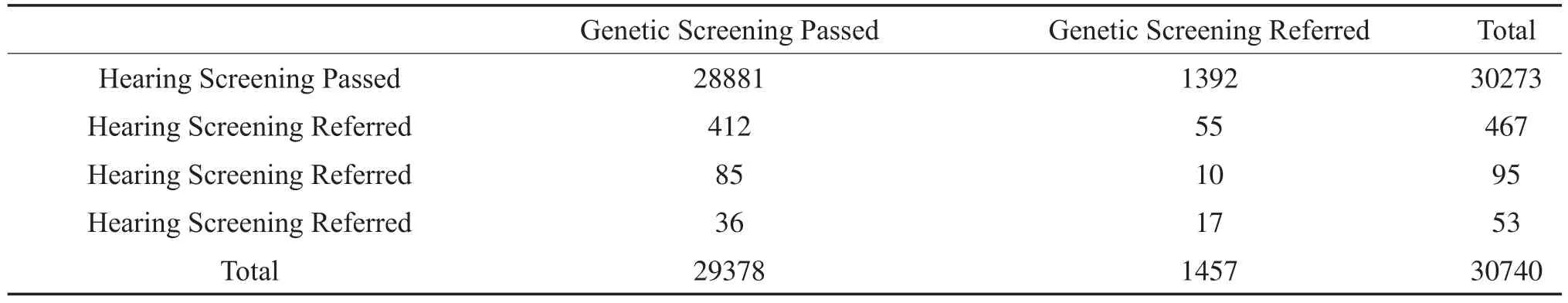
表1 新生儿听力和耳聋基因联合筛查结果Table 1 The Results Of Newborn Hearing Concurrent Genetic Screening
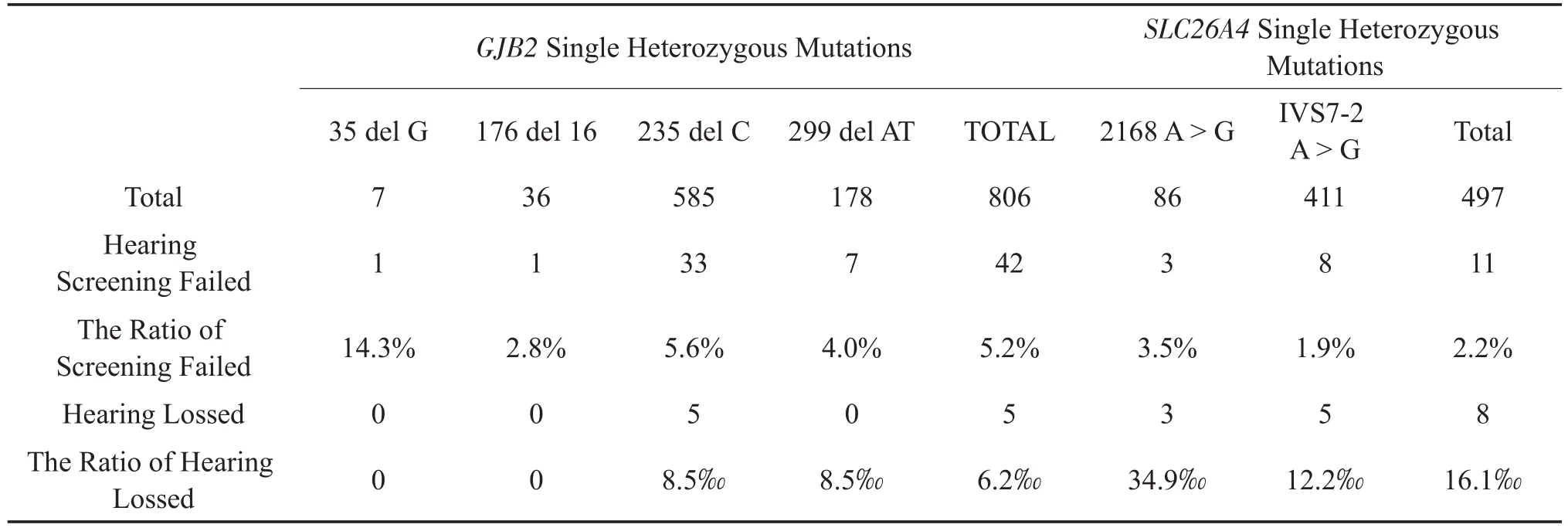
表2 GJB2和SLC26A4基因筛查未通过儿童的听力筛查和诊断结果Table 2 The Screening and Diagnosis Results of Children Failed in GJB2 and SLC26A4 Genetic Screening
线粒体12s rRNA基因筛查未通过74例,其中1494 C>T均质突变7例,1555 A>G均质突变48例,异质突变19例。74例线粒体12s rRNA基因筛查未通过病例均通过新生儿听力筛查。
3 讨论
近年来随着耳聋基因研究的突破性进展,尤其是基因芯片技术的成熟,使得耳聋基因的大规模筛查成为可能[3]。北京妇幼保健院作为北京市分娩量最大的助产机构,积极执行北京市政府决策,努力推进新生儿听力和耳聋基因联合筛查的开展工作。本院新生儿听力和耳聋基因联合筛查的覆盖率高,本研究中高达97.6%,耳聋基因筛查未通过率4.73%,与类似大样本筛查结果[4-6]较为接近。其中各种不同基因型的构成和比例分布亦与国内筛查近似,而与国外情况略有不同[7,8],反应了国人耳聋基因突变的自身特征性。
本院4年的实践表明联合筛查模式可操作性强,切实可行。近10年来,新生儿耳聋基因筛查的相关尝试工作在全国多地均有开展。北京市自2012年4月以政府公益项目形式开展了耳聋基因筛查工作,流程规划清晰,质控体系完善[9]。其中基因筛查采用晶芯®九项遗传性耳聋基因检测试剂盒(微阵列芯片法),同时开展4个基因9个热点突变位点的筛查。采血环节则充分利用已成功运行20年的新生儿遗传代谢病筛查的资源进行的,即以全体活产新生儿为筛查对象,配备专用采血针,与遗传代谢病同步采血。这样的采血流程安排对基层采血机构来说较为便利,未因筛查项目的增加而增加过多工作量,同时患儿无过多痛苦,家长也容易接受。最为关键的是,无论是听力筛查还是耳聋基因筛查,最终未通过的儿童转诊机构是一致的。也就是说,在诊治机构就诊的儿童,其听力筛查、诊断和耳聋基因筛查信息都是共享的,治疗干预时会被+综合考量,真正实现联合筛查的目的。
新生儿听力和耳聋基因联合筛查是目前最为理想的防聋筛查模式[10]。传统新生儿听力筛查有其筛查方法上和时点上的局限性,虽可及时发现大部分出生后即刻出现的先天性聋患儿,但对表现为迟发性、渐进性听力损失的患儿以及药物敏感性患儿则无法筛出。本研究结果表明,经耳聋基因筛查发现的SLC26A4基因IVS7-2 A>G位点纯合突变1例及GJB3基因538 C>T位点纯合突变1例均通过了新生儿听力筛查,如果没有耳聋基因筛查,这2例很难继续接受定期的听力监护,在患儿出现听力损失的第一时间及早发现的目标也将难以实现。另外,通过耳聋基因筛查发现的74例线粒体12s rRNA基因均质和异质突变病例也均通过了新生儿听力筛查,但基因筛查结果却明确提示了他们对氨基糖甙类药物的特殊敏感性,无论对孩子还是其母系家人未来听力保护的预警效力明显[11]。耳聋基因筛查还可为先天性聋儿提供可靠的遗传学病因解析,为有效干预提供依据。本研究发现的5例纯合和复合杂合突变病例中,除1例GJB3纯合突变暂无听力损失出现,尚在定期听力学监测之下外,其余4例均借助基因筛查得到早期确诊及有效的干预。而对于占耳聋基因筛查中“未通过”人数最多的大量携带者来说,筛查的意义在于对家庭再生育和携带者未来婚育提供科学的遗传指导,从基因层面避免先天性聋儿的诞生。同时,听力筛查及后续的听力监测也将长期助益已接受耳聋基因筛查人群的听力保护。本研究中耳聋基因筛查通过者中,依然有36例确诊听力损失的病例,应该说他们没有芯片覆盖范围内的遗传学病因,单纯依靠耳聋基因筛查难以发现。另外,耳聋基因筛查纯合和复合杂合突变的病例中,其听力损失的发生时间和轻重程度各不相同,怎样才能及时发现;单杂合突变病例是否需要进一步的基因测序;线粒体RNA基因突变病例是否仅仅慎用氨基糖甙类药物即可无忧[12],均需要借助定期听力筛查和监护才能做出适宜的医学判断。今后,我们会在实践中进一步优化联合筛查流程,将听力和耳聋基因的筛查诊断优势互补,力争将防聋筛查工作做得更加完善和有效。
1 韩冰,王秋菊.新生儿听力和基因联合筛查研究现状[J].中华耳科学杂志.2013,11(2):309-312.
Han B,Wang QJ.Research Status for Newborn Hearing Concurrent Genetic Screening[J].Chinese Journal of Otology,2013,11(2): 309-312.
2 袁永一,戴朴.耳聋基因诊断——转化医学推动耳科学发展的范例[J].中华耳科学杂志.2014,12(1):1-5.
Yuan YY,Dai P.Deafness Genetic Testing—an Example Translation⁃al Medicine Accelerating the Progress of Otology[J].Chinese Journal of Otology,2014,12(1):1-5.
3 袁永一,戴朴.遗传性聋的精准医疗[J].临床耳鼻咽喉头颈外科杂志.2016,30(1):1-4.
Yuan YY,Dai P.Precise medicine of hereditary hearing loss[J].Jour⁃nal of Clinical Otorhinolaryngology Head and Neck Surgery,2016,30(1):1-4.
4 韩冰,李倩,纵亮等.新生儿听力及基因联合筛查临床实践及筛查模式研究[J].中华耳科学杂志.2013,11(3):380-383.
Han B,Li Q,Zong L,et al.An Clinical Research on Newborn Hearing Concurrent Genetic Screening in 106513 Neonates[J].Chinese Jour⁃nal of Otology,2013,11(3):380-383.
5 孙雪晶,席作明,张静等.新生儿常见致聋基因突变位点的大样本筛查分析[J].中国妇幼健康研究.2016.27(4):506-507.
Sun XJ,Xi ZM,Zhang J,et al.Analysis of Large sampie screening for mutational sites at common deafness-related gene in neonates[J]Chi⁃nese Journal of Woman and Child Health Research,2016.27(4): 506-507.
6 李晓泽,马卫平,胡志鹏等.长治地区19113例新生儿耳聋基因检测[J].中华耳科学杂志.2015,13(4):654-657.
Li XZ,Ma WP,Hu ZP,et al.ChangZhi District 19113 Cases Of Neona⁃tai Deafness Gene Detection[J].Chinese Journal of Otology,2015,13 (4):654-657.
7 Girish VP,Bassem A,Bleool’s,et al.A Multicenter study of the fre⁃quency and distribution of GJB2 and GJB6 mutations in a large North American cohort[J].Genet Med,2007,9(7):413-426.
8 代志瑶,戴朴.非综合征型耳聋的基因型与表型关系[j].中华耳科学杂志.2013,11(1):151-155.
Dai ZY,Dai P.Relationship between genotype and phenotype of non⁃syndromic hearing loss[J].Chinese Journal of Otology,2013,11(1): 151-155.
9 黄丽辉,韩德民.新生儿耳聋基因筛查的质控体系建立[J].中国耳鼻咽喉头颈外科.2015,22(2):60-62.
Huang LH,Han DM.Establish quality control system for newborn deafness gene screening[J].Chin arch otolaryngol head neck surg, 2015,22(2):60-62.
10 王秋菊.新生儿听力及基因联合筛查——中国模式与未来发展[J].临床耳鼻咽喉头颈外科杂志.2014,28(22):1733-1736.
Wang QJ.Newborn hearing combined gene screening——China model and future development[J].Journal of Clinical Otorhinolaryn⁃gology Head and Neck Surgery,,2014,28(22):1733-1736.
11 Liu X,Dai P,Huang DL,et al.Mitochondrial DNA A1555G mutation screening using a testing kit method and its significance in prevent⁃ing aminoglycoside-related hearing loss[J].Journal of Otology,2006, 1(1):61–64.
12 张雪溪,张杰,陈敏等.线粒体DNA突变与遗传性耳聋[J].中华耳科学杂志.2015,13(3):454-457.
Zhang XX,Zhang J,Chen M,et al.Mitochondrial DNA Mutations and Hereditary Deafness[J].Chinese Journal of Otology,2015,13(3): 454-457.
Combined Hearing and Genetic Screening in 30835 Neonates
ZHANG Wanxia,SUN Huihong,MA Lixia,LI Yichen
Beijing Obstetrics and Gynecology Hospital Affiliated to Capital University of Medical Science, Beijing Maternal and Child Health Care Hospital,Beijing 100026,China
ObjectiveTo report data of combined newborn hearing and genetic screening in Beijing and its potential values.MethodsNewborns born between July 2013 and June 2015 were included in the study.After obtaining the informed consent,hearing screening was conducted within 48 hours after birth.At the same time,heel blood collection was done for genetic screening for nine hot spot mutations in four common deafness genes.Those failing to pass the initial hearing screening received the second round screening at 42 days after birth in the maternity hospital.Those failing the combined screening were referred to one of the six state designated diagnosis and treatment centers for pediatric hearing impairment in 3 months.The centers provided diagnostic hearing testing and genetic counseling.Data from combined screening were collected and analyzed.ResultsA total of 30,835 newborns(97.6%of the newborns in the study duration)received combined hearing/genetic screening,showing successful outreach efforts well received by the community.The rate of hearing screening failure was 1.51%and that of genetic screening failure was 4.73%.The rate of hearing screening failure among the newborns who failed the genetic screening(3.8%)was higher than that among those passing the genetic screening(1.4%)(P<0.001),suggesting that failing either screening modality could represent increased risk of failing the other screening modality.Among the 1,457 newborns who failed the genetic screening,GJB2 gene mutations were the most commonly seen (55.4%),followed by SLC26A4 gene mutations(34.3%).There were 74 cases of mitochondrial 12s rRNA gene mutations. Five newborns were found to have homozygous or compound heterozygous mutations and hearing loss was confirmed in four of them.Heterozygous mutations were found in 1,452 newborns,and14 of them were diagnosed with hearing loss.ConclusionsCombined hearing/genetic screening is feasible and easy to be adopted in clinical practice.The hearing and genetic screenings are complimentary to each other.The combined screening is the most effective screening modality available today.
Newborn;Hearing screening;Hearing loss gene;Concurrent screening
R764.43
A
1672-2922(2016)06-769-5
2016-09-20审核人:陈伟)
10.3969/j.issn.1672-2922.2016.06.013
张晚霞,硕士,副主任医师,研究方向:儿童听力保健
李一辰,Email:lycebs@hotmail.com
