高效液相色谱-串联质谱法测定板栗中58种农药残留
2016-02-14侯霞赵雁冰麻兵继杨红查丽娟
侯霞,赵雁冰,麻兵继,杨红,查丽娟
(1.唐山出入境检验检疫局,河北唐山063000;2.河南农业大学,河南郑州450002)
高效液相色谱-串联质谱法测定板栗中58种农药残留
侯霞1,赵雁冰1,麻兵继2,杨红1,查丽娟1
(1.唐山出入境检验检疫局,河北唐山063000;2.河南农业大学,河南郑州450002)
为建立适用于板栗多种农药残留检测的高效液相色谱-串联质谱(HPLC-MS/MS)分析方法,以乙腈为提取溶剂,样品经高速均质提取,PSA、C18固相萃取柱净化后用HPLC分离,以AgilentC18(2.7滋m,2.1 mm×100 mm)为色谱柱,甲醇和0.1%甲酸-2 mmol/L乙酸铵水为流动相进行梯度洗脱,柱温30℃,进样量5.0滋L、流速300滋L/min,在ESI离子源、正离子扫描、动态MRM模式下,以保留时间和质荷比对分离的组分定性,外标法峰面积定量。结果表明:58种农药在各自的线性范围内相关性良好(r>0.99),各农药的加标回收率范围为60%~120%,符合残留检测要求。
高效液相色谱-串联质谱(HPLC-MS/MS);板栗;农药残留
板栗素有“干果之王”的美称,其含有大量的不饱和脂肪酸,对高血压、冠心病、动脉硬化患者具有调养之功效;还含有丰富的蛋白质,对人体有特殊的保护作用,能保持人体心血管壁的弹性,阻止动脉粥样硬化,减少皮下脂肪,防止肝肾中结缔组织萎缩,提高肌体的免疫能力[1~3]。随着市场对板栗需求的扩大,栗农为了增产高收,常常在板栗生长过程中使用一些除草剂、杀菌剂等。而这些农药大部分可以通过根部吸收传输到果实,当人们食用了含有农药残留的板栗时,身体健康就会受到威胁,严重时会致残、致畸、致基因突变等[4~7]。世界各国在进出口食品方面均有最大农药残留限量(MRLs)的规定。据有关资料显示,欧盟、美国、日本、韩国等11个国家或组织规定的坚果(包括板栗)MRLs达299项,这成为影响我国板栗出口的贸易壁垒。因此,建立快速检测板栗中农药多残留的方法具有重要意义。
目前,国内外对板栗中农药多残留的报道和文献相对较少。有些方法缺乏针对性,只适用于水果和蔬菜,而对板栗并不适用[8~11]。有些方法只对植物性食品中1种或几种农药残留进行检测,且样品净化方式较为复杂,耗时、耗材、耗人力[12~14]。常用的农产品中农药残留检测方法主要有气相色谱法、液相色谱法、气相(液相)色谱-质谱法等[15~17],其中,前2种方法定性检测能力较差,容易产生假阳性现象,要求的前处理条件也较为苛刻,且检测样品数量少;气相(液相)色谱-质谱法是目前应用最为广泛的检测方法[18~20],但是,部分板栗常用农药不在其检测标准和检测范围之内。因此,迫切需要建立一个针对性强、检测项目多、覆盖面广、快速简单、准确可靠的板栗农药多残留检测方法。
1 材料与方法
1.1 试验材料
试验板栗为鲜板栗,采自唐山市某板栗生产基地。
所有仪器设备有API 5000型四极杆串联质谱仪(美国AB公司)、1200高效液相色谱仪(美国Agilent公司)、X1R离心机(美国Thermo公司)、Turbo Vap LV氮气吹干仪(美国Biotage公司)、12位固相萃取装置(美国Supelco公司)、Rotavapor R-3旋转蒸发仪(瑞士BUCHI公司)、T25均质器(德国IKA公司)。
所用试剂中,甲醇、乙腈为色谱纯;氯化钠为优级纯;无水硫酸钠为分析纯,使用前在650℃灼烧4 h,贮于干燥器中,冷却后备用。水为符合GB/T 6682规定的一级水。
农药标准品和固相萃取柱均由北京智选科汇科技发展有限公司提供。标准品纯度不低于98%;固相萃取柱:ENVI C18(1 g,6 cm);PSA(500 mg,6 cm)。
1.2 试验方法
1.2.1 标准储备液和工作溶液配制
1.2.1.1 标准储备液。称取适量的标准物质,用甲醇溶解并配制成1.0 mg/mL的标准贮备液,避光保存于4℃冰箱中。
1.2.1.2 标准工作溶液。根据农药在仪器上的响应灵敏度确定混合标准溶液中各农药的浓度,避光保存于4℃冰箱中。
1.2.2 样品前处理称取鲜板栗样品5.00 g,置于100 mL具塞的聚丙烯离心管中,加入氯化钠5 g、乙腈20 mL,然后,10 000 r/min均质提取1 min,4 000 r/min离心5 min,将上清液倒入鸡心瓶中,重复提取1次。45℃水浴条件下旋转蒸发浓缩至约1 mL,待净化。
净化。在ENVI-18柱上加无水硫酸钠2 cm,用乙腈10 mL预淋活化,下接活化好的PSA柱。将上述浓缩液转移到已活化的ENVI-18+PSA串联柱上,控制过柱速度在1 mL/min以内。用乙腈2 mL洗涤鸡心瓶,并将洗涤液移入串联柱中,重复操作3次,再用乙腈20 mL洗脱,收集洗脱液。在45℃水浴条件下旋转蒸发浓缩至约0.5 mL,将浓缩液置于氮气吹干仪上吹干,用甲醇溶液1.0 mL定容,超声溶解,经0.22 μm滤膜过滤后,供液相色谱-质谱/质谱测定。
1.2.3 色谱-质谱条件
1.2.3.1 液相色谱条件。色谱柱:Agilent C18(2.7 μm,2.1 mm×100 mm),柱温30℃;进样量5.0 μL,流速300 μL/min,梯度洗脱见表1。

表1 流动相及梯度Table1 Mobile phase and gradient
1.2.3.2 质谱条件。离子源及电压:A组为ESI+源、5 500 V,B组为ESI-源、-4 500 V;离子源温度(TEM):550℃;扫描方式:A组为正离子扫描,B组为负离子扫描;检测方式:多反应监测;雾化气:氮气;喷雾气流速(GAS1):45 psi;辅助加热气流速(GAS2):55 psi;气帘气流速(CUR):35 psi;测定农药的参考保留时间和参考质谱参数见表2。
2 结果与分析
2.1 提取方法的选择
2.1.1 样品提取溶剂的选择选择适宜的提取溶剂是保证农药残留检测准确性的前提条件。板栗中含有大量的淀粉、不饱和脂肪酸、蛋白质、维生素等,根据“相似相溶”原理和待测农药的性质,结合基质的特性,选择不同极性的提取溶剂[21],分别试验了乙腈、丙酮和正己烷作为提取溶剂的效果,结果显示,丙酮作为提取液时上层液颜色较深,杂质较多;正己烷的回收率较低。因此,最终选择乙腈作为提取溶剂。
2.1.2 提取溶剂体积的选择分别对乙腈10、15、20、25、30、35、35、40 mL作为提取溶剂进行了试
验,结果显示,农药残留的回收率为65%~120%,乙腈体积增加,平均回收率并无较大提高。综合考虑,确定提取溶剂乙腈的体积为20 mL。

表2 参考保留时间和质谱参数Table2 Reference retention time and mass spectrometric parameters
2.2 净化方式的选择
2.2.1 固相萃取柱的选择本研究涉及的化合物较多,其结构和性质差别很大,选择适宜的固相萃取柱可以降低样品基质的干扰,提高检测灵敏度。参考李丽莉等[8]和刘红等[22]的方法,对ENVI C18(1 g,6 cm)和PSA(500 mg,6 cm)与GPC的净化效果和回收率进行了比较,结果显示,GPC虽然净化效果好,但是回收率低,使用溶剂量大,操作繁琐;而C18能很好地吸附非极性脂肪、脂溶性色素,PSA作为弱阴离子交换剂可吸附样品中的酸性干扰物。考虑到此类化合物的性质,最终选择固相萃取柱C18、PSA联合吸附净化的方法。该方法操作简单,去干扰效果良好。在净化最后一步采用高速冷冻离心,能进一步去除脂肪类、挥发油等成分的干扰。
2.2.2 洗脱溶剂的选择对比了乙腈、乙腈-甲苯(3∶1)、丙酮和正己烷4种洗脱溶剂的净化效果,结果显示,乙腈-甲苯、正己烷对杂质的净化效果不明显,丙酮洗脱后干扰较大,而乙腈对样品具有较好的洗脱净化效果。因此,选择乙腈作为洗脱剂。
2.2.3 洗脱体积的选择提取液经浓缩后从鸡心瓶中转至SPE柱,用乙腈淋洗SPE柱,每隔5 mL收集流出液,共收集40 mL,分别计算各段流出液中农药的回收率。结果显示,洗脱体积超过20 mL后,平均回收率并无较大提高。综合考虑,选择乙腈20 mL洗脱。
2.3 定容液的选择
参考李丽莉等[8]和曹静等[19]的方法,比较了乙腈/水(V/V,3/2)、甲醇/水(V/V,3/2)和甲醇作为定容液的效果,结果显示,除甲醇外,其他2种定容液对菊酯类农药均不能完全溶解。因此,最终选择甲醇作为定容液。
2.4 线性范围和测定低限
将混合对照品溶液不断稀释后测定,通过仪器的最低响应值,获得方法的测定低限(S/N=3)。各农药的线性范围为0.25~500.0 μg/kg,相关系数>0.99(表3),具有良好的线性关系,符合定量要求。

表3 分析物的线性方程、线性范围、相关系数及测定低限Table3 Linear regression equations,linear ranges,correlation coefficients and limits of detection of the analyte

(续表)
2.5 回收率和精密度
用阴性样品进行添加回收和精密度实验,样品添加不同浓度标准后,按本方法进行提取、净化和测定,每个添加水平均重复6次,农药的添加量根据限量进行不同浓度的添加,其添加水平回收率在60%~120%之间,精密度也均<15%(表4)。

表4 添加回收率及精密度Table4 Recoveries and relative standard debiations

(续表)
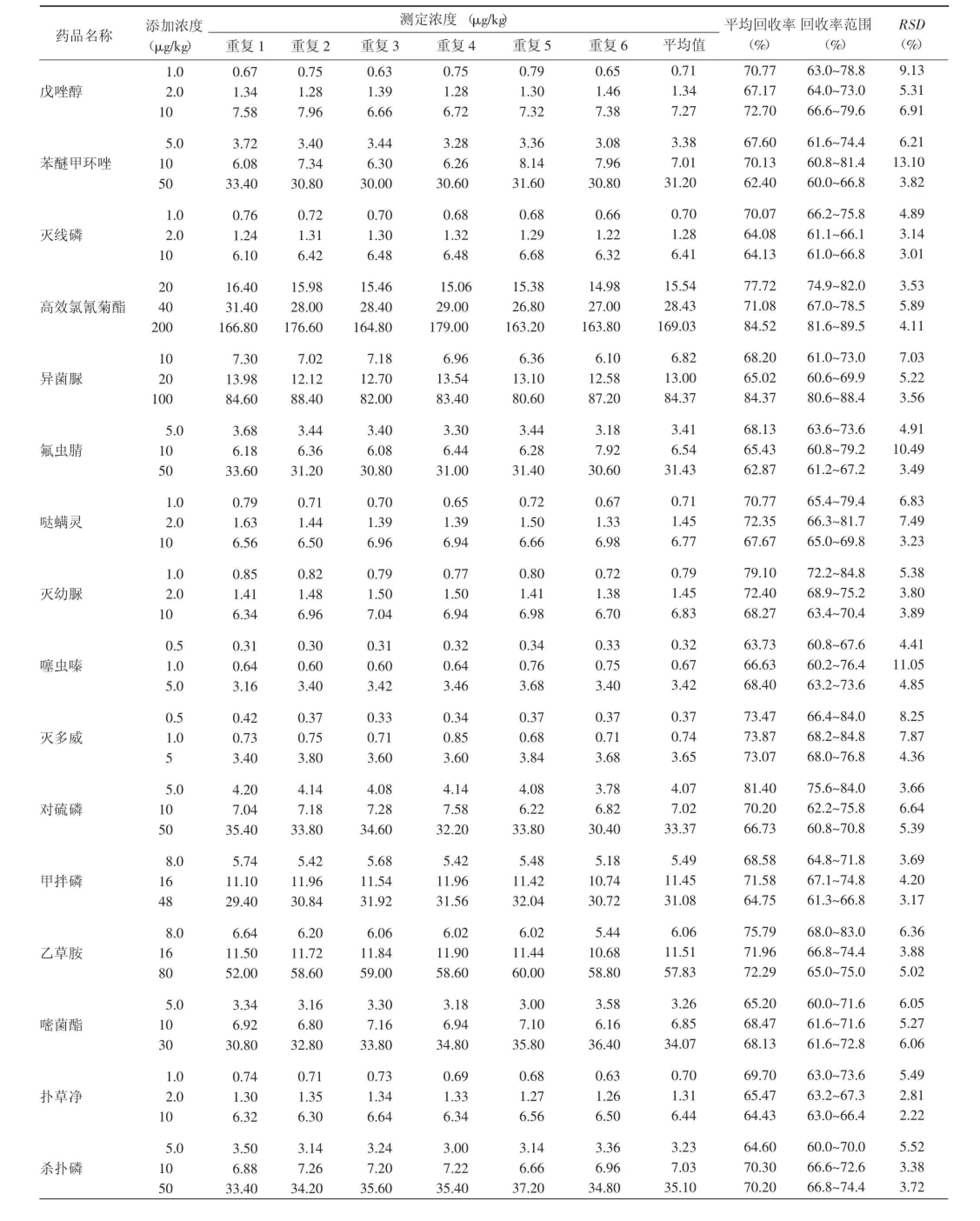
(续表)
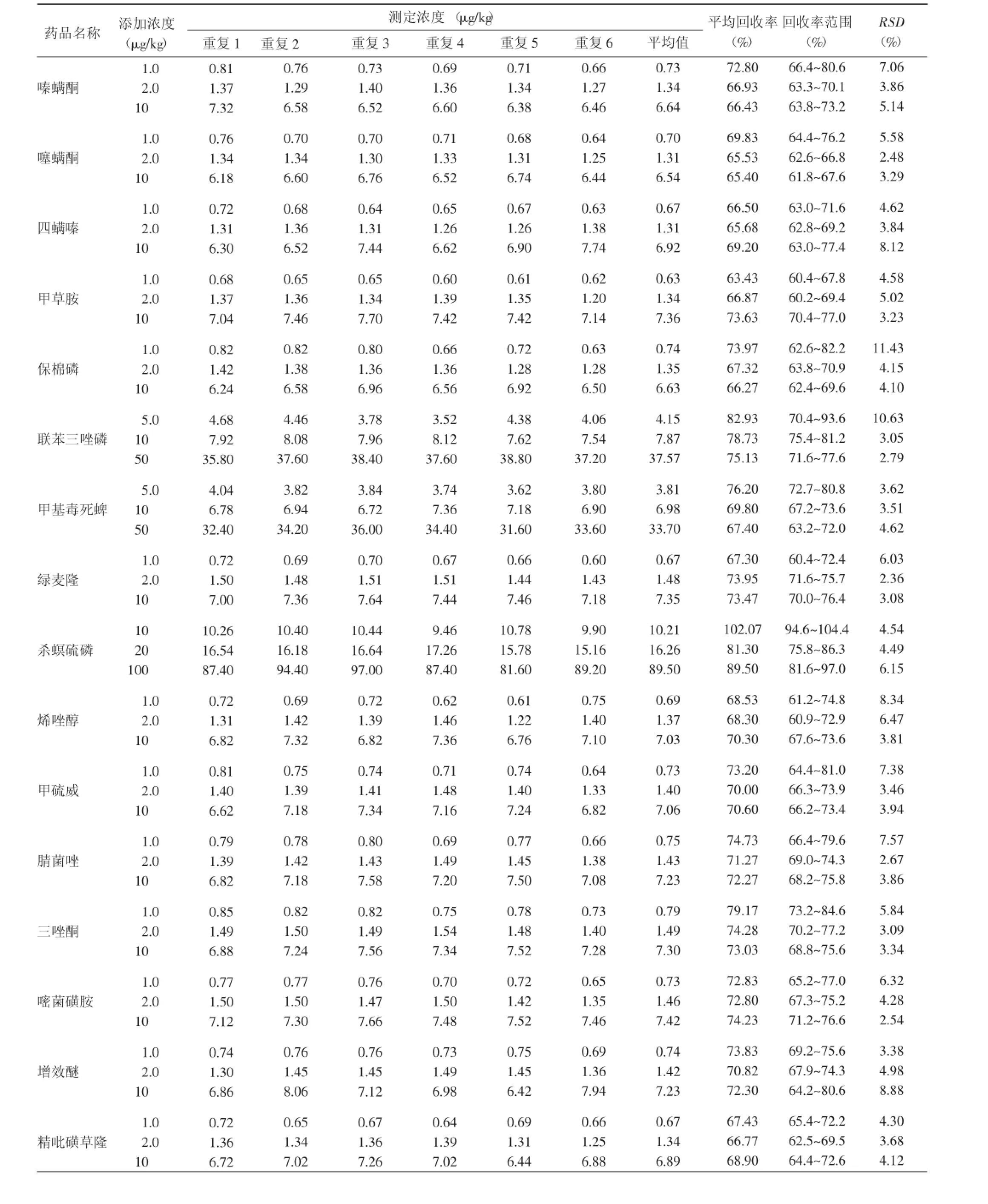
(续表)

(续表)
3 结论
通过对鲜板栗用乙腈均质提取,通过ENVI C18、PSA固相萃取柱净化后,经高效液相色谱-质谱/质谱仪检测,MRM监测模式,外标法定量,建立了应用高效液相色谱-串联质谱法检测鲜板栗中58种农药的多残留检测方法。该方法快速简单,灵敏度高,回收率和精密度均符合残留检测要求,多种农药的定量检测低限可以满足各国对相关产品设立的最高残留限量检测要求,可同时达到定性、定量的目的。
[1]高荣海,阮树安,李冬生,姜力耘,刘元.栗子的营养药用价值及加工制品的研究进展[J].北方园艺,2008,(12):184-186.
[2]齐敏,岳祟峰.板栗的药用价值及开发利用[J].中国林副特产,1997,(3):51-52.
[3]杨志斌,杨柳,徐向阳.板栗加工现状及剩余物利用前景[J].湖北林业科技,2007,143(1):57-59.
[4]郜红建,蒋新.土壤中结合残留态农药的生态环境效应[J].生态环境,2004,13(3):399-402,413.
[5]曹军,尹小乐,布文安,陈峰,杨红.环境中除草剂扑草净残留分析方法的研究[J].分析科学学报,2007,23(4):397-400.
[6]郎漫,李平,蔡祖聪.多菌灵在土壤中的降解及其生态环境效应[J].农药,2012,51(1):8-10.
[7]刘嫦娥,胡波,吴敏,张健.农产品农药残留的危害与预防[J].现代农业科技,2012,(14):290.
[8]李丽莉,丘明明,何颂华,罗轶,黄捷,陆敏仪.液相色谱-串联质谱法测定黄芪中119种农药残留[J].药物分析杂志,2012,32(3):424-433.
[9]史龙梅,李欢,周建科.液相色谱法检测番茄汁中杀菌剂和杀虫剂的研究[J].食品与发酵科技,2014,50(6):70-73.
[10]王素利,潘灿平,李莉,江树人,钱传范,刘丰茂.水果蔬菜中多种杀菌剂的基质固相分散液相色谱测定方法研究[J].分析测试学报,2007,26(6):808-812.
[11]刘文杰,万英,庞新安,张利莉.高效液相色谱法测定水果和蔬菜中残留的多菌灵、吡虫啉和甲基托布津[J].理化检验:化学分册,2008,44(7):673-674.
[12]吴岩,康庆贺,高凯扬,李志斌.固相萃取-在线凝胶渗透色谱-气相色谱/质谱法测定板栗中44种有机磷农药残留[J].分析化学研究简报,2009,37(5):753-757.
[13]乔鲁芹,马洪兵,姜淑霞,卢希萍.高新液相色谱法快速测定板栗中戊唑醇和咪鲜胺残留量[J].山东农业大学学报:自然科学版,2010,41(4):495-497.
[14]付艳梅,杜锋,翟硕莉.高效液相色谱法测定水果蔬菜中辛硫磷残留[J].食品安全质量检测学报,2015,(12):5072-5076.
[15]古丽米娜,王国卿,周璐,高慧,王明林.高效液相色谱法快速测定板栗中戊唑醇的残留量[J].化学分析计量,2010,19(5):71-72.
[16]朱臻怡,冯民,何健,熊华萱,曾义.气相色谱法同时测定花生中12种有机磷农药残留量[J].化学分析计量,2009,18(3):32-34.
[17]柴振林,杨柳,张帮川,朱杰丽.反相高效液相色谱法测定板栗中多菌灵残留量[J].浙江林业科技,2009,29(2):6-9.
[18]李南,石志红,庞国芳,范春林.坚果中185种农药残留的气相色谱-串联质谱法测定[J].分析测试学报,2011,30(5):513-521.
[19]曹静,庞国芳,王明林,范春林.液相色谱-电喷雾串联质谱法测定生姜中的215种农药残留[J].色谱,2010,28(6):579-589.
[20]赵雁冰,庞国芳,范春林,石志红.气相色谱-串联质谱法快速测定禽蛋中203种农药及化学污染物残留[J].分析试验室,2011,30(5):8-21.
[21]张艳.农药残留分析中不同提取溶剂的评价[J].甘肃农业科技,2006,(9):28-29.
[22]刘红,曾建勇,温贤有,陈坚文.固相萃取技术及其影响因素[J].现代农业科技,2010,(11):351,354.
Determination of 58 Pesticides in Chinese Chestnut Using High Performance Liquid Chromatographytandem Mass Spectrometry
HOU Xia1,ZHAO Yan-bing1,MA Bing-ji2,YANG Hong1,CHA Li-juan1
(1.Tangshan Entry-exit Inspection and Quarantine Bureau,Tangshan 063000,China;2.He’nan Agricultural University,Zhengzhou 450002,China)
A method for the determination of 58 pesticides in Chinese chestnut was developed by using high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS).The sample was extracted by acetonitrile in high-speed homogenization,cleaned by PSA,C18 Solid Phase Extraction Column and separated by HPLC.Chromatographic separation was performed on Agilent C18 column(2.7滋m,2.1 mm×100 mm)using a gradient elution of methanol and 0.1%formic acid-2 mmol/L ammonium acetate as mobile phases,at a flow rate of 300滋L/min.The column temperature was 30℃and the sample size was 5.0滋L.The peaks were detected by an electrospray ionization tandem mass spectrometry with dynamic MRM.Pesticide qualitation was based on the retention time and mass charge ratio and its quantitation was based on the peak area of fragment ion.The results indicated that the calibration curve of 58 pesticides was in good linear(r>0.99),and the average recovery of main peaks were in the range of 60%-120%.As a result,this method is simple,fast and credible and can be applied to screen and detect these pesticide residues in Chinese chestnut.
High performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS);Chinese chestnut;Pesticide residue
S664.2
:A
:1008-1631(2016)06-0097-09
2016-06-08
河南省基础与前沿技术研究项目(1423004132081)
侯霞(1979-),女,河南周口人,工程师,硕士,主要从事食品安全分析工作。E-mail:houxia1213@sina.com。
