CDK8缺失和/或SHP-2过表达后对SiHa 细胞增殖能力的影响
2016-02-13孟斐
孟 斐
(沈阳医学院附属中心医院妇产科,辽宁 沈阳 110024)
CDK8缺失和/或SHP-2过表达后对SiHa 细胞增殖能力的影响
孟 斐
(沈阳医学院附属中心医院妇产科,辽宁 沈阳 110024)
目的研究CDK8缺失和/或SHP-2过表达后对SiHa 细胞增殖能力的影响。方法 选取SiHa 细胞,利用RNA干扰技术,敲除CDK8,干扰CDK8蛋白表达;利用质粒转染技术高表达SHP-2蛋白。采用免疫印迹技术检测CDK8和SHP-2蛋白表达,同时观察并检测SiHa 细胞的增殖能力的情况。结果 实验结果表明,CDK8被干扰后,抑制了SiHa细胞的增殖能力; SHP-2过表达后,SiHa细胞的增殖能力无变化。结论 在宫颈癌细胞中,CDK8的缺失和/或SHP-2过表达影响SiHa 细胞的增殖能力,进一步验证在宫颈癌细胞中CDK8和/或SHP-2与SiHa 细胞存在相关性。
CDK8;SHP-2;SiHa 细胞;增殖能力
世界范围内发病率在女性恶性肿瘤中排第二位的是宫颈癌[1]。当前,宫颈癌是妇科肿瘤中少量已找到明确病因的肿瘤之一,其发病主要是由于人乳头瘤病毒(HPV)感染后引发机体内源性反应,如激活有关癌基因、抑癌基因活性受到抑制和整个基因组机体免疫调节机制紊乱等一系列病理性改变,进而引发细胞增殖与凋亡的反常,致使正常组织发生癌变[2]。由本课题组以前的研究可知SHP-2在宫颈组织是HPV感染的免疫应答反应中的负性调节因子;CDK8是一个已知的致癌基因,且在宫颈癌中高表达;SHP-2在宫颈病变发生发展中的免疫调节机制,是诱导产生的TGF-β通过CDK8的调节来实现的。本文主要探讨在宫颈癌细胞中,CDK8的缺失和/或SHP-2的高表达是否影响SiHa细胞的增殖能力,进一步验证在宫颈癌细胞中CDK8和/或SHP-2与SiHa 细胞的相关性。
1 资料与方法
1.1 一般资料
SiHa细胞,CCK8(DojinDo,日本),0.25%Trypsin-EDTA(1X)(Gibco,美国),Fetal Bovine Serum(Gibco,美国),96孔板(Corning,美国),酶标仪(Molecular Device,美国),倒置显微镜(Olympus,日本)。
1.2 方法
1.2.1 慢病毒感染靶细胞
第1d,以合适的比例接种靶细胞于T25的培养瓶中(两组,对照组和处理组)。第2d,感染前,病毒原液从-80℃冰箱取出后冰浴融化,用含5μg/ml Polybrene的新鲜培养基按合适的MOI值稀释病毒原液,吸除对照组和处理组原有的培养基,含有慢病毒阴性对照稀释液加到对照组细胞中,含有CDK8敲低和SHP2过表达的慢病毒稀释液加到SiHa细胞中 (换液时间可根据细胞状态可适当延长)。第3d,感染效率检测,实时定量PCR验证CDK8的敲低效果;WB验证SHP2的过表达效果。
1.2.2 细胞准备
小心吸去培养液,用1xPBS清洗,弃掉1×PBS后,加入适量胰酶;在显微镜下观察细胞,若胞质回缩,细胞之间不再连接成片,表明此时细胞消化适度。弃去胰酶,加入适量预热的新鲜培养液,将细胞吹打分散均匀,将细胞悬液吸入15mL离心管中,室温,800rpm,离心5min ,弃去培养液,加入新鲜培养液,将细胞吹打均匀,血球计数板计数。
1.2.3 常规培养
以3000个(100µL)/孔的密度铺于96孔板中,37℃,5%CO2,常规培养。
1.2.4 MTT实验
分别于24h,48h,72h,96h,120h后,在相应的孔(100µL培养液)中加入10µLCCK8(3复孔),37℃孵育2h后,450nm 测定吸光度(OD450)。
1.3 统计学方法
采用SPSS17.0统计软件进行单因素方差分析。
2 结 果
实验结果表明,CDK8被干扰后,抑制了SiHa细胞的增殖能力; SHP-2过表达后,SiHa细胞的增殖能力无变化,见图1,图2。
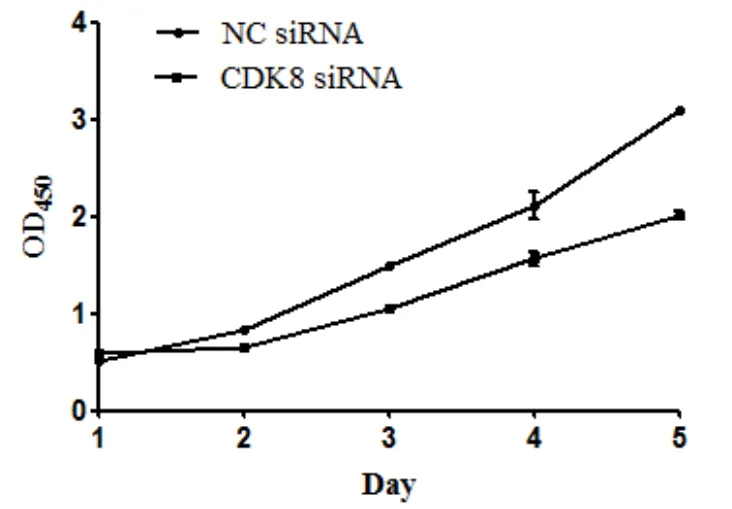
图1 实验结果表明,CDK8被干扰后,抑制了SiHa细胞的增殖能力
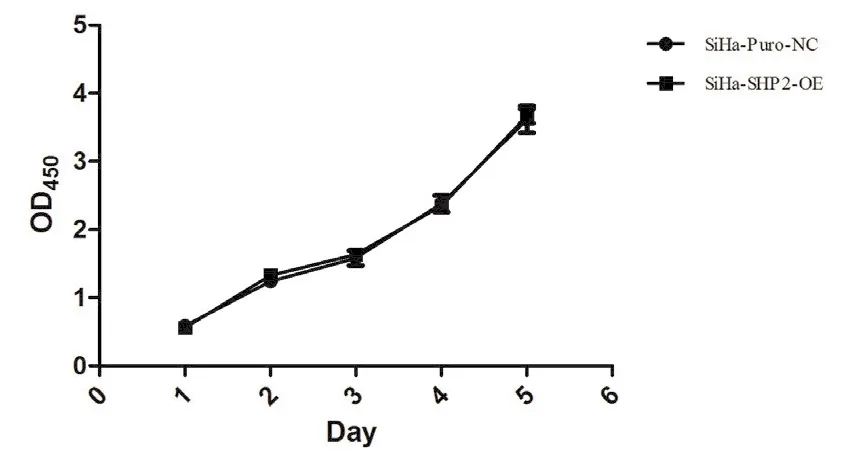
图2 SHP-2过表达后,SiHa细胞的增殖能力无变化
3 讨 论
恶性肿瘤的发生过程是极其复杂的,它可以通过很多种不同的途径发生,恶性肿瘤的发生发展是一个漫长的过程,要经过许多不同的阶段,在恶性肿瘤发展的过程中细胞可能会过度增殖,而凋亡却可能受到抑制,这种机体的平衡失控可能是肿瘤发展的因素之一[3],因此抑制肿瘤细胞增殖和诱导其凋亡是治疗肿瘤的方向之一。
CDKs在细胞增殖和分化中发挥重要的调控作用[4-5],当CDK8调控作用发生异常时,将导致细胞增殖、分化或凋亡的异常,从而导致发育异常或疾病的发生[6-7]。人类某些癌症与CDK8的功能失调与过度表达存在相关性[8]。近来发现,SHP-2参与了许多人类疾病的发病,而转基因小鼠模型的建立证实SHP-2在免疫系统中发挥作用。科学研究已证实,激活免疫反应的,是机体内一类天然免疫识别受体“家族”,学名叫做Toll样受体。它们能识别病毒,“通知”
免疫细胞,并“诱导”后者产生抗病毒的炎症细胞因子和I型干扰素等。安华章等发现:SHP-2是免疫系统的“刹车蛋白”,它在免疫反应中起负向调控作用。每每免疫反应被激活,就会有一类名为SHP的蛋白磷酸酶伴随出现。进一步研究显示,SHP-2分子正是免疫系统中的“刹车”,当病原体统统被消灭后,SHP-2会“喊停”,让免疫反应适可而止。一旦身体状况出现异常,“刹车”便“失灵”了,给了疾病可乘之机[9]。
本组资料中选取SiHa 细胞,利用RNA干扰技术,敲除CDK8,干扰CDK8蛋白表达;利用质粒转染技术高表达SHP-2蛋白。采用免疫印迹技术检测CDK8和SHP-2蛋白表达,同时观察并检测SiHa细胞的增殖能力情况,结果显示CDK8被干扰后,抑制了SiHa细胞的增殖能力;SHP-2过表达后,SiHa细胞的增殖能力无变化,说明了在宫颈癌细胞中,CDK8的缺失和/或SHP-2的表达影响SiHa 细胞的增殖能力,进一步验证在宫颈癌细胞中CDK8和/或SHP-2与SiHa 细胞存在相关性。
[1] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2] 王艳萍,徐 静,张丽钰,等.中药清毒栓对宫颈癌SiHa细胞抑制作用的影响[J]. 中国老年学杂志,2016,36(8):1822-1825.
[3] 于妍妍.中药清毒栓对宫颈癌SiHa细胞凋亡的影响[J].疑难病杂志,2008,8(9):531-533.
[4] 李 斌,张志强.肿瘤干细胞标记物eo133和pCAM在子宫内膜癌中的表达及意义[J].中国肿瘤临床,2012,39(7):1281-1282.
[5] 李世金,张爱臣.CDK8在子宫内膜癌中的表达及其临床意义[J].中国实验诊断学,2013,17(1):88-90.
[6] 王丽琴.子宫内膜癌临床诊治的研究进展[J].中国肿瘤临床与康复,2012,19(5):472-474.
[7] 邓赫男.宫内膜癌分子标志物与临床病理特征及预后的关系[J].河北医学,2014,20(4):631-632.
[8] 赵允菲,王福玲.CIM+CD25+Foxp3+T细胞在子宫内膜癌中的表达及意义[J].免疫学杂志,2013,29(7):611-614.
[9] 孟 斐.SHP-2在HPV致宫颈癌中的免疫作用[D].中国医科大学,2010.
R711.74
A
ISSN.2095-8803.2016.10.017.02
