不同浓度重碳酸盐对诸葛菜和油菜叶绿素荧光参数的影响
2016-02-11赵宽邢德科刘赵文陈松
赵宽,邢德科,刘赵文,陈松
(1.安庆师范大学资源环境学院,安徽安庆246133;2.现代农业装备与技术教育部重点实验室江苏大学农业工程研究院,江苏镇江212013)
不同浓度重碳酸盐对诸葛菜和油菜叶绿素荧光参数的影响
赵宽1,邢德科2,刘赵文1,陈松1
(1.安庆师范大学资源环境学院,安徽安庆246133;2.现代农业装备与技术教育部重点实验室江苏大学农业工程研究院,江苏镇江212013)
以诸葛菜和油菜为材料,研究了6个重碳酸盐水平对两种植物叶绿素荧光参数的影响。结果表明,与对照组相比(CK),低浓度的重碳酸盐(1,5mmol·L-1)使两种植物的光系统Ⅱ(PSⅡ)的参数,如原初光能转化效率(F v/F m)、潜在活性(F v/F o)、捕获激发能的效率(F m/F o)和表观光合电子传递速率(ETR)等随处理时间的延长而上升;高浓度的重碳酸盐(20,40mmol·L-1)使两种植物的4个荧光参数下降;在中等浓度重碳酸盐中(10mmol·L-1),诸葛菜的4个参数上升,但小于对照组,而油菜则呈下降趋势。这说明重碳酸盐浓度升高可能对油菜PSⅡ原初反应的抑制性更强,诸葛菜更适应于重碳酸盐胁迫环境下的生长,此结果选择喀斯特适生性植物提供了理论依据。
诸葛菜;油菜;重碳酸盐;叶绿素含量;叶绿素荧光
诸葛菜(Orychophragmus.violaceus)和油菜(Brassica.napus)均为十字花科草本植物。诸葛菜主要分布在我国西南云贵川、华东江浙皖赣等地区;常见于林地、路边裸地和潮湿荒滩地;喜温暖湿润气候,抗盐碱,耐寒性较强;具备一定的食用和药用价值[1-2]。油菜广泛分布在我国的大部分地区,在全世界也是一种常见的油料作物;适宜生长在土层深厚、有机质含量较高、水分适宜、pH为弱酸或中性的土壤环境;抗旱抗寒能力较强。高重碳酸盐含量是喀斯特地貌的主要特征之一[3-4]。喀斯特环境中生长的植物获取的碳更多的是来源于无机碳,而喀斯特环境的大气CO2浓度基本上是稳定的,因此喀斯特环境中生长的植物可能还需要利用环境中其他无机碳源,土壤中的无机碳(CO2,HCO3-,CO32-)是这些无机碳源的重要组成部分[5]。
叶绿素荧光动力学作为鉴定植物抗逆性的理想指标和技术已被广泛应用于农林园艺等方向[6-8]。光合结构特别是光系统Ⅱ(PSⅡ)对不同环境胁迫非常敏感,一些常用的表征PSⅡ的参数,如捕获激发能的效率(F m/F o)、潜在活性(F v/F o)等叶绿素荧光参数值能够反映逆境胁迫的程度,可作为植物抗逆性的选择指标[9-10];原初光能转化效率(F v/F m)和F v/F o通常用来说明PSⅡ的潜在量子效率[11],PSⅡ表观光合电子传递速率(ETR)用来表示叶片光合电子传递情况,它与表观光合速率(PSⅡ/50)可以说明经过暗处理植物的光合特征[12-13]。
目前已有将诸葛菜作为喀斯特的适生性植物进行了广泛的研究[14],然而,将叶绿素荧光技术应用于重碳酸盐胁迫下诸葛菜的研究还未见报道。研究重碳酸盐处理对植物叶绿素荧光特性的影响,可以为喀斯特适生性植物的研究提供重要理论依据。因此,研究不同重碳酸盐处理诸葛菜和油菜叶绿素荧光参数的变化特征,以期全面地理解碳酸盐胁迫下诸葛菜和油菜幼苗光合机构功能的变化,为植物的喀斯特环境适应性提供技术支撑。
1 材料与方法
1.1 试验材料
供试诸葛菜采自江苏镇江市南山风景区,油菜品种为秦优7号。用50孔穴盘育苗,育苗基质为有机肥料与温室土壤的混合物,有机肥料与土壤的比例为1∶1。
1.2 试验设计
在江苏大学农业工程研究院温室进行播种育苗,待其长出两片真叶后,移栽至3×4的穴盘(有托底)中进行培养,每个穴孔中移栽2株幼苗,转移至江苏大学人工气候室,条件为夜温/昼温为25℃/30℃,CO2浓度控制在360μmol· mol-1,空气湿度控制在70%,光周期为14 h,光照强度为300μmol·s-1·m2。
以Hoagland营养液[15]为母液,幼苗培养30天后,开始进行重碳酸盐的胁迫处理,HCO3-以碳酸氢钠(NaHCO3)的形式加入,共设置6个处理:分别为对照(CK,无HCO3-),1,5,10,20和40mmol·L-1的碳酸氢钠溶液。
1.3 测定指标与方法
1.3.1 叶绿素含量的测定
叶绿素含量用SPAD-502叶绿素含量测量仪测定,在各植株上均匀选取生长良好的叶片进行测定。每个处理组选取6株植物幼苗进行测定,每株植物重复测定3次。
1.3.2 叶绿素荧光参数的测定
在人工气候室中,利用IMAGING-PAM调制式叶绿素荧光仪(德国HeinzWalzGmbH公司)测定不同重碳酸盐处理下的诸葛菜和油菜的叶绿素荧光特性,测定指标包括PSⅡ最大光能转化效率(F v/F m)、PSⅡ的潜在活性(F v/F o)、PSⅡ捕获激发能的效率(F m/F o)和PSⅡ表观光合电子传递速率(ETR)等荧光参数,测定前先将叶片暗适应20 min。每个处理组选取6株植物幼苗进行测定,每株植物重复测定3次。
1.4 数据处理
采用Simgaplot软件进行数据处理和图表绘制,采用SPSS统计软件的Duncan法进行处理间的差异显著性分析。
2 结果与分析
2.1 不同重碳酸盐处理对诸葛菜和油菜叶绿素含量的影响
从图1可以看出,随着处理时间的变化,两种植物呈现出不同的变化规律。其中在HCO3-浓度为20,40mmol·L-1时诸葛菜和油菜的叶绿素相对含量均随着时间的增加而降低,均低于对照组(CK),且40mmol·L-1时的叶绿素含量显著低于20mmol·L-1时的叶绿素含量;HCO3-浓度为1,5 mmol·L-1时叶绿素含量随着时间的增加而增加,均高于对照组(CK),且5mmol·L-1时的叶绿素含量大于1mmol·L-1时的叶绿素含量;在浓度为10 mmol·L-1时两种植物变化规律不一致,其中诸葛菜随着处理时间的增加而增加,而油菜则在0~6天这段时间内有所增加,之后呈下降趋势,两种植物的叶绿素含量均低于对照组(CK)的叶绿素含量,表明两种植物的叶片对HCO3-浓度的胁迫有所不同。叶绿素含量的变化反映了植物的光合能力和荧光特性的不同,以下通过叶绿素荧光参数反映两种植物在不同重碳酸盐胁迫下的影响。
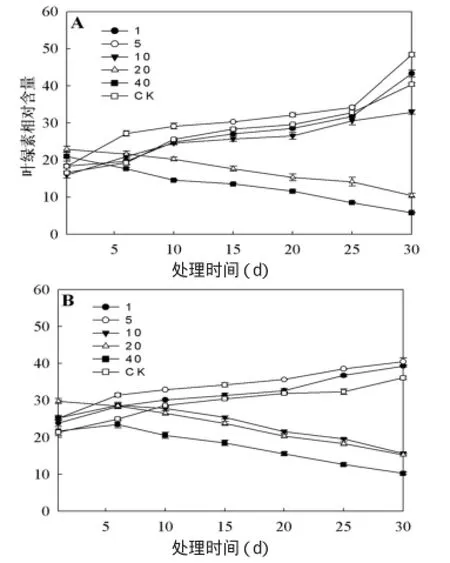
图1 不同重碳酸盐浓度处理下诸葛菜(A)和油菜(B)叶绿素含量的变化趋势
2.2 不同重碳酸盐处理对诸葛菜和油菜叶绿素荧光参数的影响
由图2可以看出,两种植物各自的4个叶绿素荧光参数随着重碳酸盐处理的变化规律基本一致,诸葛菜为5>1>10>CK>20>40,油菜为5>1>CK>10>20>40。且在低浓度时(1,5mmol·L-1)两种植物的4个荧光参数随着培养时间的增加而增加;中等浓度时(10mmol·L-1)诸葛菜表现出增加的趋势,而油菜则在0~6天内有一定的增加,之后(6~30天)呈下降趋势;在高浓度时(20,40 mmol·L-1)两种植物均在0~6天有所增加,之后呈显著下降趋势(15~30天),这表明两种植物对重碳酸盐的响应存在差异。
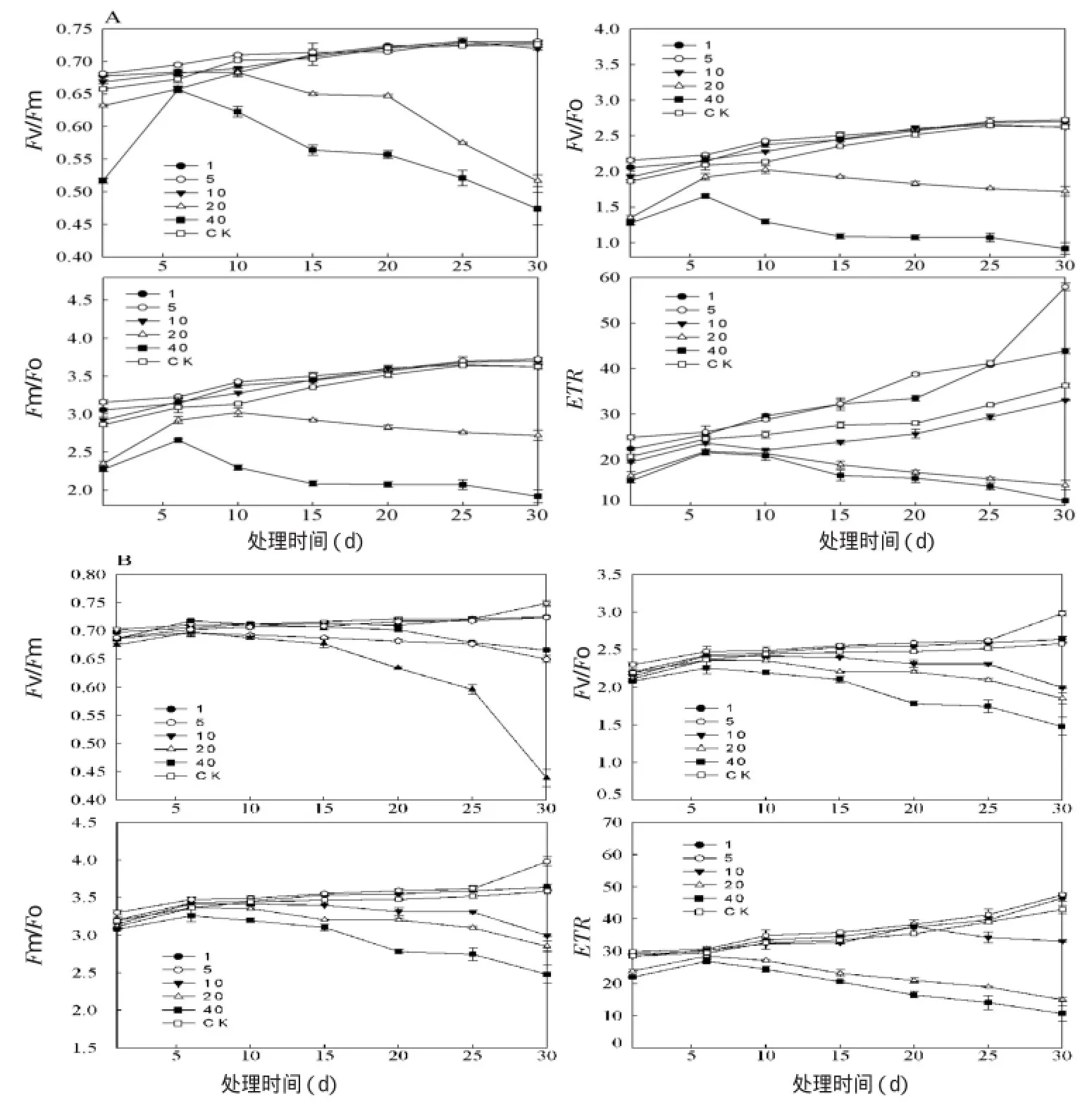
图2 不同重碳酸盐浓度处理下诸葛菜(A)和油菜(B)叶绿素荧光参数的变化趋势
随着重碳酸盐浓度的增加,诸葛菜和油菜的PSⅡ原初光能转化效率变化有所不同,在低浓度处理下两种植物PSⅡ原初光能转化效率增大,潜在活性被激发出来,促进了它们叶片光合作用的原初反应;在中等浓度胁迫下,促进了诸葛菜叶片光合作用的原初反应,油菜在一段时间(0~6天)之后的PSⅡ原初光能转化效率下降,其潜在活性中心受损,抑制了其光合作用的原初反应;在高浓度时,两种植物的PSⅡ原初光能转化效率均下降,浓度越高,叶片光合作用原初反应的抑制效果越大,从而对植物的生长有害。两种植物的PSⅡ潜在活性F v/F o和PSⅡ捕获激发能的效率F m/F o均表现出相同的规律。
同时,ETR也表现出相同的趋势,在低浓度和中等浓度下,诸葛菜的ETR增加量显著大于油菜,ETR从侧面反映了植物的表观光合速率(PSⅡ/50)变化趋势。
3 讨论
叶绿素含量直接影响光合作用的强弱程度[16-17]。逆境胁迫下植物的生长发育及植物-土壤界面的许多生理过程都会受到显著影响,这会直接或间接影响叶绿素含量,从而导致叶绿素荧光参数变化[18]。水分逆境下,许多植物的荧光参数都随着植物体内水分的流失而下降[19-21]。外界CO2升高的环境下,绿豆生长后期PSⅡ反应中心结构受到破坏,从而使绿豆叶片的光合能力下降[22]。本实验中,诸葛菜和油菜在重碳酸盐胁迫下的F v/F m,F v/F o,F m/F o和ETR这4个参数的变化规律与前人的研究结果类似。两种植物的叶绿素含量在低浓度重碳酸盐胁迫下(1,5mmol·L-1)及对照处理(CK)中均随着处理时间的增加而增加,两种植物的F v/F m,F v/F o,F m/F o均在5mmol·L-1时最大,此时显著促进了其光合原初反应。在高浓度重碳酸盐胁迫下(20mmol·L-1)两种植物的叶绿素荧光参数均下降,这说明两种植物在高浓度环境下的适应性均较弱;高浓度重碳酸盐胁迫下(20,40mmol·L-1)其含量降低,且浓度越高,诸葛菜和油菜的荧光参数值降低越快;在中等浓度下(10mmol·L-1)诸葛菜的叶绿素含量增加,油菜则呈下降趋势,且均低于对照处理(CK)组,这说明中等胁迫对诸葛菜的影响较小,而油菜而受该环境的影响,对其生长不利。
两种植物在重碳酸盐胁迫下其环境适应性不同,低浓度和高浓度重碳酸盐处理两种植物的环境适应性类似,两种植物能适应低浓度重碳酸盐环境,不适应高浓度重碳酸盐环境。在中等浓度重碳酸盐处理时,诸葛菜的环境适应性强于油菜,表明重碳酸盐胁迫对不同植物光合作用和叶绿素含量影响不同。诸葛菜对重碳酸盐的环境胁迫的适应性更强,这对我们选择喀斯特适应性植物提供了进一步的理论依据。
[1]任全进,于金平,张广伦.诸葛菜资源的综合利用[J].中国野生植物资源,1998,17(2):24-25.
[2]罗鹏,钟蓉,吴沿友,等.诸葛菜种质资源的评价和研究[J].作物品种资源,1995(1):16-18.
[3]YANG Z S,YANG L F,ZHANG B S.Soil erosion and its basic characteristics atkarst rocky-desertified land consolidation area:a casestudyatMuzhe villageof Xichou county in SoutheastYunnan, China[J].JournalofMountain Science,2010,17:55-72.
[4]ZHANGQ,XU CY,ZHANG Z X,etal.Precipitation extremes in a karst region:a case study in the Guizhou province,southwestChina [J].Theoreticaland Applied Climatology,2010,101:53-65.
[5]刘丛强.生物地球化学过程与地表物质循环——西南喀斯特土壤-植被系统生源要素循环[M].北京:科学出版社,2009.
[6]李晓,冯伟,曾晓春.叶绿素荧光分析技术及应用进展[J].西北植物学报,2006,26(10):2186-2196.
[7]SCOTT T L,JANUSZ A,PERKINS M V,et al.Effect of amphetamineprecursorsandbyproductsonsoilenzymesoftwourban soils[J].Bulletin of Environmental Contamination and Toxicology, 2003,70:824-831.
[8]温国胜,田海涛,张明如,等.叶绿素荧光分析技术在林木培育中的应用[J].应用生态学报,2006,17(10):1973-1977.
[9]杨晓青,张岁岐,梁宗锁,等.水分胁迫对不同抗旱类型冬小麦幼苗叶绿素荧光参数的影响[J].西北植物学报,2004,24(5):812-816.
[10]罗青红,李志军,伍维模,等.胡杨、灰叶胡杨光合及叶绿素荧光特性的比较研究[J].西北植物学报,2006,26(5):983-988.
[11]李绍长,胡昌浩,龚江,等.低磷胁迫对磷不同利用效率玉米叶绿素荧光参数的影响[J].作物学报,2004,30(4):365-370.
[12]赵素芬,何培民.高温对两种卡帕藻的酶活性、色素含量与叶绿素荧光的影响[J].生态学报,2011,31(22):6845-6852.
[13]王文杰,张衷华,祖元刚,等.薇甘菊(Mikaniamicrantha)非同化器官光合特征及其生态学意义[J].生态学报,2009,29(1):28-36. [14]吴沿友,刘丛强,王世杰.诸葛菜的喀斯特适生性研究[M].贵阳:贵州科技出版社,2004.
[15]HOAGLAND D R,ARNON D I.The water-culturemethod for growing plantswithoutsoil[J].California Agricultural Experiment Station,1950,347:36-39.
[16]呼和牧仁,周梅,翟洪波,等.影响树木光合作用因素的研究进展[J].内蒙古农业大学学报,2009,30(2):287-291.
[17]吴沿友,邢德科,朱咏莉,等.营养液pH对3种藤本植物生长和叶绿素荧光的影响[J].西北植物学报,2009,29(2):0338-0343.
[18]魏霞,李守中,郑怀舟,等.叶片气体交换和叶绿素荧光在植物逆境生理研究中的应用[J].福建师范大学学报(自然科学版),2007,23(4):124-128.
[19]李立辉,王岩,胡海燕,等.初花期干旱对不同抗旱性紫花苜蓿光合特征及荧光参数的影响[J].华北农学报,2015,30(4):126-131. [20]尹赜鹏,刘雪梅,商志伟,等.不同干旱胁迫下欧李光合及叶绿素荧光参数的响应[J].植物生理学报,2011,47(5):452-458.
[21]罗明华,胡进耀,吴庆贵,等.干旱胁迫对丹参叶片气体交换和叶绿素荧光参数的影响[J].应用生态学报,2010,21(3):619-623.
[22]郝兴宇,韩雪,李萍,等.大气CO2浓度升高对绿豆叶片光合作用及叶绿素荧光参数的影响[J].应用生态学报,2011,22(10):2776-2780.
Effectof Different Bicarbonate Treatmentson Chlorophyll Fluorescence Parametersof Orychophragmus.violaceus and Brassica.napus
ZHAO Kuan1,XING De-ke2,LIU Zhao-wen1,CHEN Song1
(1.School of Resources and Environments,Anqing Normal University,Anqing,Anhui246133,China;
2.Key Laboratory ofModern Agricultural Equipmentand Technology,Ministry of Education,Institute of Agricultural Engineering,Jiangsu University,Zhenjiang,Jiangsu 212013,China;)
The experiment is conducted to examine the effectsof six bicarbonate treatments on chlorophyll fluorescence in two plants(Orychophragmus.violaceus and Brassica.napus).The results show that themaximum photochemical efficiency of PS II(Fv/Fm),the potential activity of PSⅡ(Fv/Fo),the capture excitation energy efficiency of PSII(Fm/Fo)and the apparent electron transport rate of PS II(ETR)of two plants increase with the prolong of treatment time under low concentrations of bicarbonate concentration(1,5mM/L)compared to the control treatment(CK),and four chlorophyll fluorescence parameters of the two plants decrease under high concentration of bicarbonate concentration(20,40mM/L),and four chlorophyll fluorescence parameters of Orychophragmus.violaceus increase,but less than the control treatment,while Brassica.napus decrease with increasing of treatment time under medium bicarbonate concentration.The results suggest that the increase of bicarbonate concentration could more inhibit PSⅡreaction of Brassica.napus,Orychophragmus.violaceus’s adaptability to stress environment of bicarbonate is stronger than Brassica.napus,which provides a theoretical basis for the selection of the plants adaptability to karst.
Orychophragmus.violaceus;bicarbonate;chlorophyll content;chlorophyll fluorescence
Q945.79
A
1007-4260(2016)04-0085-04
时间:2017-1-3 17:19
http://www.cnki.net/kcms/detail/34.1150.N.20170103.1719.022.html
2016-05-17
国家自然科学基金(31301243),安徽省科技厅公益性技术应用研究项目(1501ld04050),安庆师范学院人才引进项目(140001000032)和安庆师范学院大学生创新创业培育项目(CXZ15026)。
赵宽,男,安徽池州人,博士,安庆师范大学资源环境学院讲师,研究方向为植物-土壤系统生理生化。
E-mail:henry3408@126.com
10.13757/j.cnki.cn34-1150/n.2016.04.022
