源自黄斑篮子鱼肠道菌群的B30菌株降解浒苔多糖的活性研究
2016-02-10谢罗瀚韩学凤张志标张青岩钟名其
谢罗瀚,韩学凤,张志标,李 进,张青岩,钟名其*,胡 忠
(1.汕头市金山中学,广东汕头 515073;2.汕头大学生物系,广东汕头 515063)
源自黄斑篮子鱼肠道菌群的B30菌株降解浒苔多糖的活性研究
谢罗瀚1,a,韩学凤2,a,张志标2,李 进2,张青岩1,钟名其2*,胡 忠2
(1.汕头市金山中学,广东汕头 515073;2.汕头大学生物系,广东汕头 515063)
以浒苔多糖作为唯一碳源,从黄斑篮子鱼肠道菌群筛选得到一株能够降解浒苔多糖的菌株,经16S rDNA鉴定为Vibrio sp.B30;其产浒苔多糖降解酶的最适条件为培养时间24 h、温度30℃、起始pH值为7、最适氮源为硫酸铵.该酶的最适反应催化温度为50℃、pH值为7,并且10 mmol/L的钙离子或钠离子能够较明显提高该酶酶活力.0.5 g/L和1 g/L的NP40、聚氯乙烯月桂醚、Tween80、Tween20、TritionX-100表面活性剂对浒苔多糖降解酶活力具有一定的提高作用.
浒苔多糖;降解;Vibrio sp.B30;黄斑篮子鱼肠道菌群
浒苔这一绿藻资源非常丰富,浒苔中浒苔多糖的含量高达50%.浒苔多糖在一定分子量范围内具有降血糖、提高免疫力、抗肿瘤等生物学活性[1-2];在辅助剂作用下可生成活性炭[3];同时浒苔多糖被降成还原糖可作为一种新型的生物能源[4].但是由于浒苔多糖分子量大,所以浒苔多糖在应用方面受到了很大的限制[1].将大分子的海藻多糖降解为低分子量的寡糖是当前研究的重点和热点.目前将大分子的海藻多糖降解为小分子的寡糖的降解方法主要有物理法、化学法、酶法.酶降解法是利用酶作为一种特殊的生物催剂,具有极强的底物和产物专一性,可选择性地酶解特定糖苷键得到特定寡聚糖,还不造成环境污染.
许多海洋动物都喜欢以海藻为食物,因此海洋动物消化道内存在着丰富的多糖降解酶.Sugita等[5]研究发现在鱼肠道和梭子蟹中广泛存在着产酶菌株.Romanenko等[6]从海洋无脊椎动物中分离到了一株新的琼脂降解菌Glaciecola mesophila KMM241.Cieslinski等[7]从南极磷虾消化道中分离得到产β-半乳糖苷酶的菌株Pseudoalteromonas sp.22b,对该基因进行了克隆表达及酶学性质的分析.2013年,冷晓飞等[8]对养殖和野生皱纹盘鲍(Haliotis discus hannai Ino)不同个体间肠道菌群数量和种类组成进行了研究,并采用PCR-DGGE指纹技术对比分析了二者肠道优势菌群的差异;他们发现,养殖和野生皱纹盘鲍肠道优势菌基本相同,均为弧菌属Vibrio,次优势菌均为玫瑰杆菌属(Roseobacter)和希瓦氏菌属(Shewanella).
黄斑篮子鱼喜好以浒苔为食物,肠道内可能存在着丰富的能够降解浒苔多糖的微生物资源及酶资源;最近,本课题组Zhang等[9]从黄斑篮子鱼的肠道菌群分离到能降解浒苔多糖的一个微生物菌群.本研究进一步从黄斑篮子鱼的肠道菌群分离能利用浒苔多糖的微生物单菌,并研究了其产浒苔多糖降解酶的能力.
1 材料与方法
1.1 实验材料、化学试剂及培养基
黄斑篮子鱼由渔民从汕头市南澳海区捕捉,并用浒苔作为饲料对篮子鱼进行驯养.
胰蛋白胨和酵母提取物均为MDBio公司产品,其他无机盐等试剂为上海生工生物工程公司分析纯试剂,2×PCR TaqMix、PCR产物凝胶回收试剂盒购买于广东东盛生物科技有限公司.DNAmaker、pMD19-T vector购买于TaKaLa公司,RNAse A、蛋白酶K和溶菌酶购买于Sigma公司.菌株Escherichia coli 5α为本实验室保存.博检革兰氏阴性细菌鉴定系统购买于青岛海博生物有限公司.
3,5二硝基水杨酸(DNS)试剂:3,5二硝基水杨酸1%,亚硫酸钠0.05%,氢氧化钠1%,酒石酸钠20%,苯酚0.2%;配好后存储于棕色瓶一周后使用.
人工海水:NaCl 20 g;MgCl2·6H2O 3.0 g;MgSO4·7H2O 6.0 g;(NH4)2SO41.0 g;NaHCO30.2 g;CaCl2·2H2O 0.3 g;KCl 0.5 g;KH2PO40.42 g;NaBr 0.05 g;SrCl·6H2O 0.02 g.
浒苔多糖降解酶筛选培养基:取10 g浒苔加500 mL水于90℃水浴锅中浸提3 h后用纱布过滤掉浒苔残渣,6 000 rpm离心10 min取上清液;直接用人工海水与上清液混合,配制成以浒苔多糖为唯一碳源的选择培养基.
1.2 浒苔多糖降解菌的筛选及理化特性分析
对黄斑篮子鱼的体表进行消毒后,在无菌条件下取出肠道,再用灭菌的镊子挑出除肠道外的其他篮子鱼器官,加入10 mL的生理盐水进行剪碎;然后用灭菌的纱布过滤、再梯度稀释成10-3、10-4、10-5、10-6的梯度后涂布于含浒苔唯一碳源的固体培养基上;挑取能在培养基上生长的菌落,通过液体培养的发酵液中浒苔多糖降解酶活力的测定(DNS法)来初步确定该菌是否具有浒苔多糖降解能力.
利用购买的革兰氏阴性菌鉴定系统,对浒苔多糖降解菌进行生理生化特性研究,主要有20个特性试验,如:ONPG、精氨酸(ADH)、赖氨酸(LDH)、鸟氨酸(ODC)、柠檬酸(CIT)、硫化氢(H2S)、脲酶(URE)、乳糖(LAC)、吲哚(IND)、VP、明胶(GEL)、葡萄糖(GLU)、甘露醇(MAN)、肌醇(INO)、山梨醇(SOR)、鼠李糖(RHA)、蔗糖(SAC)、蜜二糖(MEL)、苦杏仁甙(AMY)、阿拉伯糖(ARA).
1.3 浒苔多糖降解菌的分子鉴定
浒苔多糖降解菌DNA的提取参考SDS-CTAB法进行.利用细菌16SrDNA的通用引物27F(5’-GAG AGT TTG ATC CTG GCT CAG-3’)和1492R(5’-CGG CTA CCT TGT TAC GAC TTC-3’),以菌液DNA为模板,进行PCR反应.将PCR扩增产物用凝胶回收试剂盒进行回收,然后连接于pMD19-T vector上,转化进E.coli DH5α.挑取克隆子,并用pMD19-T vector上的通用引物M13进行验证,将阳性克隆送华大基因公司进行测序,测序回来的结果去除载体后,使用NCBI在线软件BLAST与已知微生物的16S rDNA进行相似性分析.
1.4 浒苔多糖降解菌粗酶液的制备及酶活检测
取-70℃保存浒苔多糖降解菌种,平板划线进行活化,挑取单菌落接种到含8 mL浒苔多糖培养基的试管中,在30℃、150 rpm下振荡培养8 h;以1%的比例接种到100 mL培养基中振荡培养36 h,4℃、9 000 rpm离心8 min沉淀菌体,上清液即为粗酶液.
按照DNS法,取1 mL粗酶液加入到1 mL 1%的浒苔多糖溶液中,50℃反应30 min;加入2 mL DNS,在沸水浴中煮10 min显色.然后向试管中加入4 mL蒸馏水,稀释后用紫外可见光光度计于540 nm处测OD值,以灭活酶液为对照.以OD值提高0.001定义为一个酶活力单位(U).
1.5 菌株产浒苔多糖降解酶发酵条件
将菌株按1%比例接种于添加浒苔多糖的培养基中,摇床转速150 rpm,分别在不同培养时间(12~60 h)、培养温度(25~40℃)、培养基起始pH(6.0~9.0)、不同氮源(蛋白胨、氯化铵、硫酸铵、尿素、酵母提取物)条件下培养,测定其发酵液的酶活力.
1.6 浒苔多糖降解酶部分性质分析
1.6.1 最适催化温度
取1.0 mL浒苔多糖降解酶酶液,加入1.0 mL、1%的浒苔多糖,分别在不同温度(30~60℃)中反应30 min,检测酶活.
1.6.2 pH值对酶活力的影响
配制pH值为6、7、8、9、10的缓冲液,再用其分别配制1%浒苔多糖溶液.然后取1 mL的粗酶液分别与不同pH值的底物于50℃水浴锅反应30 min后,检测其酶活.
1.6.3 金属离子对酶活力的影响
配制的1%浒苔多糖底物中加入1 mL的粗酶液,分别加入终浓度为10 mmol/L和25 mmol/L的钙、镁、钠、钾离子,50℃反应30 min后检测酶活.
1.6.4 表面活性剂对酶活力的影响
在以pH值为7的缓冲液中配制的1%浒苔多糖为底物,加入1 mL的粗酶液,然后分别添加终浓度为0.5 g/L和1 g/L的NP40、聚氯乙烯月桂醚、Tween80、Tween20、TritionX-100、Trition114,再于50℃水浴锅反应30 min后检测其酶活.
2 结果与分析
2.1 浒苔多糖降解菌株B30的分离及鉴定
通过富集培养和初筛,从黄斑篮子鱼肠道内共获得37株浒苔多糖降解菌,使用DNS法鉴定其产浒苔多糖降解酶的能力,发现大部分菌株的产酶能力不高;最后,选择酶活力较高的菌株B30作为研究对象.
使用通用引物27F和1492R,对菌株B30进行PCR扩增,获得的16S rDNA序列扩增产物进行琼脂糖凝胶电泳,结果如图1;同时,送深圳华大基因有限公司进行测序.将测序所得菌株B30的16S rDNA序列提交到NCBI做blastn程序对比分析,并构建菌株B30的系统进化树,如图2.结果表明,该菌株与Vibrio fluvialis具有99%的相似性,因此将该菌株归于Vibrio属,命名为Vibrio sp.B30.

图1 菌株B30 16S rDNA的PCR扩增产物电泳分析
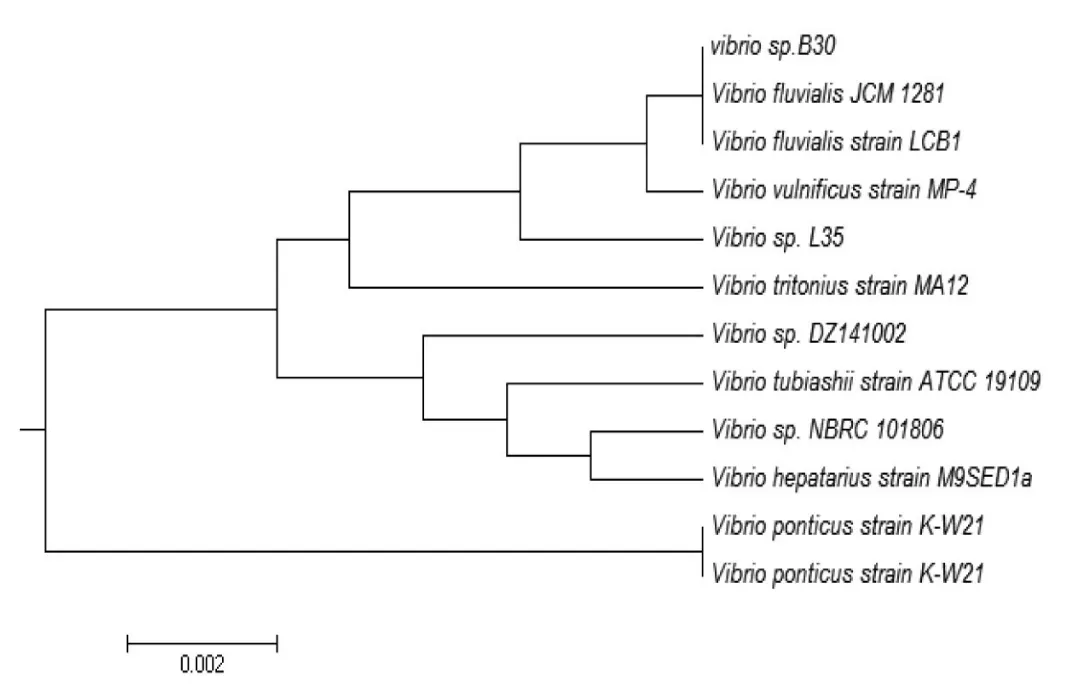
图2 菌株B30的16S rDNA序列的系统进化树
2.2 菌株B30的生理生化特性
按照博检革兰氏阴性菌鉴定系统说明书操作,得到菌株B30的基本生理生化结果,如表1.菌株B30可以利用吲哚、柠檬酸、明胶、甘露醇、阿拉伯糖等.

表1 菌株B30的生理生化特性
2.3 培养条件对菌株B30产浒苔多糖降解酶的影响
2.3.1 培养时间
分别设置了12 h、24 h、36 h、48 h、60 h等5个不同的发酵时间,研究了不同培养时间对菌株B30产浒苔多糖降解酶的影响.由图3可知,该菌株在培养24 h时,其产浒苔多糖水解酶的能力最高;随着培养时间的延长,其酶活力降低.
2.3.2 培养温度
分别设置25℃、30℃、35℃、40℃等4个培养温度,研究了不同培养温度对菌株B30产浒苔多糖降解酶的影响.由图4可知,B30最佳产酶温度为30℃;随着温度的提高,产酶量迅速下降.

图3 培养时间对菌株B30产浒苔多糖酶能力的影响

图4 培养温度对菌株B30产浒苔多糖酶能力的影响
2.3.3 培养基起始pH值
分别配置pH值为6、7、8、9的浒苔多糖培养基,研究了培养基中不同起始pH值对菌株B30产浒苔多糖降解酶的影响.由图5可知,菌株B30在起始pH值为7时酶活力最高,在pH值9时还具有一定的浒苔多糖降解酶活力;说明该菌株可以适应一定的碱性环境.
2.3.4 不同N源
实验中分别设置了蛋白胨、氯化铵、硫酸铵、尿素、酵母膏5种氮源,研究了不同氮源对菌株B30产浒苔多糖降解酶能力的影响.由图6可知,菌株发酵产浒苔多糖降解酶的最适氮源为硫酸铵,其氮源的影响依次为:硫酸铵>蛋白胨>酵母膏>氯化铵>尿素.

图5 起始pH值对菌株产浒苔多糖酶能力的影响

图6 N源对菌株B30产浒苔多糖酶能力的影响
2.4 菌株B30浒苔多糖降解酶的性质
2.4.1 最适催化温度
分别设置了30℃、35℃、40℃、45℃、50℃、55℃、60℃等7个反应温度,研究了不同反应温度对菌株B30产生的浒苔多糖降解酶能力的影响,结果如图7所示.从图7中可知,菌株B30产生的浒苔多糖降解酶最适合的催化温度为50℃;随着温度的升高,酶活迅速下降.
2.4.2 pH值对酶活力的影响
配制pH值为6、7、8、9、10的浒苔多糖底物,然后取1 mL的粗酶液分别与不同pH值的底物于50℃水浴锅反应30 min后检查其酶活.由图8可知,该酶的最适催化pH值为7,高于或低于pH值为7的条件下酶活性明显降低.
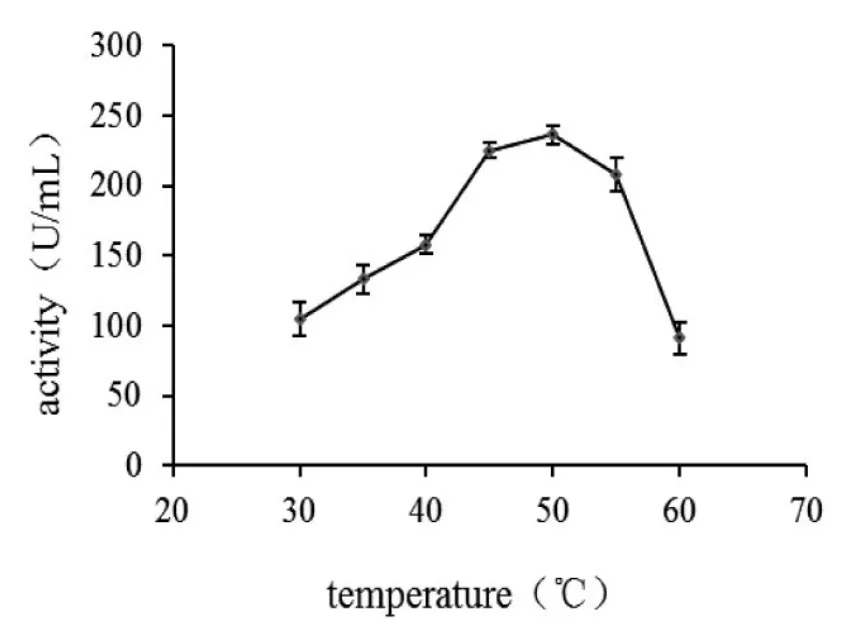
图7 反应温度对菌株B30产浒苔多糖降解酶的影响
2.4.3 金属离子对酶活力的影响
配制的1%浒苔多糖底物中分别加入1 mL的粗酶液,再加入终浓度分别为10 mmol/L和25 mmol/L的钙、镁、钠、钾等离子,结果如图9.从图9中可发现,10 mmol/L的钙离子、钠离子能够较明显提高菌株B30的浒苔多糖水解酶酶活力,10 mmol/L钾离子对浒苔多糖水解酶酶活力的提高作用较不明显,10 mmol/L镁离子能够抑制浒苔多糖水解酶酶活力.25 mmol/L的钙、镁、钠、钾等离子对浒苔多糖水解酶的酶活力均没有提高作用.
2.4.4 表面活性剂对酶活力的影响
以pH值为7的缓冲液配制1%的浒苔多糖为底物,由图10可知,终浓度分别为0.5 g/L和1 g/L的表面活性剂中,Trition114对浒苔多糖降解酶酶活力没有提高作用,其它的表面活性剂均能提高浒苔多糖降解酶酶活力.
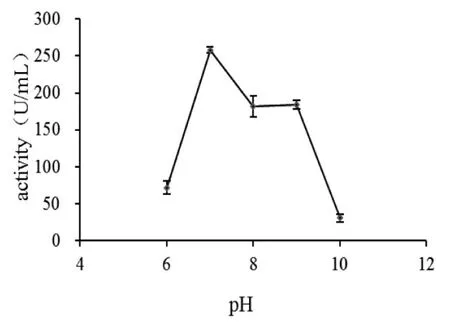
图8 pH值对菌株B30产浒苔多糖降解酶的影响
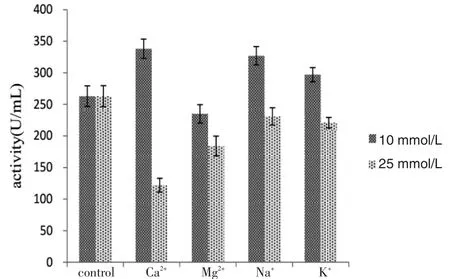
图9 金属离子对菌株B30产浒苔多糖降解酶的影响

图10 表面活性剂对菌株B30产浒苔多糖降解酶的影响
3 讨论
目前关于浒苔多糖的研究报道多集中在浒苔多糖的提取、结构及其活性的研究[1,10],而关于微生物降解利用浒苔多糖的报道不多.
2011年,赵超[11]从红树林筛选到一株能够利用浒苔多糖的降解菌株XQ12,研究发现其产酶能力也不高,这可能与浒苔多糖的复杂结构有关系.紧接着,Zhao等[12]继续从红树林中获得一个稳定高效的浒苔降解菌群D2-1,并发现在混合菌群D2-1中果胶酶活性远高于纤维素酶及木聚糖酶,表明在该菌群中产果胶酶的菌株起到了重要的作用.2013年,Li等[13]从青岛海洋沉积物中也筛选得到了一株浒苔多糖降解菌株Alteromonas sp.A321.最近,本课题组[9]利用嗜好以浒苔为食物的黄斑篮子鱼进行研究,从其肠道菌群中分离到一个能降解浒苔多糖的微生物菌群.以此为基础,本研究进一步从黄斑篮子鱼的肠道菌群中分离能利用浒苔多糖的微生物单菌,结果发现用DNS法进行复筛浒苔多糖降解菌株的时候,菌株产浒苔多糖降解酶的能力都不高;而只有菌株B30产浒苔多糖降解酶的能力较强,并具有性状稳定、易于培养的特点.
Li等[13]利用获得的浒苔多糖降解菌Alteromonas sp.A321,对菌株产浒苔多糖降解酶的最适条件进行了优化,培养基的最佳组成为K2HPO40.15%、PE 0.9%、NaNO30.4%、NaCl 1.0%、MgSO40.05%;而影响浒苔多糖降解酶生产的理化因素中,最适温度为32℃、起始pH值为7.3.在氮源的作用中,依次为:NaNO3>牛肉膏>蛋白胨>酵母膏>(NH4)2SO4>大豆粉>NH4NO3>NH4Cl尿素,在不同的氮源中Na-NO3对于菌株生产浒苔多糖降解酶的效果最好.本研究也对菌株B30产浒苔多糖降解酶的最适条件进行了优化,发现培养时间24 h、温度30℃、起始pH值为7下产酶能力较强;同时,最适的氮源为硫酸铵,而尿素的效果也最差.此外,还证实了该酶的最适反应催化温度为50℃、pH值为7,并且10 mmol/ L的钙离子、钠离子能够较明显提高该酶的酶活力.
目前为止,国内外对微生物利用浒苔多糖机制、浒苔多糖降解酶的研究极少,严重影响了浒苔多糖的规模化利用.Han等[14]通过MALDI-TOF-TOF质谱技术获得了菌株Alteromonas macleodii B7的胞外能够降解浒苔多糖的淀粉酶AmySTU,并对其进行了克隆表达,底物特异性验证了重组酶具有降解浒苔多糖的功能.今后将进一步对菌株B30的浒苔多糖降解酶及利用浒苔多糖的机制开展深入研究,为浒苔多糖的高值化利用奠定基础.
[1]韩学凤,张志标,林伯坤,等.浒苔多糖研究进展[J].汕头大学学报(自然科学版),2014,29(3):46-50.
[2]魏鉴腾,裴栋,刘永峰,等.浒苔多糖的研究进展[J].海洋科学,2014,38(1):91-95.
[3]Gao Y,Yue Q Y,Sun Y Y,et al.Optimization of high surface area activated carbon production from Enteromorpha prolifra with low-dose activating agent[J].Fuel Processing Technology,2015,132:180-187.
[4]Kim D H,Lee S B,Jeong G T.Production of reducing sugar from Enteromorpha intestinalis by hydrothermal and enzymatic hydrolysis[J].Bioresource Technology,2014,161:348-353.
[5]Sugita H,Kawasaki J,Kumazawa J,et al.Production of amylase by the intestinal bacteria of Japanese coastal animals[J].Letters in Applied Microbiology,1996,23(3):174-178.
[6]Romanenko L,Zhukova N,Rohde M,et al.Glaciecola mesophila sp.nov.,a novel marine agar-digesting bacterium[J].International Journal of Systematic and Evolutionary Microbiology,2003,53(Pt 3):647.
[7]Cieslinski H,Kur J,Bialkowska A,et al.Cloning,expression,and purification of a recombinant cold-adapted beta-galactosidase from Antarctic bacterium Pseudoalteromonas sp.22b[J].Protein Expression and Purification,2005,39(1):27-34.
[8]冷晓飞,姜海峰,刘小林,等.皱纹盘鲍肠道菌群组成及PCR-DGGE+指纹图谱分析[J].海洋科学,2013,37(5):10-14.
[9]Zhang Z B,Han X F,Xu Y,et al.Biodegradation of Enteromorpha polysaccharides by intestinal micro-community from Siganus oramin[J].Journal of Ocean University of China,2016,15(6):1034-1038.
[10]石学连,张晶晶,宋厚芳,等.浒苔多糖的分级纯化及保湿活性研究[J].海洋科学,2010,34(7):81-85.
[11]赵超.绿藻浒苔生物降解及其利用的分析研究[D].广州:中山大学,2011.
[12]Zhao C,Ruan L.Biodegradation of Enteromorpha prolifera by mangrove degrading micro-community with physical-chemical pretreatment[J].Applied Microbiology and Biotechnology,2011,92(4):709-716.
[13]Li Y,Wang J,Yu Y,et al.Production of enzymes by Alteromonas sp.A321 to degrade polysaccharides from Enteromorpha prolifera[J].Carbohydrate Polymers,2013,98(1):988-994.
[14]Han X,Lin B,Ru G,et al.Gene Cloning and Characterization of an α-Amylase from Alteromonas macleodii B7 for Enteromorpha Polysaccharide Degradation[J].Journal of Microbiology and Biotechnology.2013,24(2):254-263.
A Study ofEnteromorphaPolysaccharides-Degraded Ability of Strain B30 fromSiganus OraminIntestina
XIELuo-Han1,a,HANXue-Feng2,a,ZHANGZhi-Biao2,LIJin2,ZHANGQing-Yan1, ZHONGMing-Qi2,*,HUZhong2
(1.Jinshan Middle School of Shantou,Shantou,Guangdong,515073; 2.Biology Department of Shantou University,Shantou,Guangdong,515063)
An Enteromorpha polysaccharides-degrading strain Vibrio sp.B30 is isolated from Siganus oramin intestinal using E.polysaccharides as the sole carbon source.The optimum fermentation conditions for producing E.polysaccharides lyase are cultivated 24h at 30℃,the initial pH 7,and the most suitable nitrogen source is ammonium sulfate.The E.polysaccharides lyase can be enhanced by Ca2+,Na+and surfactant NP40, Tween80,Tween20,TritionX-100.Vibrio sp.B30 from S.oramin intestinal can use E.polysaccharides as the sole carbon source.
Enteromorpha polysaccharide;degradation;Vibrio sp.B30;Siganus oramin intestina
X 172
:A
:1007-6883(2016)06-0049-07
责任编辑 朱本华 周春娟
2016-03-30
广东省自然科学基金项目(项目编号:S2011030005257).
谢罗瀚(1999-),男,湖南攸县人,汕头市金山中学在读学生.a:并列第一作者;*:通讯作者.
