聚乳酸-羟基乙酸聚合物载入羟基喜树碱载药纳米粒子的制备及表征
2016-02-10李瑞端张建军
李瑞端,张建军
1.吉林化工学院,吉林 吉林 132022;
2.北京化工大学,北京 100029
聚乳酸-羟基乙酸聚合物载入羟基喜树碱载药纳米粒子的制备及表征
李瑞端1,张建军2
1.吉林化工学院,吉林 吉林 132022;
2.北京化工大学,北京 100029
以抗癌药物羟基喜树碱作为模型药物,可降解材料聚乳酸-羟基乙酸(PLGA)为药物负载体,采用溶剂-抗溶剂沉淀法制备聚乳酸-羟基乙酸/羟基喜树碱的载药纳米微球,考察不同溶剂-反溶剂体系对载药包封效果的影响。结果表明,以丙酮-水为溶剂体系制备的载药微球性能较好,形貌外观呈圆球形,球表面圆润光滑,粒度均一,分散效果良好,平均粒径为160 nm,载药微球包封率随着载药量的增加而减小,实测载药量为7.83%的PLGA载药微球,其载药包封率为87.68%,在28 d后溶出累计量约50%,可见以聚乳酸-羟基乙酸为载体制备的羟基喜树碱剂型,缓释作用良好。
羟基喜树碱 聚乳酸-羟基乙酸 纳米粒子
羟基喜树碱(简称HCPT)具有广谱抗肿瘤疗效,对头颈部肿瘤、腹水型肝癌、胃癌及白血病等多种肿瘤具有治疗效果[1-5]。但由于HCPT本身是非水溶性药物,其在水中溶解度极低,且其自身的内酯环结构是pH值依赖性的,在生理pH值条件下,其内酯结构自动开环形成羧酸盐形式,该盐极其不稳定,见光易分解,分解会降低其疗效,还会增加不良反应[6,7]。目前临床使用的HCPT制剂多为HCPT羧酸盐形式,其结构开环后,其抗肿瘤活性降低90%,限制了其实际临床应用[8,9]。为了改善难溶药物的水溶性和抗肿瘤活性,许多研究将HCPT制备成不同缓释剂型,如脂质体、纳米微乳、纳米微球和纳米粒等[10,11]。其中,常用的是以二甲基亚砜作溶剂,用复乳法和溶剂蒸发法[12,13]制备HCPT缓释微球。而复乳法制备的缓释微球颗粒较大,溶剂蒸发法温度变化会影响溶解度的变化,因此这两种方法均不太适合聚合物载药粒子的制备。溶剂-反溶剂重结晶法制备微球,是将药物溶解在溶解度大的溶剂中,以难以溶解该药物的溶剂作反溶剂,将溶液与反溶剂迅速混合,迅速形成的浓度差使得药物颗粒瞬间析出,该方法工艺简单,且较好分离。目前,聚乳酸-羟基乙酸聚合物(PLGA)是制备缓释微球和组织工程的常用材料,已经通过美国食品和药物管理局(FDA)认证,可作为药用辅料收录入美国药典,PLGA本身生物相容性良好,并且可自然生物降解,最终产物为CO2和H2O,随代谢排出体外,对机体无毒无副作用[14,15]。因此,本工作选择具有良好生物相容性和可生物降解性的PLGA为HCPT载体,以溶剂-反溶剂重结晶法制备载药微球。
1 实验部分
1.1 纳米微球的制备
在室温(25 ℃)下,称量10 mg PLGA(数均分子量为50 000),乳酸与羟基乙醇酸(物质的量之比为75∶25)和一定量的HCPT溶于1 mL有机溶剂,有机溶剂分别是四氢呋喃(THF),丙酮,N,N-二甲基甲酰胺(DMF),二甲基亚砜(DMSO)和二氯甲烷,PLGA/HCPT溶液作为溶剂,溶有一定量泊洛沙姆的水溶液作为反溶剂,通过溶剂-抗溶剂沉淀法,制备PLGA/HCPT载药粒子,通过真空冷冻干燥PLGA/HCPT悬浮液收集纳米粒子。
1.2 表征与分析
1.2.1 扫描电镜分析
扫描电镜分析(SEM)在日本电子公司JSM670扫描电镜上进行,将合适浓度的分散液滴在载玻片上,用滤纸吸干多余溶剂,通过导电胶将玻璃片置于铜台上,自然晾干后,喷金,在扫描电镜上观察颗粒形貌和大小。
1.2.2 粒度分析
粒度分析(DLS)在英国Malvern公司ZetaSizer-3000HS型激光粒度电位仪上进行,选用氩离子激光源,定义散射角90°,测试温度25 ℃,分散剂选择水相。
1.2.3 载药微球包封率、载药量和溶出累计量的测定
采用紫外-可见分光光度计(UV)测定HCPT在检测波长265 nm处的吸光度,利用其标准曲线计算包封率、载药量及溶出累计量。
标准曲线:以乙醇为溶剂,HCPT溶液在浓度为0.03~25.00 μg/mL时,其吸光度(A)与浓度(C)呈现良好的线性关系,标准曲线为A= 0.066 58C-0.007 17。
载药量和包封率按以下公式计算:

式中:L为载药量;E为包封率;M0为载药微球质量;M1为微球中药物的质量;M2为投入总药物的质量。
溶出累计量的测定:以磷酸缓冲盐溶液(PBS)为缓冲液(pH值为7.4)作为体外溶出介质,以5 mg载HCPT/PLGA微球冻干样品,分散在2 mL PBS的透析袋中,放进恒温37 ℃,恒速搅拌的50 mL PBS中,按一定时间间隔取出一定量的PBS,紫外-可见分光光度计检测其在265 nm处的吸光度,用标准曲线换算药物释放量,同时要及时补充等温等量的新鲜介质。
2 结果与讨论
2.1 不同溶剂对颗粒和形貌的影响
溶剂-反溶剂重结晶法主要原理是以溶质在液相中饱和溶解度的变化作为传质推动力来促使溶质析出,分别以丙酮,THF,DMF,DMSO和二氯甲烷为溶剂,水为反溶剂,PLGA浓度为10 mg/mL,考察不同溶剂-反溶剂体系成球性的情况,结果表明,分别以DMF,DMSO和二氯甲烷做为溶剂制备纳米微粒时,成球性较差,都是成片、粘连的,以THF和丙酮作溶剂的体系制备出的HCPT/PLGA微粒综合效果好,其形貌如图1所示。由图可看出,丙酮和THF作溶剂制备的微球粒度较均一并且较小。综合考虑THF和丙酮作为溶剂对于颗粒的形貌和稳定性的影响,选择丙酮为溶剂,去离子水为反溶剂,制备PLGA纳米微球。
2.2 PLGA浓度对微球的影响
PLGA浓度对微球粒径和包封率起主要影响因素,考察PLGA浓度对微球粒径和形貌的影响,结果见图2。由图可知,随着PLGA浓度的增加微球粒径尺度明显增大,这主要是由于PLGA的浓度增大后,PLGA初乳的黏度也随之增加,在相同搅拌转速下乳液越黏稠越不易分散,因而形成微球的粒径尺度有所增大,但是相差不是很大。综合考虑,后续实验选择PLGA的浓度为10 mg/mL。

图1 不同溶剂-反溶剂体系制备的PLGA纳米颗粒SEM照片Fig.1 SEM images of PLGA nanoparticles by different solvent-anti-solvent systems a-THF; b-acetone

图2 不同浓度的PLGA颗粒的SEM照片Fig.2 SEM images of PLGA nanoparticles at different concentrations
2.3 HCPT/PLGA载药微球的形貌分析
采用溶剂-反溶剂法制备的负载HCPT的PLGA微球,冷冻干燥后为微黄色絮状粉末,图3a和b分别为SEM和DLS的测试结果。由图可知,微球呈圆球形,外表面光滑,分散性良好,平均粒径大小为160 nm。
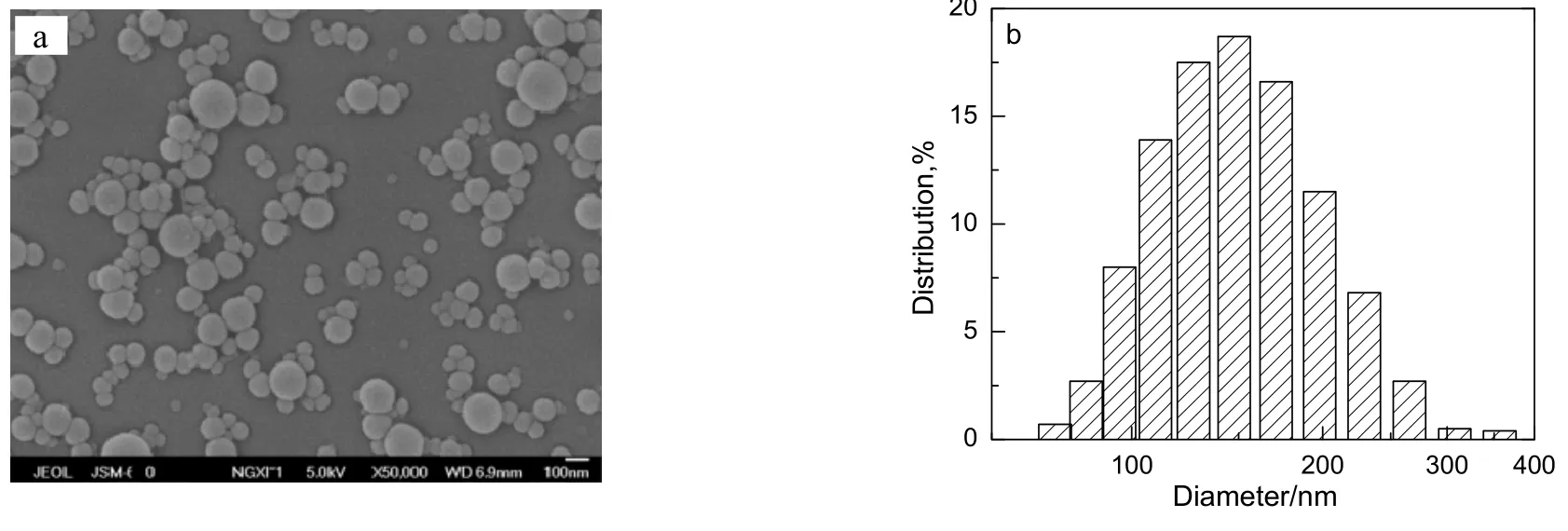
图3 HCPT/PLGA纳米颗粒的扫描电镜照片和粒度分布Fig.3 SEM image and DLS distribution graph of HCPT/PLGA nanoparticles
2.4 载药量对HCPT/PLGA载药粒子包封率的影响
分别考察不同的理论载药量(质量分数分别为4.76%,9.09%,16.67%和23.08%)对实际包封效果的影响,对应的包封率分别为99.36%,87.68%,78.82%和65.54%,即随着载药量的增加,HCPT/PLGA载药粒子的包封率减小。综合考虑载药量和包封率的关系,选择理论载药量9.09%较合适,经测量其实际载药量为7.83%。
2.5 体外溶出实验
负载药物的HCPT/PLGA粒子体外释放累计溶出量测定结果见图4。由图可知,前5 d的溶出速率较快,有突释现象,之后溶出速率逐渐放缓,至28 d累计溶出量约为50%。这是由于在溶出实验的初期,载药纳米粒子表面吸附的药物以及包载不牢的药物分子快速释放,导致溶出初期药物释放较快。据前期研究[15]可知,由纳米化HCPT粒子和原料药HCPT的体外溶出曲线可以看出,纳米化HCPT溶出速率远大于未纳米化原料药的溶出速率,纳米化HCPT在30 min的溶出累计量已近于100%,而原料药HCPT在30 min的溶出量仅为11.6%。因此说明本实验制备的载药微球具有一定的缓释作用。
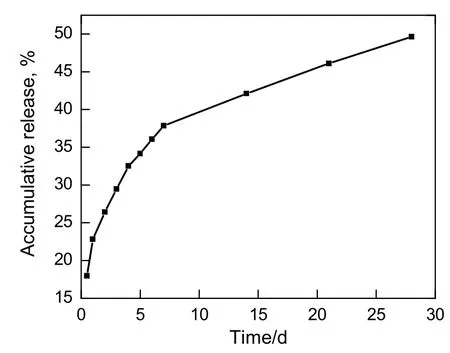
图4 溶出曲线Fig.4 Release graph
3 结 论
聚乳酸-羟基乙酸浓度为10 mg/mL,采用溶剂-抗溶剂技术制备聚乳酸-羟基乙酸包载羟基喜树碱载药微球,其表面光滑,粒度均一,HCPT/PLGA粒子包封率随着载药量的增加而减小,其在28 d溶出累计量约50%,具有一定的缓释作用。
[1] Guo S, Zheng J, Dong J, et al. Iron/dextran sulfate multilayered microcapsules for controlled release of 10-hydroxycamptothecin[J]. Int J Biol Macromol, 2011, 49(3): 409-415.
[2] Lee Y, Cui F D, Cun D M, et al. Preparation, characterization and biodistribution of the lactone form of 10-hydroxycamptothecin (HCPT)-loaded bovine serum albumin (BSA) nanoparticles[J]. International Journal of Pharmaceutics, 2007, 340(3): 163-172.
[3] Markman M. Topotecan as second-line therapy for ovarian cancer: dosage versus toxicity[J]. Oncologist, 2005, 10(9): 695-697.
[4] Pu X H, Sun J, Wang Y, et al. Development of a chemically stable 10-hydroxycamptothecin nanosuspension[J]. International Journal of Pharmaceutics, 2009, 379(1), 167-173.
[5] 龚明涛, 张钧寿, 戴晓鸣. 羟基喜树碱纳米乳在大鼠体内的药代动力学研究[J]. 中国药科大学学报, 2004, 35(4): 324-327. Gong Mingtao, Zhang Junsho, Dai Xiaoming. Pharmacokinetics of hydroxycamptothecin microemulsions in rats[J]. Journal of China Pharmaceutical University, 2004, 35(4): 324-327.
[6] Hong M H, Zhu S J, Jiang Y Y, et al. Efficient tumor targeting of hydroxycamptothecin loaded PEGylated niosomes modified with transferring[J]. Journal of Controlled Release, 2009, 133(2): 96-102.
[7] 董 隽, 郭建新, 平其能. 羟基喜树碱脂肪乳的制备及其在人血浆中稳定性考察[J]. 中国新药杂志, 2005, 14(6): 720-723. Dong Jun, Guo Jianxin, Ping Qineng. Preparation and stability of hydroxycamptothecin lipid emulsion[J]. Chinese Journal of New Drugs, 2005, 14(6): 720-723.
[8] Wani M C, Ronman P E, Lindley J T, et al. Plant antitumor agents 18: synthesis and biological activity of camptothecin analogues[J].Journal of Medicinal Chemistry, 1980, 23: 554-560.
[9] Zhang L Y, Yang M, Wang Q, et al. 10-hydroxycamptothecin loaded nanoparticles: preparation and antitumor activity in mice[J]. J Control Rel, 2007, 119: 153-162.
[10] 黄 毅, 刘松青, 林 彩, 等. 羟基喜树碱自制脂质体注射液与市售注射液家兔体内药代动力学行为的比较[J]. 第三军医大学学报, 2004, 26(6): 517-519. Huang Yi, Liu Songqing, Lin Cai, et al. Comparison of the pharmacokinetic characteristics of hydroxycamptothecin liposomes injection with market hydroxycamptothecin injection in rabbits after intravenous administration[J]. Journal of Third Military Medical University, 2004, 26(6): 517-519.
[11] 陆 彬. 纳米粒给药系统[J]. 中国药师, 2003, 6(7): 399-401. Lu B. Nanoparticles drug delivery system[J]. China Pharmacist, 2003, 6(7): 399-401.
[12] Shenderova A, Burke T G, Schwendeman S P. Stabilization of 10-hydroxycamptothecin in poly(lactide-co-glycolide) microsphere delivery vehicles[J]. Pharm Res, 1997, 14: 1406-1414.
[13] Shenderova A, Burke T G, Schwendeman S P. The acidic microclimate in poly(lactide-co-glycolide) microspheres stabilizes camptothecins[J]. Pharm Res, 1999, 16: 241-248.
[14] Toti U S, Guru B R, Hali M, et al. Targeted delivery of antibiotics to intracellular chlamydial infections using PLGA nanoparticles[J]. Biomaterials, 2011, 32(27): 6606-6613.
[15] 李瑞端, 张建军, 陈建峰, 等. 10-羟基喜树碱纳米微球的制备及表征[J]. 北京化工大学学报(自然科学版), 2014, 5: 83-88. Li Ruiduan, Zhang Jianjun, Chen Jianfeng, et al. Preparation and characterization of 10-hydroxycamptothecin nanoparticles[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2014, 5: 83-88.
Preparation and Characterization of Poly(lactic-co-glycolic acid) Nanoparticles Containing Hydroxycamptothecin
Li Ruiduan1, Zhang Jianjun2
1. Jilin Institute of Chemical Technology, Jilin 132022, China; 2. Beijing University of Chemical Technology, Beijing 100029, China
The poly(lactic-co-glycolic acid) (PLGA) nano-microspheres containing hydroxycamptothecin (HCPT) was prepared using solvent and anti-solvent precipitation method with HCPT as the model drug, degradable PLGA as the carrier. The effects of different solvents and anti-solvents system on the drug loading capacity and entrapment efficiency were investigated. The results showed that the microspheres prepared with acetone-water as solvent system had better performance, spherical appearance, round and smooth surface, uniform particle size (the average particle size of 160 nm) and good dispersion. The entrapment efficiency of drug-loaded microspheres decreased with the increase of drug loading. It was found that the entrapment efficiency was 87.68% in the HCPT/PLGA microspheres when drug loading was 7.83%. The cumulative release amount was 50% after 28 days. This HCPT/PLGA drug delivery system clearly demonstrated its good sustained-release effect.
hydroxycamptothecin; poly(lactic-co-glycolic acid); nanoparticle
R917
:A
1001—7631 ( 2016 ) 06—0542—05
2016-10-31;
:2016-12-09。
李瑞端(1983—),女,博士;张建军(1980—),男,副教授,通讯联系人。E-mail: zhangjj@mail.buct.edu.cn。
吉林省教育厅项目(2013324);吉林市科技局青年基金项目(20156421)。
