参藻混养生态系统中孔石莼、蛋白核小球藻与刺参的相互作用研究
2016-02-10李朝政
李朝政,赵 文,刘 钢,王 珊
(大连海洋大学水产与生命学院,辽宁省水生生物学重点实验室,辽宁大连116023)
参藻混养生态系统中孔石莼、蛋白核小球藻与刺参的相互作用研究
李朝政,赵 文,刘 钢,王 珊
(大连海洋大学水产与生命学院,辽宁省水生生物学重点实验室,辽宁大连116023)
为了探讨参藻混养生态系统中孔石莼Ulva pertusar、蛋白核小球藻Chlorella pyrenoidosa与刺参Apostichopus japonicus的相互作用,采用实验生态学方法进行了106、105cells/mL两种浓度的蛋白核小球藻与孔石莼及刺参不换水混养的生态效应研究。结果表明:孔石莼和小球藻能有效地吸收养殖水体中的氮磷;106cells/mL浓度的小球藻在与孔石莼、刺参混养时对孔石莼有明显的抑制作用,而105cells/mL浓度的小球藻对孔石莼有一定的抑制作用。研究表明,小球藻浓度为105cells/mL的混养组在水质、刺参生长方面与孔石莼混养组相近,且能较好地抑制孔石莼过快生长。
孔石莼;蛋白核小球藻;刺参;混养;水质;生态效应
近年来,中国水产养殖业发展迅速,但养殖系统中养殖动物的粪便和残饵等已成为养殖水域的重要污染源[1-2],水产健康养殖场建设势在必行。孔石莼是一种常见的大型海藻,已有学者对孔石莼与鱼、虾混养及净化水质等方面进行了研究,结果表明,其光合作用能有效吸收水体中的氮磷,对养殖废水有良好的修复效果[3-8]。
有关孔石莼克制其他大型海藻及赤潮微藻的研究也很多,其克生作用可以有效抑制刺参养殖水体中有害的大型水藻(如刚毛藻等)[9-12]。然而,在富营养水体和高温环境下,孔石莼容易迅速繁殖,其光合作用会使大片藻体上浮,覆盖水体表面,导致水体缺氧,且自身的腐烂会分解释放有害气体,导致水质变差。在参藻混养模式中发现,蛋白核小球藻对孔石莼有抑制作用,所以如何利用小球藻抑制孔石莼过快生长,对减少刺参生产中孔石莼的负效应具有重要意义。
本研究中,选择孔石莼和蛋白核小球藻与刺参混养,探讨小球藻对孔石莼生长的抑制作用,以便在养殖生产过程中知晓何种浓度条件下小球藻能有效抑制孔石莼,防止孔石莼迅速繁殖为害,扩大孔石莼对刺参养殖的正效应。
1 材料与方法
1.1 材料
孔石莼Ulva pertusar采自大连市庄河海域,将其运回实验室后,用海水洗净,选取大小相对均一的藻体,在室温、光照强度为2000~3000 lx条件下培养一周。
蛋白核小球藻Chlorella pyrenoidosa由大连海洋大学辽宁省水生生物学重点实验室提供,小球藻处于指数生长期。
刺参Apostichopus japonicus购自大连金砣水产食品有限公司,在塑质水槽(200 cm×50 cm×80 cm)中饥饿暂养一周,选取体质量大小相对均一的幼参进行试验,幼参体质量为(5.0±0.6)g。试验用塑质水槽在使用前经0.1%高锰酸钾浸泡24 h后反复冲刷干净待用。
试验用海水取自大连市黑石礁近岸海域,经孔径为37.5μm的筛绢网过滤、沉淀后待用。
1.2 方法
1.2.1 试验设计 试验设高浓度小球藻试验组(A)、低浓度小球藻试验组(B)、孔石莼对照组(C)、小球藻对照组(D)、海水空白对照组(E)共5组,A、B、C 3组分别接种孔石莼60 g(藻体浓度为3 g/L),A组接种106cells/mL小球藻,B、D两组接种105cells/mL小球藻,E组不接种小球藻及孔石莼,每组设3个重复,每个重复组放入10头预培养的刺参进行混养,每3 d采集1次样品并进行测定。试验期间,培养温度为(23±1)℃,盐度为(30±1),试验过程中用恒温加热棒控温,全程用气泵进行充氧,采用光照强度为2000~3000 lx的白炽灯作为光源,光暗比为12 h∶12 h。每48 h投入经烘干处理的海参饵料,投入量为海参体质量的1%。每24 h对塑质水槽进行吸底,吸出废液经筛绢网过滤,用5 L锥形瓶收集,并于吸底后倒回至养殖箱中。
1.2.2 指标的测定与计算 每3 d测定1次水质。用次溴酸盐氧化法测定氨氮含量,用钼-锑-抗法测定活性磷含量,用锌-镉还原法测定硝酸氮含量,用萘乙二胺分光光度法测定亚硝酸氮含量[13-14]。每3 d从每组取1 mL水样,用Lugol碘液固定,以血球计数板在显微镜下计算蛋白核小球藻数量变化。每12 d用天平称量1次孔石莼和刺参体质量。根据下式计算饵料系数:
饵料系数=饵料消耗量/增重量×100%。
1.3 数据处理
应用SPSS 19.0软件进行单因素方差分析(ANOVA),用Duncan法进行多重比较。试验数据均用平均值±标准误表示。
2 结果与分析
2.1 参藻混养系统中营养盐含量及其动态
从表1可见:高浓度小球藻组和海水对照组营养盐平均浓度均较高,其余3组均较低;高浓度小球藻组、海水对照组氨氮浓度高于渔业水质标准(0.2 mg/L),小球藻对照组氨氮浓度稍高于标准,孔石莼对照组及低浓度小球藻组氨氮浓度均低于标准,且各浓度组氨氮浓度均显著低于海水对照组(P<0.05);各组硝酸氮浓度均低于海水对照组,仅低浓度小球藻组和孔石莼对照组硝酸氮浓度显著低于高浓度小球藻组及海水对照组(P<0.05);各组亚硝酸氮浓度均低于海水对照组,仅孔石莼对照组亚硝酸氮浓度显著低于海水对照组(P<0.05);各组活性磷浓度均低于海水对照组,且低浓度小球藻组、孔石莼对照组、小球藻对照组活性磷浓度显著低于海水对照组(P<0.05)。
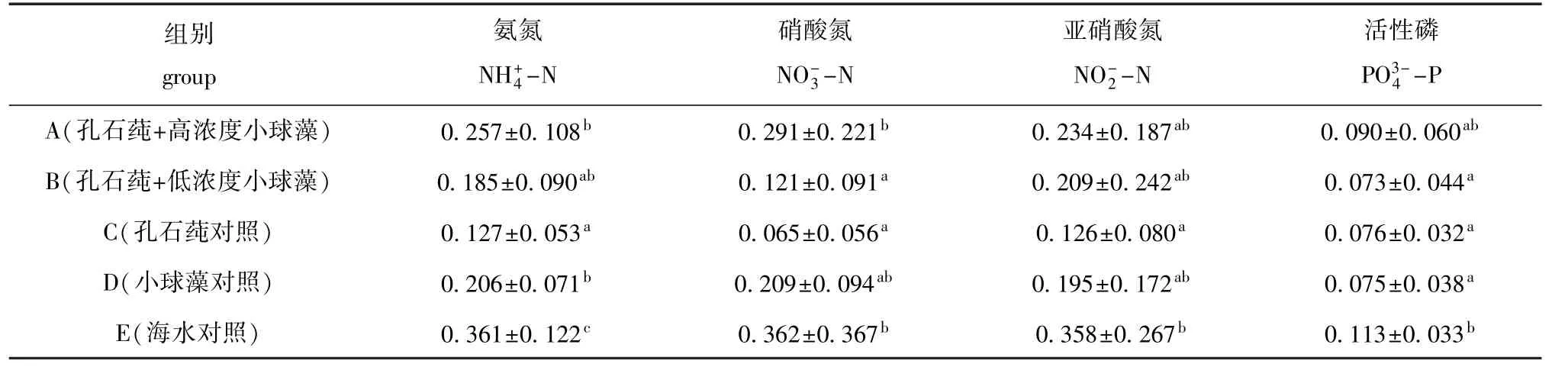
表1 参藻混养生态系统营养盐的平均浓度Tab.1 M ean concentrations of nutrients in polyculture of sea cucumber w ith alga mg/L
从图1可见:海水对照组氨氮浓度一直呈上升趋势;高浓度小球藻组氨氮浓度试验初期先降低,于第3天后一直上升;小球藻对照组氨氮浓度试验初期保持稳定,于第15天降低后又转为上升;低浓度小球藻组和孔石莼对照组氨氮浓度先降低后保持平稳,继而于第15天二次降低后又转为上升;各组氨氮浓度均在最后阶段有下降趋势,最高值均出现在第33天。
试验过程中,海水对照组硝酸氮浓度先保持平稳,第30天后迅速上升;其余4组先保持平稳,经小幅上升后回落,继而平稳上升,各组硝酸氮浓度最高值均出现在第36天。
试验过程中,海水对照组亚硝酸氮浓度先保持平稳,第30天后也迅速上升,其余4组亚硝酸浓度均先下降后保持平稳;高浓度小球藻组于第15天小幅上升后保持平稳,于第27天后迅速上升;低浓度小球藻组及小球藻对照组于第21天开始迅速上升;孔石莼对照组亚硝酸浓度则于试验第30天开始迅速上升;各组亚硝酸氮浓度最高值均出现在第36天。
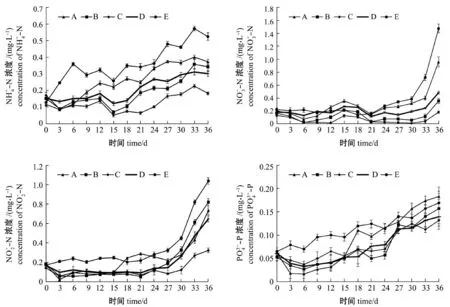
图1 试验期间参藻混养生态系统营养盐含量的变化Fig.1 Dynam ics of nutrients in polyculture of sea cucumber w ith alga during the experiments
试验过程中,海水对照组活性磷浓度总体呈上升趋势,其余4组活性磷浓度均先下降后呈上升趋势;各组活性磷浓度最高值均出现在第36天。
2.2 孔石莼生长情况
从表2可见:试验期间,试验组和对照组中孔石莼均为负生长;12、24、36 d时,孔石莼质量随混养模式中小球藻浓度的降低而显著升高(P< 0.05),高浓度小球藻组孔石莼质量均显著低于低浓度小球藻组(P<0.05),而两种小球藻浓度组孔石莼质量均显著低于对照组(P<0.05);试验结束时,高浓度、低浓度小球藻组孔石莼质量较初始时分别减少76.13%和50.92%,均高于对照组(16.28%),说明蛋白核小球藻浓度对孔石莼质量有显著影响。表2 参藻混养生态系统中孔石莼的生长Tab.2 Grow th of sea lettuceUlva pertusarin polyculture of sea cucumber w ith alga

表2 参藻混养生态系统中孔石莼的生长Tab.2 Grow th of sea lettuceUlva pertusarin polyculture of sea cucumber w ith alga
2.3 小球藻生长情况
试验过程中蛋白核小球藻密度的变动如图2所示。从图2可见:试验组和对照组小球藻密度在前6天均有上升,低浓度小球藻组和小球藻对照组此后一直保持平稳,有缓慢下降趋势;而高浓度小球藻组小球藻密度于第6天后迅速下降,至第15天后保持平稳态势,于第27天再次有明显下降。
2.4 刺参生长情况
试验过程中刺参生长情况如表3所示。从表3可见:在试验第12天时,除海水对照组外,其余各组增重率均达到1.5%以上,其中仅高浓度小球藻组刺参增重率显著高于海水对照组(P<0.05);试验进行至第24天时,除海水对照组外,其余各组刺参增重率均已达2.4%以上,其中小球藻对照组与孔石莼对照组增重率均显著高于海水对照组(P<0.05);到第36天试验结束时,除海水对照组外,其余各组刺参增重率均已高于2.5%,且孔石莼对照组和小球藻对照组已达3.5%左右,其中低浓度小球藻试验组、小球藻对照组和孔石莼对照组增重率均显著高于海水对照组(P<0.05)。

图2 试验生态系统中蛋白核小球藻密度的变化Fig.2 Dynam ics of green algaChlorella pyrenoidosadensity in the experimental ecosystem
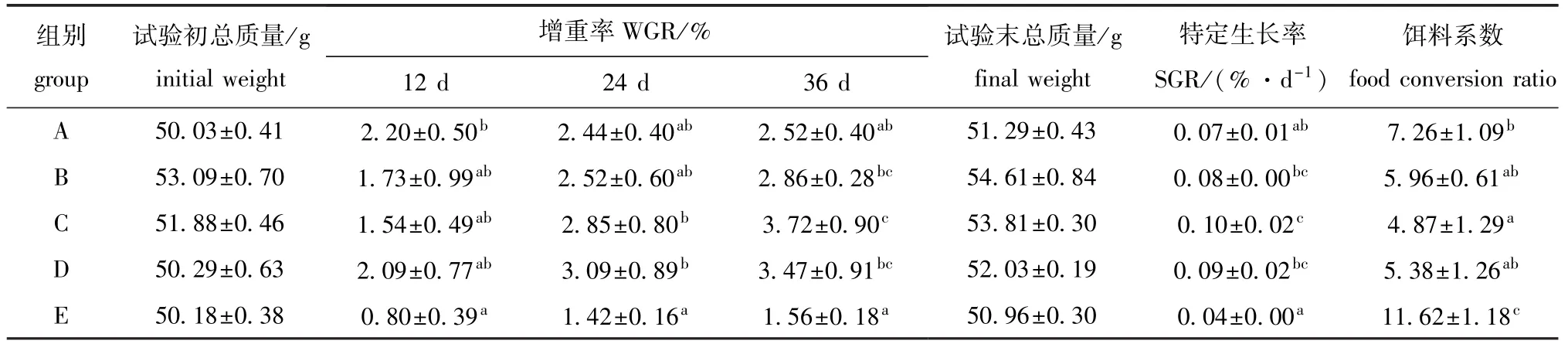
表3 参藻混养生态系统中刺参的生长Tab.3 Grow th of sea cucumberApostichopus japonicusin the polyculture of sea cucumber w ith the alga
从表3还可见:孔石莼对照组的特定生长率最大(0.10%/d),小球藻次之(0.09%/d),而海水对照组最低(0.04%/d),其余两组均在0.07 %/d以上,且低浓度小球藻组、孔石莼对照组、小球藻对照组特定生长率均显著高于高浓度小球藻组和海水对照组(P<0.05);除海水对照组外,其余各组饵料系数均在10以下,其中海水对照组显著高于其余各组(P<0.05),高浓度小球藻试验组显著高于孔石莼对照组(P<0.05)。
3 讨论
3.1 小球藻对孔石莼生长的影响
研究表明,孔石莼对氨氮有较强的吸收作用[15-18],而小球藻不能直接吸收氨氮[19-20]。本试验中,小球藻试验组氨氮浓度高于孔石莼对照组,所以小球藻对孔石莼的生长和生理状态有明显的影响。而高浓度小球藻组氨氮开始升高的时间早于低浓度小球藻组,且氨氮浓度也高于低浓度小球藻组,说明小球藻浓度为106cells/mL时对孔石莼的生长抑制作用比浓度为105cells/mL时强。
孔石莼和小球藻对硝酸氮均有一定的吸收作用[15-20]。若小球藻对孔石莼不产生抑制作用,则小球藻试验组硝酸氮浓度应较孔石莼对照组低,且高浓度小球藻组应低于低浓度小球藻组,从图2、表1可知,小球藻试验组硝酸氮浓度较孔石莼对照组高,所以小球藻对孔石莼的生长和生理状态有一定影响,且高浓度小球藻组硝酸氮浓度高于低浓度小球藻组,说明高浓度小球藻抑制作用更明显,同时说明孔石莼吸收硝酸氮作用要强于小球藻。这也表明,小球藻浓度为105cells/mL时对孔石莼的抑制作用不如浓度为106cells/mL时强。
本试验中,高浓度小球藻组孔石莼质量减少了76.13%,而低浓度小球藻组孔石莼质量也减少了50.92%,且3组孔石莼质量差异显著,说明小球藻对孔石莼生长有明显抑制作用,且小球藻浓度越高越明显。
由此可见,小球藻可以抑制孔石莼的生长并可影响其生理状态,而且高浓度小球藻抑制作用比较明显,这可能是因为较高浓度的微藻克藻效应比较强,且较高的小球藻浓度使水颜色改变,对主要在塑质水槽底部生长的孔石莼形成一定遮光效应,影响了孔石莼对光的吸收及其光合作用,从而影响其生长。试验过程中还发现,分解后的孔石莼会被刺参摄食一部分,因此,可以利用这一现象在刺参养殖生产中对孔石莼的生物学进行调控。
3.2 孔石莼对小球藻生长的影响
本试验中,高浓度小球藻试验组小球藻的密度于第6天后有明显下降,说明受到了孔石莼的抑制作用,而低浓度小球藻试验组和对照组小球藻密度目相对较平稳,说明小球藻浓度为105cells/mL时抵抗孔石莼抑制作用的能力强于小球藻浓度为106cells/mL时。
本试验中,孔石莼和小球藻对活性磷均有一定的吸收作用[15-20],小球藻试验组活性磷浓度在第15天前均低于孔石莼对照组,说明105cells/mL小球藻浓度组对磷的吸收能力强于孔石莼组,这可能是因为大型海藻对活性磷的吸收是主动吸收[21]。也有研究表明,孔石莼对磷酸盐的吸收在高氮环境(5mmol/L)下会受到抑制[22]。但高浓度小球藻试验组活性磷浓度在第15天之后迅速升高,说明此时小球藻的数量增长已经受到了孔石莼的抑制作用。
3.3 孔石莼对刺参生长的影响
在本试验的参藻混养生态系统中,孔石莼吸收水中多余氮磷,能为刺参生长提供较好的水质环境,同时能使刺参在适宜的避光条件下吸附,为刺参提供很好的栖息环境,而孔石莼分解后也可作为生长饲料供刺参舔舐。小球藻试验组由于孔石莼受抑制,且小球藻净水作用有限,导致刺参生长的水质环境略差于孔石莼组,生长变缓。
3.4 小球藻、孔石莼与海参混养模式评价
在参藻混养生态系统中,孔石莼能为刺参提供附着基,在光照充足时其自身光合作用会产生大量气体,使大型藻体上浮,能起到一定的遮光作用,为刺参提供良好的栖息环境,且能净化水质,吸收多余氮磷,促进自身生长。当孔石莼在较高温度下生长过快时,加入小球藻能抑制其过快生长,使孔石莼分解沉入池底,作为天然饵料被刺参舔舐,且小球藻自身也有一定的净水作用。本试验结果表明,小球藻试验组刺参初期(12 d)增长较快(增重率>1.7%),而孔石莼对照组刺参增长也较快(1.5%),均比海水对照组(0.8%)要快一倍左右,说明小球藻、孔石莼与刺参混养对刺参生长均有一定促进作用。在试验中期(24 d),小球藻试验组刺参的增长速度减慢,同时,低浓度小球藻试验组和小球藻对照组刺参增重率下降且相近,孔石莼对照组刺参增重率仍较大,说明孔石莼对小球藻的生长有影响,而对刺参生长影响有限。其中,高浓度小球藻试验组的刺参增重率仅提高0.2%,而此时孔石莼已大量裂解,说明孔石莼裂解后对刺参生长有影响,而此影响很可能是由于孔石莼裂解后将之前吸收的氮磷释放回养殖水体,导致水质变差,从而影响到刺参生长。试验结束时,孔石莼对照组刺参增重率显著高于其他组,除高浓度小球藻试验组外,小球藻组刺参增重率显著高于海水对照组,说明孔石莼、小球藻对刺参生长有显著促进作用。结合饵料系数可以发现,在小球藻浓度为105cells/mL的条件下,可以有效控制孔石莼增长,且对刺参有促进作用,而且能较好地节省养殖成本。而高浓度小球藻混养组虽然能较好地抑制孔石莼生长,但后期由于缺少孔石莼的净水作用导致水体水质变差,刺参生长受到了抑制。所以养殖生产中需注意孔石莼裂解后的水质变化,应保持一定的换水量,以防水体中氮磷突然升高影响刺参的生长发育。
研究表明,在以刺参为主养对象的养殖模式中,混养对象间及投入物(如微生态制剂)和生态育苗设施等均会对养殖系统有影响[23-25]。本研究中仅研究了混养对象之间的影响,至于参藻混养系统投入物及设施的影响尚需进一步研究。
[1]贾晓平,蔡文贵,林钦.我国沿海水域的主要污染问题及其对海水增养殖的影响[J].中国水产科学,1997,4(4):78-82.
[2]王曙光.加强海洋资源环境管理,促进海洋经济可持续发展[M].北京:海洋出版社,2001:30-33.
[3]Schuenhoff A,Shpigel M,Lupatsch I,et al.A semi-recirculating, integrated system for the culture of fish and seaweed[J].Aquaculture,2003,221(1-4):167-181.
[4]Msuya F E,Neori A.Ulva reticulataandGracilaria crassa:macroalgae that can biofilter effluent from tidal fishponds in Tanzania [J].Western Indian Ocean Journal of Marine Science,2002,1 (2):117-126.
[5]王吉桥,靳翠丽,张欣,等.不同密度的石莼与中国对虾的混养实验[J].水产学报,2001,25(1):32-37.
[6]Ryther JH,Goldman JC,Gifford C E,etal.Physicalmodels of integrated waste recycling-marine polyculture systems[J].Aquaculture,1975,5(2):163-177.
[7]Bodvin T,Indergaard M,Norgaard E,et al.Clean technology in aquaculture-a production without waste products?[J].Hydrobiologia,1996,326-327(1):83-86.
[8]江志兵,曾江宁,陈全震,等.大型海藻对富营养化海水养殖区的生物修复[J].海洋开发与管理,2006,23(4):57-63.
[9]田志佳.大型海藻化感物质对短裸甲藻的抑制作用[D].青岛:中国海洋大学,2009.
[10]南春容,董双林.大型海藻与海洋微藻间竞争研究进展[J].海洋科学,2004,28(11):64-66.
[11]蔡恒江,唐学玺.孔石莼和赤潮异弯藻相互作用的初步研究[J].大连海洋大学学报,2012,27(3):255-259.
[12]蔡恒江,李博,孙禾琳.孔石莼克生作用对赤潮异弯藻生长和抗氧化系统活性的影响[J].海洋环境科学,2010,29(6): 859-862.
[13]中华人民共和国国家质量监督检验检疫总局.GB 17378-2007海洋监测规范[S].北京:中国标准出版社,2007.
[14]雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004: 116-128.
[15]王翔宇,詹冬梅,李美真,等.大型海藻吸收氮磷营养盐能力的初步研究[J].渔业科学进展,2011,32(4):67-71.
[16]李秀辰,张国琛,崔引安,等.孔石莼对养鲍污水的静态净化研究[J].农业工程学报,1998,14(1):173-176.
[17]孙琼花,闫慧,沈淑芬,等.孔石莼对养虾废水营养盐吸收的研究[J].福建师范大学学报:自然科学版,2013,29(4):109-113.
[18]孙琼花.大型海藻对养殖废水营养盐吸收及海区的生物修复[D].福州:福建师范大学,2013.
[19]胡开辉,朱行,汪世华,等.小球藻对水体氮磷的去除效率[J].福建农林大学学报:自然科学版,2006,35(6):648-651.
[20]马彩虹,麻晓霞,马玉龙,等.不同氮磷浓度对小球藻生长性能的影响[J].安徽农业科学,2012,40(22):11367-11369.
[21]Lundberg P,Weich R G,Jensen P,et al.Phosphorus-31 and nitrogen-14 NMR studies of the uptake of phosphorus and nitrogen compounds in the marine macroalgaeUlva lactuca[J].Plant Physiology,1989,89(4):1380-1387.
[22]Brinkhuis B H,Li Renzhi,Wu Chaoyuan,et al.Nitrite uptake transients and consequences forin vivoalgal nitrate reductase assays[J].Journal of Phycology,1989,25(3):539-545.
[23]刘铁钢,赵文,刘钢,等.5种微生态制剂对刺参幼参的生态安全性[J].大连海洋大学学报,2012,27(2):129-136.
[24]窦妍,丁君,曲凌云,等.秋、冬季刺参养殖池塘菌群的多样性分析[J].大连海洋大学学报,2015,30(2):143-148.
[25]谢玺,赵文.刺参养殖池塘围隔环境特征及生态育苗的初步研究[J].大连海洋大学学报,2013,28(6):589-596.
Interaction among sea lettuceUlva pertusar,gree algaChlorella pyrenoidosaand sea cucumberApostichopus japonicusin a polyculture ecosystem
LIChao-zheng,ZHAOWen,LIU Gang,WANG Shan
(Key Laboratory of Hydrobiology in Liaoning Province,College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China)
The ecological effectswere studied in a 200 cm×50 cm×80 cm polyculture tank of sea cucumberApostichopus japonicuswith sea lettuceUlva pertusarand green algaChlorella pyrenoidosaat two concentrations of 106cells/mL and 105cells/mL withoutwater exchanging in order to evaluate the interaction among sea lettuce,green alga and sea cucumber in the polyculture ecosystem.The results showed that the sea lettuce,and green alga effectively absorbed nitrogen and phosphorus in water for aquaculture.The green alga had significant inhibition of sea lettuce at alga concentration of106cells/mL and to some extent inhibition of sea lettuce at alga concentration of105cells/mL,atwhich water quality and growth of sea cucumber nearly were the same with those in the polyculture of sea cucumber with sea lettuce,especially restraining the growth of sea lettuce.
Ulva pertusar;Chlorella pyrenoidosa;Apostichopus japonicus;polyculture;water quality;ecological effect
S968.9
A
10.16535/j.cnki.dlhyxb.2016.06.010
2095-1388(2016)06-0640-06
2016-03-02
国家海洋公益项目(201305005)
李朝政(1990—),男,硕士研究生。E-mail:919098138@qq.com
赵文(1963—),男,教授,博士生导师。E-mail:zhaowen@dlou.edu.cn
