海黍子有性生殖相关形态建成因子分析
2016-02-10吴海一王翔宇辛美丽刘梦侠
刘 玮,吴海一,王翔宇,辛美丽,刘梦侠
(1.山东省海洋生物研究院,山东青岛266104;2.青岛市大型海藻工程技术研究中心,山东青岛266104)
海黍子有性生殖相关形态建成因子分析
刘 玮1、2,吴海一1、2,王翔宇1、2,辛美丽1、2,刘梦侠1
(1.山东省海洋生物研究院,山东青岛266104;2.青岛市大型海藻工程技术研究中心,山东青岛266104)
为了评估海黍子Sargassum muticum有性繁殖生殖力情况,利用统计学方法对海黍子有性生殖相关的形态建成因子进行了初步研究,通过分析藻体长度与侧枝数、侧枝长度与生殖托数、生殖托长度与生殖托挂卵数之间的数量相关性,利用回归方程估算了海黍子的个体生殖力。结果表明:海黍子成熟藻体平均长度为(164.5±59.9)cm,侧枝平均长度为(10.4±5.3)cm,生殖托平均长度为(9.3±1.5)mm,单个生殖托平均挂卵数量为(378±121)粒,各因子间存在线性正相关性(P<0.05)。研究表明,单株海黍子成熟藻体能够产生(21~400)万粒受精卵,可基本满足1 m2的采苗生产需要。
海黍子;生殖力;形态建成因子;有性繁殖
海黍子Sargassum muticum隶属于褐藻纲、墨角藻目、马尾藻科,为中国黄渤海沿岸常见马尾藻科海藻种类。马尾藻科海藻具有重要的经济价值,不仅可作为海珍品的养殖饲料[1],而且还可作为医药、化工行业的原料[2-3]。此外,海黍子还具有重要的生态价值,其常在近海岩礁区聚集生长形成海藻床,而海藻床可为无脊椎动物提供栖息、觅食和繁殖场所[4],是近海生态系统的重要组成部分。
近年来,海黍子自然资源被过度攫取[5],海黍子野生群体数量明显下降,因此,对海黍子种群资源的保护工作亟待开展。海黍子苗种人工繁育是保护和恢复海黍子种群的重要手段。相对于海带人工繁育技术,海黍子苗种繁育技术目前尚处于初步研究阶段[6],海黍子有性繁殖相关文献资料较少[5,7-8],一定程度上制约了海黍子人工苗种繁育技术的发展。研究海黍子群体有性繁殖能力,尤其是研究群体中个体的生殖力,对海黍子群体资源保护及优化幼苗人工繁育技术具有重要的理论意义和实践价值。
本研究中,以海黍子有性繁殖相关的形态因子为研究对象,分析了各因子间的相关性,并进一步评估了该海黍子群体的个体生殖力,以期揭示生殖力与藻体大小的相关性,旨在为海黍子资源保护及人工繁育提供数据支持和参考。
1 材料与方法
1.1 材料
试验用海黍子为2014年5月采集于山东青岛(N 36°3′,E 120°19′)潮下带的野生海黍子群体,采集数量150份,采集时选取生殖托明显的藻体。
1.2 方法
1.2.1 苗种的采集与培育 藻体采集后用保温箱(4℃)转运至山东俚岛(N 37°12′,E 120°19′)进行人工夹苗,用直径为0.8 cm的尼龙绳将3~5株藻体夹为一簇,每簇间距10 cm。海黍子夹苗后用苗绳平挂于海上养殖筏架区进行海上暂养,每2~3天检查藻体成熟情况。当藻体生殖枝上明显有卵挂托时即被视为成熟藻体(图1、图2),用保温箱将成熟藻体带回实验室进行测量统计。
1.2.2 藻体形态建成因子测量统计 本试验中测量的形态因子主要包括藻体长度、侧枝数量、侧枝长度、生殖托数量、生殖托长度和生殖托挂卵数量等6个因子。测量时随机选取100株成熟藻体,用于测量藻体长度及侧枝数量。其中以海黍子主枝长度记为该株海藻的藻体长度,主枝上的侧枝数记为该株海藻的侧枝数量。从测量的100株海藻的主枝中各随机选取1条侧枝用于测量藻体侧枝长度及生殖托数量;再从测量的100株海藻的侧枝上随机选取50个生殖托用于测量生殖托长度及生殖托挂卵数量,测定生殖托挂卵数时,需预先用洁净的手术刀小心刮下生殖托上的卵,置于盛有10mL过滤海水的培养皿中,在体式显微镜(江南SE2200)下计数。

注:A为海黍子筏架区暂养;B为成熟的海黍子藻体Note:A,Sargassum muticumtemporarily cultured in the raft cultivation area;B,mature thalli of sea weedSargassum muticum图1 海黍子海上暂养情况Fig.1 Temporary cultivation of sea weedSargassum muticumon the sea

注:A为海黍子整株藻体;B为海黍子侧枝;C为附着在生殖托表面的卵Note:A,the entire thallus of sea weedSargassum muticum;B, the lateral branch of seaweedSargassum muticum;C,eggsattached on the surface of the receptacle图2 海黍子藻体Fig.2 The thalliof sea weedSargassum muticum
1.3 数据处理
数据分析采用SPSS 22.0软件完成。试验数据均以平均值±标准差(mean±S.D.)表示;分别对藻体长度与侧枝数、侧枝长度与生殖托数、生殖托长度与生殖托挂卵数等各形态建成因子间进行线性回归分析,显著性水平设为0.05;用相关性系数r2表示各形态因子间的相关性。
2 结果与分析
2.1 藻体长度与侧枝数的关系
从图3可见:成熟藻体的平均长度为(164.5±59.9)cm,其中成熟藻体的长度分布范围为67.3~344.2 cm,超过半数的藻体长度分布在100~200 cm范围内。平均每株藻体侧枝数为(89±31)个,其中成熟藻体的侧枝数量分布范围为80~164个,侧枝密度平均为(0.6±0.1)个/cm。藻体长度与侧枝数的散点分布如图4所示,结果显示,藻体长度与侧枝数之间呈线性正相关(r2=0.644,P<0.05),其回归方程如表1所示。

图3 海黍子成熟藻体形态因子分布Fig.3 Distribution of architectural factors in mature thalli of sea weedSargassum muticum

表1 海黍子群体相关因子的回归分析Tab.1 Regression of the correlation factor of sea weedSargassum muticumpopulation

图4 藻体长度与侧枝数的关系Fig.4 Relationship between thallus length and num ber of lateral branch
2.2 侧枝长度与生殖托数的关系
对侧枝长度统计分析发现,试验群体的侧枝平均长度为(10.4±5.3)cm,侧枝长度分布范围为1.6~25.7 cm,超过半数的侧枝长度分布在5~15 cm范围内(图3)。侧枝上生殖托平均数量为(43±35)个,其中单条侧枝上生殖托数分布范围为0~150个;侧枝上生殖托的平均密度为(3.5± 2.0)个/cm。侧枝长度与生殖托数的散点分布如图5所示,结果显示,侧枝长度与生殖托数之间呈线性正相关(r2=0.826,P<0.05),其回归方程如表1所示。此外,对试验群体测量发现,位于藻体主枝顶部的侧枝长度短于主枝中部和基部的侧枝长度,而且位于成熟藻体主枝顶部的部分侧枝上并未形成生殖托。

图5 侧枝长度与生殖托数的关系Fig.5 Relationship between length of lateral branch and number of receptacle
2.3 生殖托长度与生殖托挂卵数的关系
测量结果显示,生殖托平均长度为(9.3± 1.5)mm,其中生殖托长度分布范围为5.6~12.7 mm,接近半数的生殖托长度分布在8~10 mm范围内(图3)。生殖托上平均附卵数量为(378± 121)粒,其中单个生殖托上附卵数量分布范围为0~564粒;生殖托上的平均附卵密度为(41±15)粒/mm。生殖托长度与附卵数量的散点分布如图6所示,结果表明,生殖托长度与生殖托上附卵数量呈线性正相关(r2=0.623,P<0.05),其回归方程如表1所示。此外,对试验群体测量发现,藻体侧枝顶部的生殖托长度短于侧枝其他部分的生殖托长度,且位于侧枝顶部的部分生殖托外壁上没有发现卵。
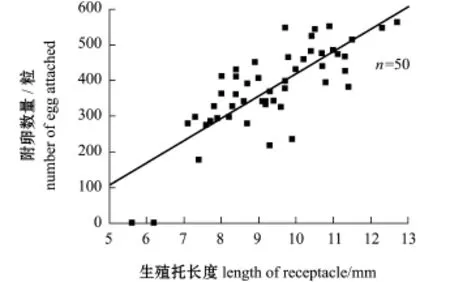
图6 生殖托长度与生殖托挂卵数的关系Fig.6 Relationship between length of receptacle and number of egg attached
2.4 海黍子生殖力估算
基于海黍子藻体自身结构特点,单株海藻的生殖力(产生卵细胞数量)=侧枝数×生殖托数×生殖托附卵数量。利用试验群体藻体长度、侧枝长度、生殖托长度的平均值,并结合试验数据分析获得的回归方程,可以推算出该海黍子群体单株藻体生殖力为(21~400)万粒/株。
3 讨论
动物和植物的生殖繁衍均依赖于其形态建成[9-10]。对墨角藻目海藻的相关研究表明,海藻有性繁殖过程中对藻体形态大小具有依赖性[11-12]。海黍子有性繁殖依赖于生殖托形成发育,本试验中发现,海黍子生殖托主要分布于侧枝上,海黍子主枝长度限制了侧枝的数量,而侧枝长度则制约着生殖托的数量,生殖托的长度则直接制约附卵数量。因此,海黍子藻体大小影响着个体生殖力,这与Arenas等[7]对欧洲海黍子种群的研究结果一致。生殖力对藻体大小的依赖反映了藻体营养资源对生殖构件的分配[13],个体生殖力与藻体大小具有一定相关性,这与对马尾藻科海藻生殖分配的相关研究结果一致[14-18]。
海藻个体发育受潮位、海浪等多种环境因素影响,群体的生殖分配比例也随环境因子不同而改变,从而使海藻个体生殖力大小具有波动性。Russell[19]研究发现:墨角藻Fucus vesiculosus在海浪较强的环境下,海藻群体倾向于产生更多的生殖细胞;而在海浪较弱的环境下,海藻群体产生的生殖细胞数则相对较少。对鼠尾藻的研究发现,其群体生殖分配受潮位和海浪等环境因素的影响明显且环境因子间存在交互作用[14]。海黍子在中国沿海分布广泛,而不同地理群体的生境存在差异,因而不同群体的个体生殖力也存在差异。
海黍子自然群体成熟期为1个月左右,个体成熟具有非同步性。成熟非同步性不仅表现在不同海藻个体间[20],即便是同一株海藻的生殖托也并非完全同步。本研究中发现,在成熟海黍子藻体主枝顶部的部分侧生分枝上生殖托尚未形成,而在侧枝顶部的部分生殖托个体较小且尚未挂卵,这表明海黍子有性生殖具有异步性,而环境因子很可能是导致海藻生殖非同步性的主要原因[17,21]。这种生殖非同步性使得难以在一个时间点估算成熟个体的完整生殖力,因此,本研究中测算获得的海黍子生殖力可能会比实际值略小。
海黍子有性繁殖能形成大量生殖细胞,但在中国沿海地区自然种群扩张能力有限,可采用人工繁育方法获得大量人工苗种。海黍子每年可有性繁殖一次[8],但受精卵需要在放散后避开水流刺激才能稳定地固着在附着基上[22-23],而海黍子群体多分布于近岸大干潮线下[24],在潮汐海流的冲击作用下,有性繁殖个体成活率不高。但利用海黍子有性繁殖特点进行人工苗种繁育,则能在短时间内获得大量幼苗[5]。马尾藻科海藻人工育苗实践表明,附着基上(20~70)万粒/m2的采苗密度适用于人工幼苗培育[25-27]。本研究结果表明,一株具有平均长度为(164.5±59.9)cm的海黍子成熟藻体能够产生(21~400)万粒卵细胞,即一株成熟海黍子藻体产卵量基本满足1 m2的采苗生产需要。
本研究中,通过对青岛海域海黍子群体统计分析发现,海黍子生殖力与藻体大小具有一定的相关性,试验群体中单株海黍子能够产生(21~400)万粒受精卵,可基本满足1 m2的采苗生产需要。由于时间、环境等因素的制约,本研究结果具有一定局限性,对不同生境、成熟期内不同阶段海黍子生殖力的状况有待于进一步研究。
[1]殷旭旺,李文香,白海峰,等.不同海藻饲料对刺参幼参生长的影响[J].大连海洋大学学报,2015,30(3):276-280.
[2]吕志华,于广利,迟连利,等.海黍子多酚对亚油酸甲酯氧化的抑制作用[J].中国海洋药物,2001,20(6):25-28.
[3]马伟伟,李丽,周革非.海黍子硫酸多糖体外免疫与抗肿瘤活性[J].食品科学,2013,34(7):270-274.
[4]Jobe C F,BrooksW R.Habitat selection and host location by symbiotic shrimps associated withSargassumcommunities:the role of chemical and visual cues[J].Symbiosis,2009,49:77-85.
[5]柴雨,王丽梅,宋广军,等.海黍子新生枝条的室内培养及有性生殖同步化[J].海洋渔业,2012,34(4):422-428.
[6]曹淑青,张泽宇,王国书,等.海黍子室内人工育苗技术的研究[J].大连水产学院学报,2008,23(5):359-363.
[7]Arenas F,Fernández C.Ecology ofSargassum muticum(Phaeophyta)on the North coast of Spain:III.reproductive ecology[J]. Botanica Marina,1998,41(1-6):209-216.
[8]Deysher L E.Reproductive phenology of newly introduced populations of the brown alga,Sargassum muticum(Yendo)Fensholt [J].Hydrobiologia,1984,116-117(1):403-407.
[9]Lovett D J,Lovett D L.Plant Reproductive Ecology:Patterns and Strategies[M].New York:Oxford University Press,1988.
[10]姜玉声,刘庆坤,李岑,等.日本蟳抱卵量与形态参数的相关性分析[J].大连海洋大学学报,2011,26(6):488-492.
[11]Ang Jr P O.Cost of reproduction inFucus distichus[J].Marine Ecology Progress Series,1992,89:25-35.
[12]Gillespie R D,Critchley A T.Reproductive allocation and strategy ofSargassum elegansSuhr andSargassum incisifolium(Turner) C.Agardh from reunion rocks,KwaZulu-Natal,South Africa[J].Botanica Marina,2001,44(3):231-235.
[13]姚红,谭敦炎.胡卢巴属4种短命植物个体大小依赖的繁殖输出与生活史对策[J].植物生态学报,2005,29(6):954-960.
[14]潘金华,张全胜,李晓捷,等.黄海太平角鼠尾藻有性繁殖分配[J].应用生态学报,2011,22(8):2167-2172.
[15]Zou Dinghui,Gao Kunshan,Ruan Zuoxi.Seasonal pattern of reproduction ofHizikia fusiformis(Sargassaceae,Phaeophyta)from Nanao Island,Shantou,China[J].Journal of Applied Phycology, 2006,18:195-201.
[16]Zhang Quansheng,LiWei,Liu Su,et al.Size-dependence of reproductive allocation ofSargassum thunbergii(Sargassaceae,Phaeophyta)in Bohai Bay,China[J].Aquatic Botany,2009,91 (3):194-198.
[17]Liu Wei,Wu Haiyi,Zhan Dongmei,et al.Phenological study ofSargassum thunbergii(Fucales,Phaeophyta)in Lidao Bay, Rongcheng,China[J].Chinese Journal of Oceanology and Limnology,2016,34(3):498-506.
[18]张树宝,唐永政,王志芳,等.鼠尾藻生长与生殖的权衡[J].生态学报,2010,30(22):6027-6034.
[19]Russell G.Heavy receptacles in estuarineFucus vesiculosusL. [J].Estuarine and Coastal Marine Science,1979,9(5):659-661.
[20]Pang Shaojun,Chen Lantao,Zhuang Dinggen,et al.Cultivation of the brown algaHizikia fusiformis(Harvey)Okamura:enhanced seedling production in tumbled culture[J].Aquaculture,2005, 245(1-4):321-329.
[21]Engelen A H,Breeman A M,Olsen JL,etal.Life history flexibility allowsSargassum polyceratiumto persist in different environments subjected to stochastic disturbance events[J].Coral Reefs, 2005,24(4):670-680.
[22]Norton T A,Fetter R.The settlement ofSargassum muticumpropagules in stationary and flowing water[J].Journal of the Marine Biological Association of the United Kingdom,1981,61(4): 929-940.
[23]Liu Wei,Wu Haiyi,Liu Mengxia,et al.Improvement of the zygote utilization and reduction of the seedling loss in the early stage of seedling production ofSargassum thunbergii(Fucales,Phaeophyta)[J].Chinese Journal of Oceanology and Limnology,2016,34 (3):492-497.
[24]曾呈奎.中国黄渤海海藻[M].北京:科学出版社,2009.
[25]Xie Enyi,Liu Dongchao,Jia Cheng,et al.Artificial seed production and cultivation of the edible brown algaSargassum naozhouenseTseng et Lu[J].Journal of Applied Phycology, 2013,25(2):513-522.
[26]Pang Shaojun,Shan Tifeng,Zhang Zhihuai,et al.Cultivation of the intertidal brown algaHizikia fusiformis(Harvey)Okamura: mass production of zygote-derived seedlings under commercial cultivation conditions,a case study experience[J].Aquaculture Research,2008,39(13):1408-1415.
[27]Zhang Quansheng,Tang Yongzheng,Liu Shikai,et al.Zygote-derived seedling production ofSargassum thunbergii:focus on two frequently experienced constraints in tank culture of seaweed[J]. Journal of Applied Phycology,2012,24(4):707-714.
An analysis of architectural factors related to sexual reproduction of sea weedSargassum muticum
LIUWei1,2,WU Hai-yi1,2,WANG Xiang-yu1,2,XIN Mei-li1,2,LIU Meng-xia1
(1.Marine Biology Institute of Shandong Province,Qingdao 266104,China;2.Macroalgae Engineering Technology Center of Qingdao,Qingdao 266104,China)
The architectural factors related with sexual reproduction of seaweedSargassum muticumincluding relationships between thallus length and lateral branch number,lateral branch length and receptacle number and receptacle length and number of egg attached on receptacle,and individual fecundity were analyzed by regression equations in order to assess the sexual reproduction fecundity of the seaweed.Itwas found that the seaweed had average thallus length of(164.5±59.9)cm,average lateral branch length of(10.4±5.3)cm,average receptacle length of(9.3±1.5)mm and average egg attached number of(378±121)per individual,with a linear positive correlation between architectural factors.The findings indicated that a mature thallus of the sea weed produced (21-400)×104per individuals of eggs,sufficient for 1 m2collectors in seedling production.
Sargassum muticum;fecundity;architectural factor;sexual reproduction
S917.3
A
10.16535/j.cnki.dlhyxb.2016.06.006
2095-1388(2016)06-0618-05
2016-04-05
国家海洋公益性行业科研专项(201305021,201305043)
刘玮(1981—),男,博士,助理研究员。E-mail:liuwei_mbi@163.com
吴海一(1973—),男,博士,副研究员。E-mail:wuhaiyi1997@163.com
