不同驯化温度对施氏鲟幼鱼肝脏线粒体代谢的影响
2016-02-10赵志刚李晋南徐奇友王常安王连生
赵志刚,李晋南,徐奇友,罗 亮,王常安,王连生,都 雪,王 海
(中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070)
不同驯化温度对施氏鲟幼鱼肝脏线粒体代谢的影响
赵志刚,李晋南,徐奇友,罗 亮,王常安,王连生,都 雪,王 海
(中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070)
为研究不同驯化温度对体质量为(6.26±0.21)g的施氏鲟Acipenser schrenckiiBrandt幼鱼肝脏线粒体代谢的影响,将试验分为8个温度驯化组,分别设16、19、22、25℃4个恒温组,以及(16±2)、(19± 2)、(22±2)、(25±2)℃4个变温组,驯化6周后取样,分别测定各驯化组施氏鲟幼鱼肝脏组织线粒体的蛋白含量、呼吸率和细胞色素C氧化酶(CCO)活性。结果表明:施氏鲟肝脏组织线粒体蛋白含量在各驯化组间均无显著性差异(P>0.05);鱼体肝脏组织线粒体状态3呼吸率和状态4呼吸率均随着驯化温度的升高显著增加(P<0.05),在16℃和19℃驯化组中,恒温处理和变温处理间均无显著差异(P>0.05),而在22℃和25℃驯化组中,变温驯化组的线粒体状态3呼吸率和状态4呼吸率均显著高于恒温驯化组(P<0.05);鱼体肝脏组织线粒体的呼吸控制率(RCR)随驯化温度的升高呈显著降低的趋势(P<0.05),在各温度驯化组中,线粒体的RCR在恒温和变温处理间均无显著性差异(P>0.05);鱼体肝脏组织线粒体CCO活性随着驯化温度的升高显著增加(P<0.05),但酶活性在恒温和变温处理间均无显著性差异(P>0.05)。研究表明,20~27℃的变温驯化能够显著诱导施氏鲟线粒体呼吸率升高。
施氏鲟;恒温;变温;线粒体;代谢
线粒体是动物机体细胞内利用氧并产生能量(ATP)的主要场所[1-2]。研究表明,动物机体组织线粒体中的电子传递链及氧化磷酸化过程的代谢模式是高度保守的,对于环境变化的任何适应性反应都应当是对其量值的调节,而不是对其代谢途径或模式的更新[3-4]。当环境温度条件发生改变时,线粒体生产ATP的速率将随之调控,以保持动物机体生理功能的相对稳定[4]。因此,线粒体代谢途径随环境因子变化的调节能力就决定了该物种在环境变化中的适应性[5]。鱼类作为变温动物,由于缺乏稳定体温的调节机制,其机体线粒体功能对环境温度的变化会更为敏感[6]。
施氏鲟Acipenser schrenckiiBrandt是中国重要的大型名贵经济鱼类,用其卵制成的鱼子酱有“黑色黄金”之称,具有极高的经济价值[7-8]。施氏鲟自然分布于黑龙江水系,生存水温为1~30℃,人工养殖条件下,在17~26℃范围内均能正常摄食和生长[9]。自然界中施氏鲟生存的水温是周期性变化的,如昼夜变化、季节变化等。目前,关于不同温度条件下鲟科鱼类组织线粒体代谢方面的研究尚未见报道。本试验中,在不同恒温和变温驯化条件下,研究了施氏鲟幼鱼肝脏线粒体代谢的变化情况,旨在为探索施氏鲟的代谢调节机制提供依据。
1 材料与方法
1.1 材料
试验用施氏鲟幼鱼取自中国水产科学研究院鲟鱼繁育中心,体质量为(6.26±0.21)g,将幼鱼运回后在室内循环水族箱内暂养2周。暂养用水为曝气自来水,期间饱食投喂鲟鱼商品鱼苗种配合饲料,每天换水1/3,水温控制在(20±1)℃。
线粒体提取试剂盒购自南京建成生物有限公司。线粒体蛋白含量测定试剂盒(BCA蛋白定量试剂盒)购自北京艾德莱生物有限公司。
1.2 方法
1.2.1 温度设计 试验设16、19、22、25℃4个恒温组,以及(16±2)、(19±2)、(22±2)、(25± 2)℃4个变温组,共8个温度组。变温组的温度通过可编程智能温度控制仪进行控制,即在06:00从最低温开始逐渐升温,到13:00上升到最高温度,13:00~18:00保持在最高温度;从18:00后开始逐渐降温,到次日01:00逐渐降到最低温度,从01:00~06:00保持最低温度,以24 h为单位进行循环。
1.2.2 温度驯化 暂养结束后,选择规格整齐且健康的试验鱼转移至不同处理组循环水玻璃缸中进行温度驯化,放养密度为每缸20尾。每天以1℃的变化速率升温或降温,达到驯化温度后,在各温度条件下驯化6周。驯化用水为曝气自来水。驯化期间每天换水1/3以上,每天于08:30、13:00和17:00饱食投喂鲟商品鱼苗种配合饲料,定期清除残饵和粪便。整个驯化期间,各处理组溶解氧均保持在5.5 mg/L以上,光照周期为12 L∶12 D。驯化结束后,试验鱼停食48 h,以保证各处理组鱼体完全处于空腹状态。然后从每个处理组随机取6尾鱼,用MS-222麻醉剂麻醉后,在冰盘上迅速解剖,摘取完整肝脏,在液氮中速冻后放入超低温冰箱(-80℃)中保存备用。
1.2.3 组织线粒体的制备 准确称取100~200 mg冻存的肝脏样品,用生理盐水冲洗干净,滤纸吸干。剪碎后将组织放入一个置于冰上的离心管中,加入1.5 mL预冷的裂解液,冰浴过程中用间隙严密的研杵研磨组织20次(相差显微镜下检查未裂解细胞应在50%左右即可)。将匀浆液转移至预冷的离心管中,在800g条件下离心5 min。另取一个新的预冷离心管,在其中预先加入0.5 mL溶液A,将离心后的上清液0.5 mL沿管壁加入含有溶液A的离心管中,覆盖于溶液A的上层,再在15 000g条件下离心10 min,离心后的沉淀则为线粒体。在沉淀中加入0.2 mL漂洗液重新悬浮线粒体沉淀,在15 000g条件下离心10min,弃上清液。用50~100μL储存液或合适的缓冲液重悬线粒体沉淀,立即使用或在-70℃下保存。以上操作均在(0~4)℃条件下进行。
1.2.4 组织线粒体呼吸率及细胞色素C氧化酶活性的测定 通过液相氧电极(Hansatech公司)分别在16、19、22、25℃下测定对应温度下各处理组样品肝脏组织线粒体呼吸率及细胞色素C氧化酶(CCO)的活性,每个处理组的样本量为6。具体测定方法见文献[5]。
每个线粒体样品均重复测定2~3次,线粒体呼吸率及CCO活性均采用单位线粒体蛋白含量的耗氧率表示。
1.3 数据处理
试验结果均用平均值±标准差(mean±S.D.)表示。试验数据用SPSS 19.0软件进行统计分析,分别对各处理组的试验数据进行单因素方差(One-Way ANOVA)分析和Duncan’s多重比较,显著性水平设为0.05。
2 结果与分析
2.1 线粒体蛋白含量
从图1可见,鱼体肝脏组织的线粒体蛋白含量为7.80~10.22 mg/g,且各温度处理组间均无显著性差异(P>0.05)。

图1 不同温度驯化组施氏鲟幼鱼肝脏组织线粒体蛋白含量Fig.1 M itochondrial protein contents in liver of juvenile Amur sturgeonAcipenser schrenckiiacclimatized at different tem perature
2.2 线粒体呼吸率
从图2、图3可见:鱼体肝脏组织线粒体状态3呼吸率和状态4呼吸率表现出相同的变化趋势,两者的呼吸率均随驯化温度的不断升高显著增加(P<0.05);在16℃和19℃驯化组中,恒温或变温处理间均无显著性差异(P>0.05),而在22℃和25℃驯化组中,变温驯化组的线粒体状态3呼吸率和状态4呼吸率均显著高于恒温驯化组(P<0.05)。
从图4可见:鱼体肝脏组织线粒体的呼吸控制率(RCR)随驯化温度的升高呈显著降低的趋势(P<0.05);各温度驯化组中,恒温和变温处理组间无显著性差异(P>0.05);恒温或变温处理条件下,22、25℃驯化组间CRC无显著性差异(P>0.05),但均显著低于16、19℃组(P<0.05)。
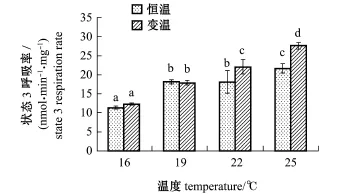
注:标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同Note:The means with different letters are significant differences at the 0.05 probability level,and the means with the same letters are not significant differences,et sequentia图2 不同温度驯化组施氏鲟肝脏组织线粒体状态3呼吸率Fig.2 M itochondrial state3 respiration rates in liver of juvenile Amur sturgeonAcipenser schrenckiiacclimatized at different temperature

图3 不同温度驯化组施氏鲟肝脏组织线粒体状态4呼吸率Fig.3 M itochondrial state4 respiration rates in liver of juvenile Amur sturgeonAcipenser schrenckiiacclimatized at different temperature

图4 不同温度驯化组施氏鲟肝脏组织线粒体的呼吸控制率Fig.4 RCR values ofm itochondrial respiration in liver of juvenile Amur sturgeonAcipenser schrenckiiacclimatized at different temperature
2.3 线粒体细胞色素C氧化酶活性
从图5可见:鱼体肝脏组织线粒体细胞色素C氧化酶活性随驯化温度的升高显著增加(P<0.05);各温度驯化组中,酶活性在恒温和变温处理间均无显著性差异(P>0.05)。

图5 不同温度驯化组施氏鲟肝脏组织线粒体CCO活性Fig.5 M itochondrial cytochrome C oxidase activity in liver of juvenile Amur sturgeonAcipenser schrenckiiacclimatized at different tem perature
3 讨论
3.1 温度对线粒体蛋白含量及呼吸率的影响
通常用线粒体蛋白含量来表征组织细胞的线粒体含量[10-11]。研究表明,一些鱼类经过温度驯化后其组织线粒体的数量会发生改变,如经过低温驯化的欧洲鲫Carassius auratus和条纹狼鲈Morone saxatilis,其肌肉线粒体的数量会明显升高[12-13],而对南方鲇SilurusmeridionalisChen的研究发现,其肝脏、肾脏和心脏组织中线粒体数量在不同温度驯化组间并无明显差异[5]。本研究结果显示,施氏鲟幼鱼肝脏组织的线粒体蛋白含量在不同的恒温组和变温组间均无显著性差异(图1),表明不同的温度驯化对施氏鲟肝脏组织线粒体数量的增殖不产生诱导作用,同时也进一步表明,温度驯化诱导鱼体组织线粒体数量在不同鱼类中可能存在种间差异。
Estabrook[14]根据线粒体呼吸控制率和磷氧比,将动物机体细胞线粒体呼吸率的测定过程分为4个状态,其中,状态3的呼吸率通常代表线粒体的最高代谢水平,而状态4的呼吸率则能够反映组织线粒体内膜通透性的大小。状态3与状态4呼吸率的比值通常被定义为线粒体的呼吸控制率(RCR),该指标可评价线粒体功能状态及氧化磷酸化的偶联程度[6,15-16]。线粒体的能量代谢过程本质上是一系列复杂酶促反应的结果,一定程度的升温可促进酶促反应速率,进而增加其呼吸率。随着驯化温度的升高,施氏鲟鱼体肝脏组织线粒体状态3和状态4呼吸率均显著增加(图2和图3)。一些研究发现,南极鱼Notothenia neglecta、南方鲇等鱼体组织线粒体状态3和状态4呼吸率在一定温度范围内也与本试验表现出相同的变化趋势[17-18]。本试验结果显示,在16℃和19℃驯化组中,恒温和变温处理间均无显著性差异,而在22℃和25℃驯化组中,变温驯化组的线粒体状态3和状态4呼吸率均显著高于恒温驯化组(图2和图3),表明与恒温驯化相比,较低温度下的变温驯化(14~21℃)不足以诱导施氏鲟鱼体肝脏线粒体呼吸率发生变化,而较高温度下的变温驯化(20~27℃)则能够显著诱导其线粒体呼吸率升高。该结果也进一步表明,施氏鲟肝脏线粒体对较高温度下的变温(20~27℃)更为敏感。鱼类体温的变化取决于周围水环境温度的变化,水温的变化可直接影响鱼体内的各种生理功能[19]。有学者认为,温度变化能够改变机体组织线粒体中一些生物活性分子的敏感度[6]。线粒体在发挥功能过程中,ADP作为反应底物对氧化磷酸化过程有重要的调节作用[20],其对温度的变化极为敏感,对虹鳟肌肉线粒体的研究也证明了这一点[21]。
3.2 温度对线粒体呼吸控制率及细胞色素C氧酶活性的影响
本试验结果显示,在各温度驯化组中,施氏鲟肝脏组织线粒体的RCR值在恒温和变温处理间均无显著性差异(图4),表明与恒温相比,变温驯化对施氏鲟鱼体肝脏线粒体功能中的氧化磷酸化的偶联程度不产生显著影响。CCO是线粒体中的关键代谢酶[6]。本试验中,施氏鲟肝脏组织线粒体CCO活性随着驯化温度的升高显著增加,但在各温度驯化组中,酶活性在恒温处理和变温处理间均无显著性差异(图5)。该结果表明,在本试验温度范围内,变温驯化不能诱导施氏鲟肝脏组织线粒体CCO活性发生变化。一些广温性鱼类经过适当的低温驯化后会提高某些关键代谢酶的活性,通过这种方式增强其代谢能力来适应低温环境[22-23]。也有研究发现,温度驯化并不能引起线粒体关键代谢酶活性的改变[24-25]。对南方鲇的研究表明,其心脏、肾脏和肝脏组织线粒体的CCO活性在温度驯化过程中变化显著,而脑和白肌中的差异并不显著[18]。因此,不同温度条件驯化对鱼体组织线粒体关键代谢酶的活性变化影响,不仅存在种间差异,而且还可能存在组织差异。
[1]Guderley H,St-Pierre J.Going with the flow or life in the fast lane:contrasting mitochondrial responses to thermal change[J]. Journal of Experimental Biology,2002,205(15):2237-2249.
[2]Moyes C D,Hood D A.Origins and consequences ofmitochondrial variation in vertebratemuscle[J].Annual Review of Physiology, 2003,65(1):177-201.
[3]Koch L G,Britton S L.Aerobic metabolism underlies complexity and capacity[J].The Journal of Physiology,2008,586(1):83-95.
[4]Seebacher F,Murray SA,Eles P L.Thermal acclimation and regulation ofmetabolism in a reptile(Crocodylus porosus):the importance of transcriptional mechanisms and membrane composition [J].Physiological and Biochemical Zoology,2009,82(6):766-775.
[5]闫玉莲,谢小军.温度及光照驯化对南方鲇线粒体代谢补偿调节的影响[J].水生生物学报,2014,38(3):422-429.
[6]闫玉莲,谢小军.鱼类适应环境温度的代谢补偿及其线粒体水平的调节机制[J].水生生物学报,2012,36(3):532-540.
[7]孙大江,曲秋芝,马国军,等.史氏鲟人工繁殖及养殖技术[M].北京:海洋出版社,2000.
[8]席庆凯,弘颖,刘晓勇,等.施氏鲟胚胎发育阶段可溶性蛋白、性激素含量和免疫相关指标的变化[J].大连海洋大学学报, 2015,30(4):357-362.
[9]李大鹏,庄平,严安生,等.施氏鲟幼鱼摄食和生长的最适水温[J].中国水产科学,2005,12(3):294-299.
[10]Lannig G,Storch D,Pörtner H O.Aerobic mitochondrial capacities in Antarctic and temperate eelpout(Zoarcidae)subjected to warm versus cold acclimation[J].Polar Biology,2005,28(8): 575-584.
[11]Guderley H,Seebacher F.Thermal acclimation,mitochondrial capacities and organmetabolic profiles in a reptile(Alligatormississippiensis)[J].Journal of Comparative Physiology B,2011,181 (1):53-64.
[12]Egginton S,Sidell B D.Thermal acclimation induces adaptive changes in subcellular structure of fish skeletalmuscle[J].American Journal of Physiology,1989,256(1):R1-R9.
[13]Londraville R L,Sidell B D.Cold acclimation increases fatty acid-binding protein concentration in aerobic muscle of striped bass,Morone saxatilis[J].Journal of Experimental Zoology, 1996,275(1):36-44.
[14]Estabrook RW.Mitochondrial respiratory control and the polarographicmeasurement of ADP:O ratios[J].Methods in Enzymology,1967,10:41-47.
[15]Nicholls D G,Ferguson S J.Bioenergetics 2[M].London:Academic Press,1992.
[16]Guderley H,St-Pierre J,Couture P,etal.Plasticity of the properties ofmitochondria from rainbow trout red muscle with seasonalacclimatization[J].Fish Physiology and Biochemistry,1997,16 (6):531-541.
[17]SugizakiM,Lucchiari PH,MalucelliM IC,etal.Respiration and oxidative phosphorylation ofmitochondria from tissues and organs of Antarctic fish[J].Proceedings of the NIPR Symposium on Polar Biology,1997,10:145-152.
[18]闫玉莲,谢小军,袁伦强.温度对南方鲇肝组织离体线粒体代谢耗氧率的影响[J].水生生物学报,2008,32(2):237-243.
[19]Guderley H.Metabolic responses to low temperature in fish muscle[J].Biological Reviews,2004,79(2):409-427.
[20]Murphy M P,Brand M D.The control of electron flux through cytochrome oxidase[J].Biochemical Journal,1987,243(2):499-505.
[21]Guderley H,St-Pierre J.Seasonal cycles of mitochondrial ADP sensitivity and oxidative capacities in trout oxidativemuscle[J]. Journal of Comparative Physiology B,1999,169(7):474-480.
[22]St-Pierre J,Charest P M,Guderley H.Relative contribution of quantitative and qualitative changes in mitochondria to metabolic compensation during seasonal acclimatisation of rainbow trout,Oncorhynchusmykiss[J].Journal of Experimental Biology,1998, 201(21):2961-2970.
[23]Kraffe E,Marty Y,Guderley H.Changes in mitochondrial oxidative capacities during thermal acclimation of rainbow trout,Oncorhynchusmykiss:roles ofmembrane proteins,phospholipids and their fatty acid compositions[J].Journal of Experimental Biology, 2007,210(1):149-165.
[24]Lucassen M,Schmidt A,Eckerle L G,et al.Mitochondrial proliferation in the permanent vs.temporary cold:enzyme activities and mRNA levels in Antarctic and temperate zoarcid fish[J].A-merican Journal of Physiology,2003,285(6):R1410-R1420.
[25]Lucassen M,Koschnick N,Eckerle L G,et al.Mitochondrial mechanisms of cold adaptation in cod(GadusmorhuaL.)populations from different climatic zones[J].Journal of Experimental Biology,2006,209(13):2462-2471.
Effects of different acclimation tem perature on m itochondrial metabolism in liver of juvenile Amur sturgeonAcipenser schrenckiiBrandt
ZHAO Zhi-gang,LIJin-nan,XU Qi-you,LUO Liang,WANG Chang-an, WANG Lian-sheng,DU Xue,WANG Hai
(Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
The aim of this study is to investigate the effects of different acclimation temperature on mitochondrial metabolism in liver of juvenile Amur sturgeonAcipenser schrenckiiBrandtwith body weight of(6.26±0.21)g.The mitochondrial protein contents,mitochondrial respiration rates and mitochondrial cytochrome C oxidase activity (CCO)weremeasured in liver of the fish acclimated at constant temperature of16,19,22 and 25℃and four variable temperature(16±2),(19±2),(22±2)and(25±2)℃for 6 weeks.The results showed that there were no significant differences in mitochondrial protein contents in the fish between acclimation groups(P>0.05).However,themitochondrial state 3 and state 4 respiration rateswere found to be increased significantly with increases in acclimation temperature(P<0.05),without significant differences in acclimation groups of 16℃and 19℃(P>0.05),even though therewere significanthighermitochondrial respiration rates in variable temperature groups than those in constant temperature groups in acclimation groups of22℃and 25℃(P<0.05).The RCR values ofmitochondrial respiration in liver were declined significantly with increases in acclimation temperature(P<0.05), without significant differences between constant temperature groups and variable temperature groups in all acclimation temperature(P>0.05).With increases in acclimation temperature,themitochondrial CCO activitieswere increased significantly(P<0.05),without significant differences between constant temperature groups and variable temperature groups(P>0.05).The findings indicate that variable temperature acclimation from 20℃to 27℃can lead to significantly induce increases in mitochondrial respiration rates in liver of juvenile Amur sturgeon.
Acipenser schrenckiiBrandt;constant temperature;variable temperature;mitochondrion;metabolism
S917.4
A
10.16535/j.cnki.dlhyxb.2016.06.004
2095-1388(2016)06-0607-05
2016-06-22
国家自然科学基金资助项目(31302204);黑龙江省自然科学基金资助项目(QC2015041)
赵志刚(1982—),男,博士,助理研究员。E-mail:zhaozhigang@hrfri.ac.cn
