蟾酥逆转多重耐药鲍曼不动杆菌氨基糖苷类耐药研究
2016-02-10王晓磊余道军侯晓丽
王晓磊余道军侯晓丽
蟾酥逆转多重耐药鲍曼不动杆菌氨基糖苷类耐药研究
王晓磊1余道军1侯晓丽2
蟾酥;鲍曼不动杆菌;氨基糖苷类;多重耐药;RT-PCR
鲍曼不动杆菌(acinetobacter baumannii,AB)是生存能力较强的非发酵条件致病菌,广泛存在于医院环境中,是院内感染的主要病原菌。随着目前医院广谱抗菌药物、各类免疫抑制剂的广泛使用及各种介入治疗的普及,导致鲍曼不动杆菌的耐药率逐年增高。近几年中国CHINET耐药性监测中均发现,多重耐药鲍曼不动杆菌无论是在耐药菌中所占的比例或对临床常见的抗菌药物的耐药率,均呈逐年上升的趋势[1-3]。
中药蟾酥具有强心、升压、镇痛以及抗肿瘤等多种药理活性,但成分复杂。本实验通过研究两种蟾酥制剂作用不同时间,对多重耐药鲍曼不动杆菌氨基糖苷类抗菌药物相关耐药基因表达的影响,从基因表达调控角度探讨蟾酥作用时间对鲍曼不动杆菌氨基糖苷类耐药性的影响及其部分机制。
1 实验材料
1.1 菌株来源 收集2014年1月—2015年4月期间来我院就诊的患者痰、血液、伤口分泌物及胆汁等标本,分离得到非重复100株鲍曼不动杆菌。并通过琼脂稀释法检测蟾酥和氨基糖苷类抗菌药物单独及联合使用获得最低抑菌浓度(minimum inhibitory con-centration,MIC),筛选2株菌株用于耐药基因表达实验。
1.2 药物与仪器 蟾酥(购自浙江中医药大学门诊部);荧光定量PCR分析仪(ABI7500荧光定量PCR分析仪);生物安全柜(新加坡ESCO公司生产,型号AC2-4S1);高速冰冻离心机(德国赛默飞生产,型号Thermo Micro 17R型)。
1.3 主要试剂 细菌总RNA提取试剂盒(北京庄盟国际生物基因科技有限公,批号3140309-02HW)。一步法SYBGREEN RT-PCR试剂(TaKaRa公司,批号804051)。灭菌注射用水(浙江瑞新药业股份有限公司,批号20150818)。无水乙醇(杭州龙山精细化工有限公司,批号20150726)。
2 实验方法
2.1 蟾酥有效成分提取 (1)醇提蟾酥:称取片状蟾酥0.5g,充分研磨,加入50mL无水乙醇,放置在37℃恒温振荡器,100~110Rmp/min振荡48h,分装到15mL离心管中,3000Rmp/min,离心10min,取上清液,用滤纸将上清液过滤,将过滤液用0.2μm的除菌滤器再次过滤除菌,用无水乙醇定容至100mL,蟾酥浓度记为5mg/mL。保存在无菌的Eppendorf管中,置4℃冰箱备用;(2)水提蟾酥:称取片状蟾酥0.5g,充分研磨,加入50mL蒸馏水,放置在37℃恒温振荡器,100~110Rmp/min振荡48h,分装到15mL离心管中,3000Rmp/min,离心10min,取上清液,用滤纸将上清液过滤,将过滤液分装至1.5mL Eppendorf管中。取上述已分装的上清液,12 000Rmp/min,离心10min后,再用0.2μm的除菌滤器过滤除菌,用无菌注射用水定容至100mL,蟾酥浓度记为5mg/mL。保存在无菌的Eppendorf管中,置4℃冰箱备用。
2.2 实验菌株配置 通过先期实验,根据琼脂稀释法检测蟾酥和氨基糖苷类抗菌药物单独及联合使用时,最低抑菌浓度的变化情况,筛选出2株具有协同抗菌作用的菌株用于耐药基因表达实验,菌株编号为32和34。菌株重新纯培养,将培养的菌株配成0.5麦氏单位的混悬液,并用营养肉汤稀释100倍,备用。醇提蟾酥和水提蟾酥配置:将醇提、水提蟾酥分别用营养肉汤稀释,浓度为32、34号菌株的0.5MIC浓度。吸取稀释好的菌液100μL,分别加到醇提蟾酥和水提蟾酥中(细菌终浓度105CFU/mL),同时记录时间。分别作用0、0.5、1、2、4、8、16、24和48h后提取菌株的RNA。
2.3 RNA纯度及含量检测 RNA提取步骤严格按照试剂盒说明书操作。取RNA液1μL,在微量核酸检测仪上检测其纯度(得到OD260/OD280为1.9),然后采用电泳法半定量其含量。
2.4 引物合成 根据相关参考文献设计引物,并委托上海生工生物有限公司合成。见表1。
2.5 反应体系 2×one stop SYBR Green Mix 10μL、one stop SYBR Green Mix 1μL、Dye 2 0.4μL、上游引物0.4 μL、下游引物0.4μL、ddH2O 3.8μL和RNA模板4μL,共计20μL。
2.6 反应条件 按照TaKaRa试剂公司的说明书进行PCR反应,条件为50℃30min,95℃5min,95℃10s,60℃40s,其中95℃10s和60℃40s循环40次。
2.7 统计学方法 应用SPSS13.0软件对两种蟾酥制剂对氨基糖苷类耐药基因表达影响的结果进行χ2检验比较,以孕<0.05表示差异有统计学意义。

表1 引物合成表
3 结果
两种蟾酥提取液分别与鲍曼不动杆菌菌株作用不同时间,醇提蟾酥作用后的CT值普遍高于水提蟾酥作用,显示醇提蟾酥抑制耐药基因表达作用强于水提蟾酥。两种蟾酥提取液对鲍曼不动杆菌氨基糖苷类耐药基因表达影响,醇提蟾酥作用16、24h后,氨基糖苷类耐药基因aac(6')-Ⅱ和aac(6')-Ⅰ基因的表达水平均有不同程度下降,48h左右抑制作用减弱。水提蟾酥抑制耐药基因的作用弱于醇提蟾酥,仅在4h对aac(6')-Ⅱ有抑制作用,但维持时间短,并逐渐减弱,对aac(6')-Ⅰ则基本无抑制作用,仅24h时有较弱的抑制作用。蟾酥对氨基糖苷类耐药基因ant(3〞)-Ⅰ基因整体抑制效果不佳,醇提蟾酥作用16h时对ant(3〞)-Ⅰ表达有微弱抑制作用,随后逐渐减弱。而水提蟾酥基本无抑制ant(3〞)-Ⅰ表达作用。两种蟾酥制剂对AMI-aphA1和AMIaadA1作用效果基本一致,醇提蟾酥作用16~24h时对这两种基因表达有较明显的抑制作用,但维持时间短。水提蟾酥对这两种基因的抑制作用较弱。蟾酥作用48h时,以上基因的RT-PCR结果显示均有较为明显的CT值下降。醇提蟾酥作用16和24小时对五种基因的表达与作用与其他时间段比较,差异有统计学意义(孕<0.05)。水提蟾酥作用0、0.5、1和2小时对五种基因的表达与作用与其他时间段比较,差异有统计学意义(孕<0.05),见表2~5。
4 讨 论
随着抗生素尤其是广谱抗生素的大量应用,临床上多重耐药鲍曼不动杆菌的分离率越来越高[4-5],给临床抗感染治疗带来极大困扰。临床上多药联合应用容易产生更强的耐药菌株[6]。研究[7-10]表明,某些中药与抗菌药物联用可以产生显著的增效作用,因此中药与抗菌药物联用成为新的研究热点。
蟾酥为中华大蟾蜍或黑眶蟾蜍的耳后腺及皮肤腺的分泌物,干燥后可以入药。余道军等[11]研究发现蟾酥的水提和醇提液均可以使大肠杆菌的耐药基因TEM和CTX-M-9的mRNA表达丧失,从耐药表型的研究表明其逆转了大肠杆菌的对相关抗菌药的耐药性。说明中药不仅有良好的抗菌作用,其在恢复已
经耐药的细菌对相关抗菌药物敏感性方面也有良好的效果。任玲玲等[12-13]和游思湘[14]的相关研究显示,中药可以改变耐药菌的基因序列,抑制其耐药性,降低对某一类抗菌药物的耐药性。
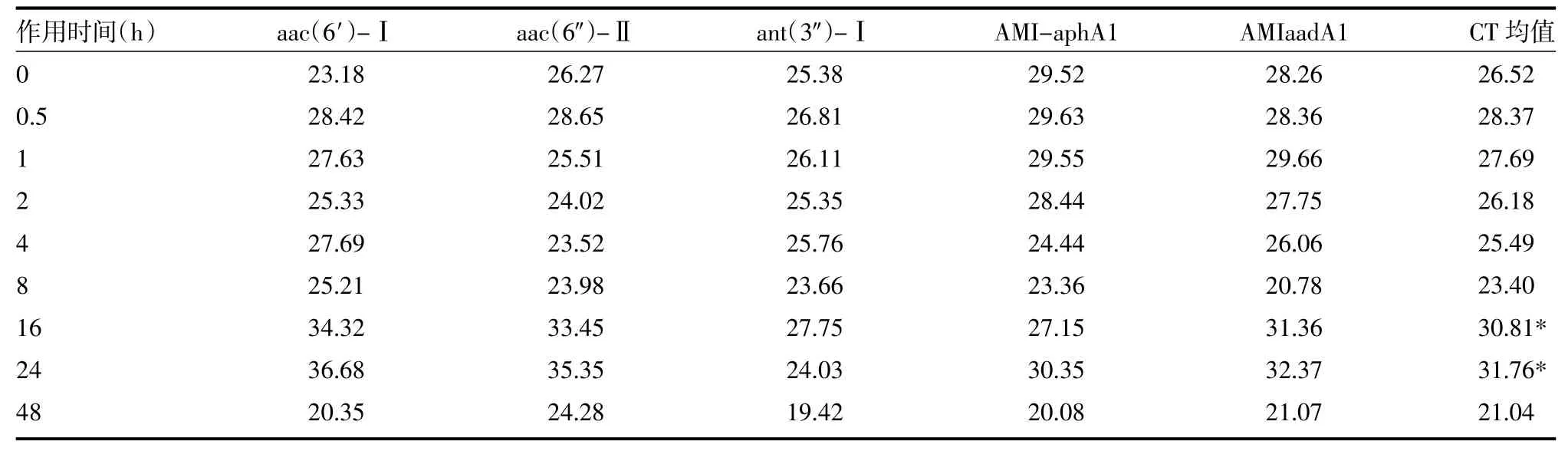
表2 32号菌株醇提蟾酥作用后氨基糖苷类耐药基因表达结果(CT值)

表3 32号菌株水提蟾酥作用后氨基糖苷类耐药基因表达结果(CT值)

表4 34号菌株醇提蟾酥作用后氨基糖苷类耐药基因表达结果(CT值)

表5 34号菌株水提蟾酥作用后氨基糖苷类耐药基因表达结果(CT值)
本研究通过RT-PCR检测多重耐药鲍曼不动杆菌氨基糖苷类药物耐药基因的表达情况,发现醇提蟾酥作用0~8h,aac(6')-Ⅱ和aac(6')-Ⅰ的表达没有被明显抑制,当作用16~24h后,aac(6')-Ⅱ和aac (6')-Ⅰ基因的表达水平均有不同程度下降,说明醇蟾酥抑制基因表达的作用可能有一定的累加效应。醇提蟾酥的抑制作用在48h左右又减弱,可能是由于醇提蟾酥有效成分降解变化所致。水提蟾酥抑制耐药基因的作用弱于醇提蟾酥,对aac(6')-Ⅱ在4h左右有抑制作用,但维持时间短,8h后已基本无作用,对aac(6')-Ⅰ则基本无抑制作用,只在24h时有较弱的抑制作用。
本研究显示,蟾酥对核苷转移酶的相关基因ant (3〞)-Ⅰ表达的整体抑制效果不佳。RT-PCR检测显示,醇提蟾酥在作用16h左右时有微弱的抑制核苷转移酶的相关基因ant(3〞)-Ⅰ表达的作用,随后即逐渐减弱,而水提蟾酥基本没有抑制ant(3〞)-Ⅰ表达的作用。所以我们推测,本次研究的鲍曼不动杆菌耐药与核苷转移酶基因表达关系不是很密切。
蟾酥对AMI-aphA1和AMIaadA1基因作用的结果显示,两种蟾酥制剂的作用效果基本一致。醇提蟾酥在作用1h时有较明显的抑制这两种基因表达的作用,但维持时间短,2h后基本无抑制作用。造成这种现象的机制尚不明确,有待进一步的研究。水提蟾酥对这两种基因在2h时有较弱的抑制作用,2h后也基本无抑制作用。蟾酥作用48h时,上述基因的RT-PCR结果显示均有较为明显的CT值下降,基因表达重新活跃,原因可能与蟾酥的有效成分降解或代谢有关。
综上所述,蟾酥有抑制多重耐药鲍曼不动杆菌氨基糖苷类药物耐药基因表达的作用,这种作用的强弱程度与蟾酥作用时间有一定的关系,且在不同的基因会有不同的表现。从总体抑制基因表达效果分析,醇提蟾酥在16h和24h时抑制基因表达的效果明显,而水提蟾酥则在前2h效果较明显,推测可能和不同蟾酥制剂的有效成分不用,发挥作用的时间有关。通过对抑制基因表达结果的分析,说明蟾酥可能有逆转细菌氨基糖苷类耐药性的作用。但中药逆转细菌耐药的机制尚没有权威的解释。我们通过本次的初步研究,认为蟾酥逆转细菌耐药的机制之一可能是抑制细菌耐药基因的转录,进而使耐药酶无法表达而丧失耐药性。为进一步深入研究中药制剂逆转细菌耐药研究提供新思路。
[1]朱德妹,汪复,胡付品,等.2010年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2011,11(5):321-329.
[2]胡付品,朱德妹,汪复,等.2011年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2012,12(5):321-329.
[3]胡付品,朱德妹,汪复,等.2013年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2014,14(5):365-374.
[4]马序竹,吕媛.鲍曼不动杆菌对主要抗菌药物耐药机制[J].中国临床药理学杂志,2009,25(1):90-94.
[5]Sievert DM,Ricks P,Edwards JR,et al.Antimicrobialresistant pathogens associated with healthcare-associated infections:summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention,2009-2010[J].Infect Control Hosp Epidemiol,2013,34(1):1-14.
[6]Arroyo LA,Mateos I,Gonez V,et al.In vitro activities of tigecycline,minocycline,and colistin igecycline combination against multi-and pandrug-resistant clinical isolates of Acinetobacter baumannii group[J].Antimicrob Agents Chemother,2009,53(3):1295-1296.
[7]曹翠萍,宁海强,位朋,等.中药与抗菌药物联用对大肠杆菌抑制作用的研究[J].西南农业学报,2008,21(1):217.
[8]李仲昆,林杉,李海蜀,等.双黄连粉针与4种抗生素伍用的体外最小抑菌浓度研究[J].中成药,1999,21(3):137.
[9]夏美玲,冯海英,刘野,等.中西药联合体外抑菌试验的研究[J].医学研究杂志,2010,39(10):100.
[10]黄瑞玉,穆小萍,柏彩英,等.连翘对多药耐药鲍曼不动杆菌主动外排泵编码基因adeB的影响[J].中国病原生物学杂志,2011,6(2):111.
[11]余道军,徐叶艳.蟾酥逆转大肠埃希菌耐药性的研究[J].中华中医药学刊,2010,28(5):1033-1034.
[12]任玲玲,关立增.连翘对大肠埃希菌多重耐药基因AcrA的影响研究[J].动物医学研究,2008,29(5):43-45.
[13]任玲玲,鞠玉琳,平家奇,等.中药复方制剂对大肠埃希菌多重耐药基因AcrA-mRNA表达水平的影响[J].湖北农业科学,2010,49(2):257-259.
[14]游思湘.中药抑制剂血清药理学研究及对相关基因影响[D]湖南农业大学,2011.
(收稿:2016-05-13 修回:2016-06-14)
1浙江中医药大学附属杭州第一医院检验科(杭州 310007);2浙江中医药大学基础医学院(杭州 310053)
王晓磊,Tel:18267112102;E-mail:32419641@qq.com
