口腔扁平苔藓病灶中Toll样受体4与TNF-α的表达*
2016-02-09王学莹宋典坤
王学莹,宋典坤
口腔扁平苔藓病灶中Toll样受体4与TNF-α的表达*
王学莹,宋典坤
目的 探讨TLR4、TNF-α在口腔扁平苔藓(OLP)发病中的可能作用。方法 采用免疫组化法检测OLP组与正常对照组口腔黏膜蜡块标本中TLR4、TNF-a的表达;采用qRT-PCR法检测TLR4的基因表达。结果OLP组中的TLR4、TNF-α蛋白及TLR4 mRNA表达均显著高于对照组 (P<0.05);TNF-α蛋白与TLR4蛋白表达呈正相关(P<0.05)。结论 OLP病灶部位TLR4 mRNA表达激活,TLR4、TNF-α表达增多,与OLP局部炎症和破坏的迁延不愈有关。
口腔扁平苔藓;Toll样受体4;肿瘤坏死因子α
口腔扁平苔藓(oral lichen planus,OLP)是一种慢性炎症性疾病,病因不清,一般认为是T细胞介导的免疫反应[1]。病理上表现为上皮下淋巴细胞带状浸润,侵犯上皮基底细胞层,引起角质形成细胞损伤。持续的T淋巴细胞浸润导致该炎性病变迁延不愈[2]。Toll样受体(Toll like receptors,TLRs)属于模式识别受体,在固有免疫和获得性免疫中发挥作用[3]。TLRs表达于多种免疫和非免疫细胞表面,识别诸如脂多糖、肽葡聚糖、脂蛋白等病原相关分子,启动和控制固有免疫反应。TLRs在许多慢性炎症性疾病的发病过程中发挥重要作用,但其在OLP中的作用仍不明确。本研究OLP患者口腔黏膜组织中TLR4的基因表达,TLR4、TNF-α蛋白的表达,探讨TLR4、TNF-α在OLP发生发展中的可能作用。
1 材料与方法
1.1 试剂与仪器兔抗人TLR4多克隆抗体(北京博奥森),兔抗人TNF-α多克隆抗体 (北京博奥森),小鼠超敏二步法免疫组化试剂盒pv-9002(北京中杉金桥生物技术公司),RNeasy FFPE Kit(QIAGEN,German),PrimeScript RT reagent Kit(TAKARA,Japen),SYBR Premix Ex TaqTMII(TAKARA,Japen),TLR4 (引 物 序 列 F-5’-CTGGAAATATGACCACAGTCAGAA-3’,R-5’-TCAATCACCCTAGACCTGCTCAA-3’),内参基因GAPDH(引物序列:F-5’-GCACCGTCAAGGCTG AGAAC-3’,R-5’-TGGTGAAGACGCCAGTGGA- 3’),Light Cycler○R480 system(Roche Diagnostics,瑞士)。
1.2 材料收集福建医科大学附属协和医院病理科2011年7月—2012年2月间病理诊断为OLP的蜡块标本30例(男9,女21),患者年龄22~65岁,平均(45.2±9.4)岁。其中颊黏膜20例,舌部黏膜8例,下唇黏膜1例,前庭沟黏膜1例,将30例OLP病损黏膜按病变类型分为两组:糜烂型(16例)和非糜烂型(14例)。另取10例正常口腔黏膜(NOM)作为对照组。
1.3 免疫组化法检测口腔黏膜组织TLR4及TNF-α蛋白的表达采用SP法进行免疫组化染色。TLR4抗体工作浓度1∶100,TNF-α抗体工作浓度1∶50,以PBS液代替一抗作为阴性对照。用二氨基联苯胺(DAB)显色试剂盒显色,苏木素轻度复染,系列乙醇脱水,二甲苯透明,封片,显微镜下观察免疫组化染色结果。判断标准:采用着色强度和阳性细胞率综合分析法。着色强度计分:按阳性细胞着色无、弱(淡黄)、中(棕黄)、强(棕褐)分别计0、1、2、3分;每例对象切片随机选取5个400倍视野观察,按阳性细胞占总细胞数的比例计分:0%~10%、11%~25%、26%~50%、51%~75%、>75%,分别计0、1、2、3、4分。按上述两项分数之和分级作为表达强度:0~1分为(-);2~3分为弱阳性(+);4~5分为中等阳性(++);6~7分为强阳性(+++)。
1.4 qRT-PCR法检测蜡块标本中TLR4的基因表达每个组织蜡块按RNeasy FFPE Kit说明书要求切片并提取总RNA,并测浓度和纯度。总RNA根据PrimeScriptTMRT reagent Kit要求步骤逆转录成cDNA。根据SYBR Premix Ex TaqTMII要求配置PCR反应液,应用LightCycler○ R480 system扩增仪进行PCR反应,内参基因GAPDH与待测基因同批扩增,根据扩增产物的Ct值,以2-ΔΔCt法计算目的基因相对表达量。
1.5 统计学分析SPSS 13.0统计软件进行数据分析。免疫组化表达结果采用等级资料成组Wilcoxon秩和检验,多组间的表达采用Kruskal-Wallis秩和检验。TLR4 mRNA的表达为计量资料,以±s表示,采用成组t检验,多组间均数比较采用单因素方差分析;相关关系采用Spearman相关检验,P≤0.05表示差异有统计学意义。
2 结果
2.1 TLR4、TNF-α免疫组化染色TLR4蛋白表达于细胞质和/或细胞核,呈黄色或棕黄色颗粒。在NOM组中,TLR4只表达与上皮基底层,表达强度明显弱于OLP组织,阳性率20%(2/10);在OLP组织中,TLR4表达强度由基底层、棘细胞层、颗粒层、角质层逐渐减弱,黏膜下层TLR4表达较上皮层减弱,表达于浸润的淋巴细胞,阳性率为90%(27/30),其中,糜烂型阳性率100%,非糜烂型78.6%。OLP组的TLR4蛋白表达强度显著高于对照组(P=0.000),糜烂型OLP组织TLR4表达强度阳性率显著高于非糜烂型OLP组织(P=0.005),见表1及图1。
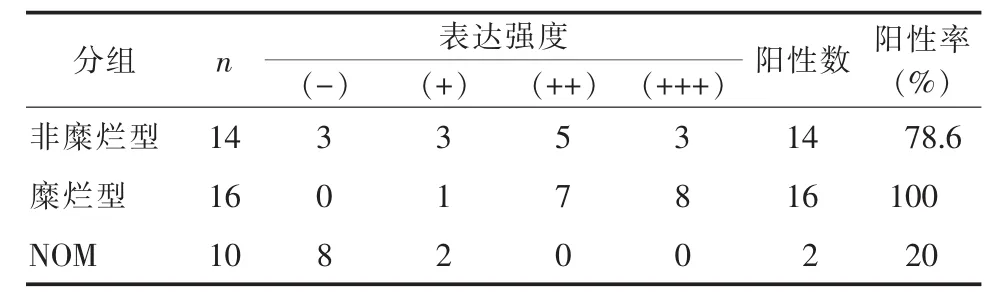
表1 TLR4免疫组化结果
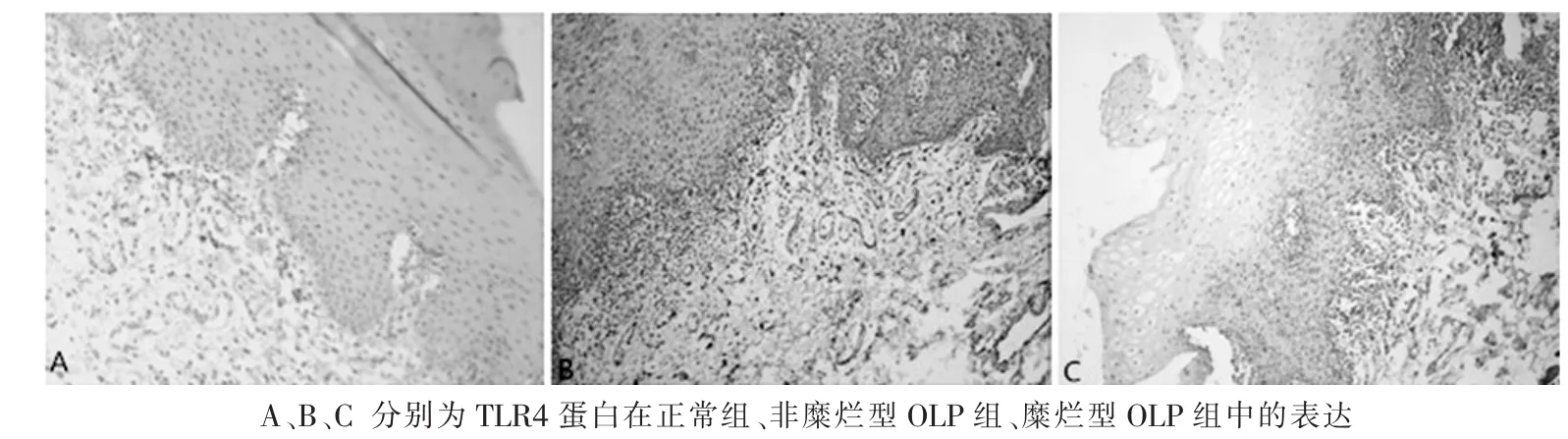
图1 TLR4蛋白在各组中的表达(×100)
TNF-α蛋白表达于口腔黏膜角质形成细胞和炎性浸润细胞,定位于细胞质,其在NOM组中上皮全层均有散在表达,阳性率20%(2/10);在OLP组中,TNF-α表达于上皮基底细胞层、棘层及浸润淋巴细胞的细胞质,阳性率为90%(27/30),其中,糜烂型阳性率100%,非糜烂型78.6%。OLP组的TNF-α蛋白表达强度显著高于对照组 (P=0.000),但两型之间则无显著性差异(P=0.229),见表2及图2。
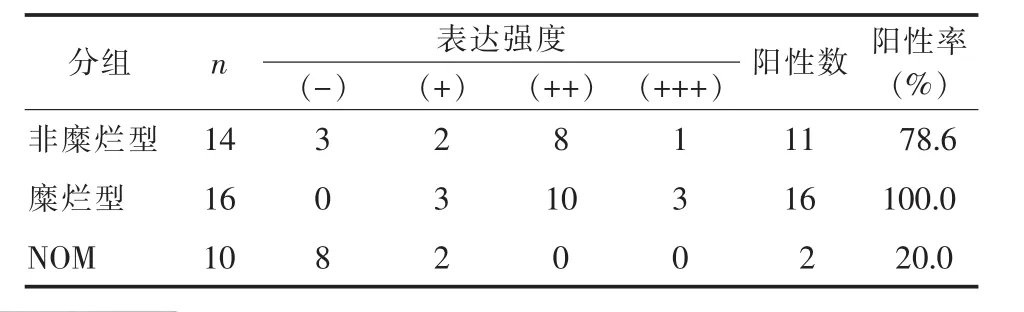
表2 TNF-α免疫组化结果

图2 TNF-α蛋白在各组中的表达(×100)
2.2 TLR4的mRNA表达经单因素方差分析,NOM组TLR4mRNA表达低于非糜烂型OLP组、糜烂型OLP组(P=0.000),差异有统计学意义;而经成组 t检验,OLP组中糜烂型和非糜烂型 TLR4 mRNA的表达无明显差异(P=0.153)。见图3。

图3 TLR4 mRNA在各组的表达
2.3 TLR4与TNF-α表达的相关分析经Spearman相关分析,TLR4蛋白表达与TLR4mRNA呈正相关(r=0.575,P=0.000),相关性一般;TLR4蛋白表达与TNF-α的表达显著正相关(r=0.836,P<0.05)。
3 讨论
目前,TLRs被认为参与自身免疫性疾病以及肺、肾、胃肠道、中枢神经系统疾病乃至癌症的发生发展,其介导的上皮免疫反应在结肠炎、牛皮癣、扁平苔藓、复发性阿弗他溃疡的等其他上皮的慢性炎症中起着重要作用[4,5]。TLRs能识别微生物的特异性分子结构,从而导致炎症因子和/或INF-I的增多。而不同的TLRs识别不同的微生物特异性分子结构,如本研究涉及的TLR4能识别革兰阴性菌LPS。口腔本身具有复杂的微生物环境,TLR4可表达于原代培养的牙龈上皮细胞、健康牙龈和牙周炎的牙龈上皮、结缔组织,其表达强度与炎症程度正相关[6,7]。正常情况下,口腔黏膜受到一系列模式识别受体所介导的精确调节反应保护,防止潜在威胁入侵。革兰阴性菌在OLP病灶部位显著增多[8],能识别LPS的TLR4表达也相应增多。Yana的研究发现OLP组织中,TLR4的免疫组化阳性率较正常组织显著增高[9],在LPS诱导建立的OLP细胞模型中,TLR4的基因和蛋白表达均明显增强。Siponen的研究也证实了,TLR4在OLP组织中表达显著增高,特别是在萎缩糜烂型中,基底层较中间层、表层及黏膜下炎症浸润层显著增高[10]。Janarhanam等除了证实了OLP病灶TLR4的高表达,还发现OLP患者口腔脱落上皮细胞TLR4 mRNA的表达较正常细胞增高[11]。同样,该研究OLP病灶中TLR4 mRNA表达增强,TLR4蛋白的表达较正常组明显增多,可见,TLR4通过识别病原分子,诱发一系列级联反应,导致OLP的发生。
TNF-α作为一种受NF-κB调控的细胞因子[12],能刺激血管内皮细胞、角质形成细胞产生黏附分子、趋化分子,引导T淋巴细胞从血管内游出,参与炎症反应。NF-κB信号通路的激活是TLR4调节免疫反应的关键环节[13]。许野等[14]通过实验发现在OLP病灶中TLR4与NF-κB p65的蛋白协同表达,提出TLR4通过对NF-κB p65的正向调节,参与OLP的病理过程。宋典坤等[15]的研究也发现NF-κB p65在OLP组中的表达明显高于NOM组,阳性染色定位于棘细胞、基底层细胞及固有层淋巴细胞的胞质和胞核,与本研究中TNF-α、TLR4阳性表达位置一致。综合上述研究及本研究结果可推测:OLP病灶部位增多的革兰阴性菌和脱落上皮激活了OLP部位TLR4 mRNA转录,TLR4蛋白相应表达增多,识别病原相关分子,与相应受体结合,启动和激活NF-κB通路,促进TNF-α表达增多,而TNF-α的大量表达产生,导致T淋巴细胞浸润基底层,而增多的T淋巴细胞又分泌TNF-α,导致黏膜局部炎症和破坏的发生和迁延不愈。
现有对OLP基因表达的研究多采用新鲜取材的标本,但活检并不是OLP诊断的必须手段,从而限制了这类研究的样本量。本研究探索性地以商品化的试剂盒提取既往的石蜡包埋组织蜡块中的RNA进行TLR4基因表达的研究,可测得总的mRNA表达量,为OLP的研究提供了新的方法。OLP由于病因不清,尚无有效的治疗方法。而本研究发现TLR4可能参与OLP发病的启动环节,对TLR4-NF-κB p65-TNF-α这一通路的监测和抑制,有望成为OLP诊断和治疗的新方向。
[1]Roopashree MR,Gondhalekar RV,Shashikanth MC,et al.Pathogenesis of oral lichen planus-a review[J].J Oral Pathol Med,2010,39(10):729-734.
[2]Sugerman PB,Savage NW,Walsh LJ,et al.The pathogenesis of oral lichen planus[J].Crit Rev Oral Biol Med,2002,13(4):350-65.
[3]Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010,11(5):373-384.
[4]Curry JL,Qin JZ,Bonish B,et al.Innate immune-related receptors in normal and psoriatic skin[J].Arch Pathol Lab Med,2003,127(2):178-186.
[5]Furrie E,Macfarlane S,Thomson G,et al.Toll-like receptors-2,-3 and-4 expression patterns on human colon and their regulation by mucosal-associated bacteria[J].Immunology,2005,115(4):565-574.
[6]Beklen A,Hukkanen M,Richardson R,et al.Immunohistochemical localization of Toll-like receptors 1-10 in periodontitis[J].Oral Microbiol Immunol,2008,239(5):425-431.
[7]Rojo-Botello NR,Garc1′a-Hernandez AL,Moreno-Fierros L.Expression of toll-like receptors 2,4 and 9 is increased in gingival tissue from patients with type 2 diabetes and chronic periodontitis[J].J Periodontal Res,2012,47(1):62-73.
[8]Bornstein MM,Hakimi B,Persson GR.Microbiological findings in subjects with asymptomatic oral lichen planus:a crosssectional comparative study[J].J Periodontol,2008,79(12):2347-2355.
[9]Yana Ge,Ye Xu,Wenjing Sun,et al.The molecular mechanisms of the effect of Dexamethasone and Cyclosporin A on TLR4/NF-κB signaling pathway activation in oral lichen planus[J]. Gene,2012,508(2):157-164.
[10]Siponen,Joonas HK,Ylermi Soini,et al.TLR4 and TLR9 are induced in oral lichen planus[J].Oral Pathol Med,2012,41(10):741-747.
[11]Janardhanam SB,Prakasam S,Swaminathan VT,et al.Differential expression of TLR-2 and TLR-4 in the epithelial cells in oral lichen planus[J].Archives of Oral Biology,2012,57(5):495-502.
[12]Rhodus NL,Cheng B,Bowles W,et al.A comparison of the proinflammatory,NF- kappaB-dependentcytokines:TNF-alpha,IL-1-alpha,IL-6,and IL-8 in different oral fluids from oral lichen planus patients[J].Clin Immunol,2005,114(3):278-283.
[13]Carmody RJ,Chen YH.Nuclear factor-kappa B:Activation and regulation during toll-like receptor signaling[J].Cell Mol Immunol,2007,4(1):31-41.
[14]许 野,夏现印,赵凌波,等.Toll样受体4及核因子-κBp65在口腔扁平苔藓中的表达及意义[J].实用口腔医学杂志,2013,29(2):231-235.
[15]宋典坤,关为群,王学莹,等.ALX-R和NF-κBp65在口腔扁平苔藓病灶中的表达研究[J].现代医药卫生,2005,31(20):3050-3055.
[2015-10-15收稿,2015-11-14修回]
[本文编辑:韩仲琪]
The expression of Toll like receptor 4 and TNF-α signal pathway in oral lichen planus lesion
WANG Xue-ying,SONG Dian-kun.
Fujian Medical University Union Hospital,Fuzhou,Fujian 350001,China
Objective To investigate the possible role of TLR4 and TNF-α in OLP.Methods Immunohistochemistry was used to detect the expression of TLR4,TNF-α in the oral mocusa of patients with OLP and normal oral mucosa (control group),respectively.Quantitative real-time PCR was used to detect the expression of mRNA of TLR4.ResultsThe IHC expression of TLR4,TNF-α in OLP was significantly stronger than those in control group(P<0.05),TLR4 mRNA expression did so.There was positive correlation between the expression of TNF-α and TLR4(P<0.05).ConclusionThe high expression and activation of TLR4 and increased expression of TNF-α may have some relation to long-lasting inflammation and destruction in the lesion of OLP.
Oral lichen planus(OLP);Toll like receptor 4;Tumor necrosis factor-α
R781.31
A
10.14172/j.issn1671-4008.2016.04.019
福建省自然科学基金面上项目(2013J01314)
350001福建福州,福建医科大学附属协和医院(王学莹,宋典坤)
