含硼替佐米的BDT、BCD、BAD化疗方案治疗初诊性多发性骨髓瘤
2016-02-09董月华徐风华赵丽君
董月华,徐风华,赵丽君
含硼替佐米的BDT、BCD、BAD化疗方案治疗初诊性多发性骨髓瘤
董月华,徐风华,赵丽君
目的研究分析硼替佐米为主的联合化疗方案BDT、BCD、BAD治疗初诊性多发性骨髓瘤的整体临床效果及不良反应。方法回顾性分析笔者所在医院2011年1月—2015年6月收治的初诊性多发性骨髓瘤患者210例,分别行BDT方案化疗(B1组)92例,BCD方案化疗(B2组)89例,BAD方案化疗(B3组)29例。结果联合化疗方案中,B1组治疗后有效率为80.43%,B2组治疗后有效率为86.52%,B3组治疗后有效率为93.11%,三组比较,B3组治疗后有效率略高于B2组和B1组的治疗后有效率 (P=0.0145);B2组治疗后有效率略高于B1组 (P=0.0386);化疗后各组的不良反应发生情况比较,粒细胞降低中B1组发生率小于B2组(P=0.0392),B2组小于B3组(P=0.117);血小板降低中,B2组发生率明显高于B3组(P=0.046),B3组发生率明显高于B1组(P=0.029);疲乏患者中,B3组发生率明显高于B2组(P=0.028),而B2组与B1组间无显著差异(P=0.938);病毒疱疹中,B1组发生率明显高于B2组(P=0.006)和B3组(P=0.018),而B3组发生率明显高于B2组(P=0.033),比较差异具有统计学意义;贫血、感染、腹泻、腹水并发症发生情况中,三组间无显著差异,比较无统计学意义(P>0.05)。结论以硼替佐米(万珂)为主的联合化疗方案BDT、BCD、BAD治疗初诊多发性骨髓瘤均可取得较好的临床疗效,尤其以BAD的联合用药有效率最高。但是由于该研究的病例尚数量不足,何种方案最优还需进一步研究,对于临床医师的选择应用还需其根据患者的具体情况进行制定。
多发性骨髓瘤;硼替佐米;联合化疗方案
目前多发性骨髓瘤 (multiple myeloma,MM)在血液系统肿瘤的发生率可达12%,其为单克隆浆细胞增生性肿瘤[1]。随着医学研究的不断深入,以往化疗方案无法满足临床医师的要求及患者的期望。硼替佐米的作用主要是将细胞内控制细胞凋亡和传导信号的蛋白质阻断降解,最终是肿瘤细胞凋亡,临床应用已取得较好的疗效[2]。该研究参照以往临床研究,通过对笔者所在医院2011年1月—2015年6月初诊性多发性骨髓瘤患者210例MM患者进行研究,回顾性分析三种硼替佐米为主的联合化疗方案治疗初诊性多发性骨髓瘤的综合治疗效果,现报告如下。
1 资料与方法
1.1 一般资料纳入标准:(1)所有患者均为初诊性多发性骨髓瘤;(2)以往未行相关化疗治疗;(3)均需行及时的化疗治疗,且具有有效的血、尿从蛋白标本已进行相关指标评估;(4)化疗方案均为硼替佐米为基础;(5)多发性骨髓瘤根据WHO标准进行诊断;(6)所有患者均行D-S(Durie-Salmon)和ISS(International Staging System)分期;(7)均无肾功能不全者。回顾性分析笔者所在医院2011年1月—2015年6月收治的初诊性多发性骨髓瘤患者210例;其中男134例,女76例;年龄41~76岁,平均(62.17±5.06)岁;Lg分型中,LgA 61例,LgG 124例,LgD 25例;初诊时D-S分期中,Ⅰ期36例,Ⅱ其69例,Ⅲ期105例;ISS分期中,Ⅰ期40例,Ⅱ其79例,Ⅲ期91例。210例患者中,行BDT方案化疗(B1组)92例,BCD方案化疗(B2组)89例,BAD方案化疗(B3组)29例。所有患者及家属均自愿参加该次研究并已签署知情同意书,该院医学伦理委员会已批准该研究内容并对全程进行监督。
1.2 治疗方法BDT方案化疗中,于治疗的1、4、8、11 d静脉注射1.2 mg/m2的硼替佐米,于治疗的1、2、3、4 d静脉滴注20 mg/d地塞米松,化疗间口服应用80 mg/d沙利度胺;BCD方案化疗中,于治疗的1、4、8、11 d静脉注射1.2 mg/m2的硼替佐米,于治疗的1、2、3、4 d静脉滴注140 mg/m2环磷酰胺,于治疗的1、2、3、4 d静脉滴注20 mg/d地塞米松;BAD方案化疗中,于治疗的1、4、8、11 d静脉注射1.2 mg/m2的硼替佐米,于治疗的1、2、3、4 d静脉滴注20 mg/d地塞米松,于治疗的1、2、3、4 d静脉滴注阿霉素15 mg/m2,所有患者均行2~4个疗程治疗。
1.3 观察指标根据国际MNI工作组的肿瘤治疗后临床效果评估标准[3],分为完全缓解(complete remission,CR),很好的部分缓解(very good partial response,VGPR),部分缓解(partial response,PR),疾病稳定(stable disease,SD),疾病进展(progressive disease,PD)。有效率为完全缓解例数+很好的部分缓解例数+部分缓解例数/整体例数×100%。无进展生存期(PFS)为患者从起始治疗至病情进一步发展的时间;总体生存期(OS)为患者从起始治疗至死亡或随访停止时间[4]。
1.4 统计学分析采用SPSS 20.0软件进行分析。患者临床特征、临床效果的组间比较采用Pearson χ2检验进行比较,采用Kaplan Meie生存函数对患者生存资料进行分析,采用log-rank法行组间生存数据比较。
2 结果
2.1 三组多发性骨髓瘤一般资料见表1。
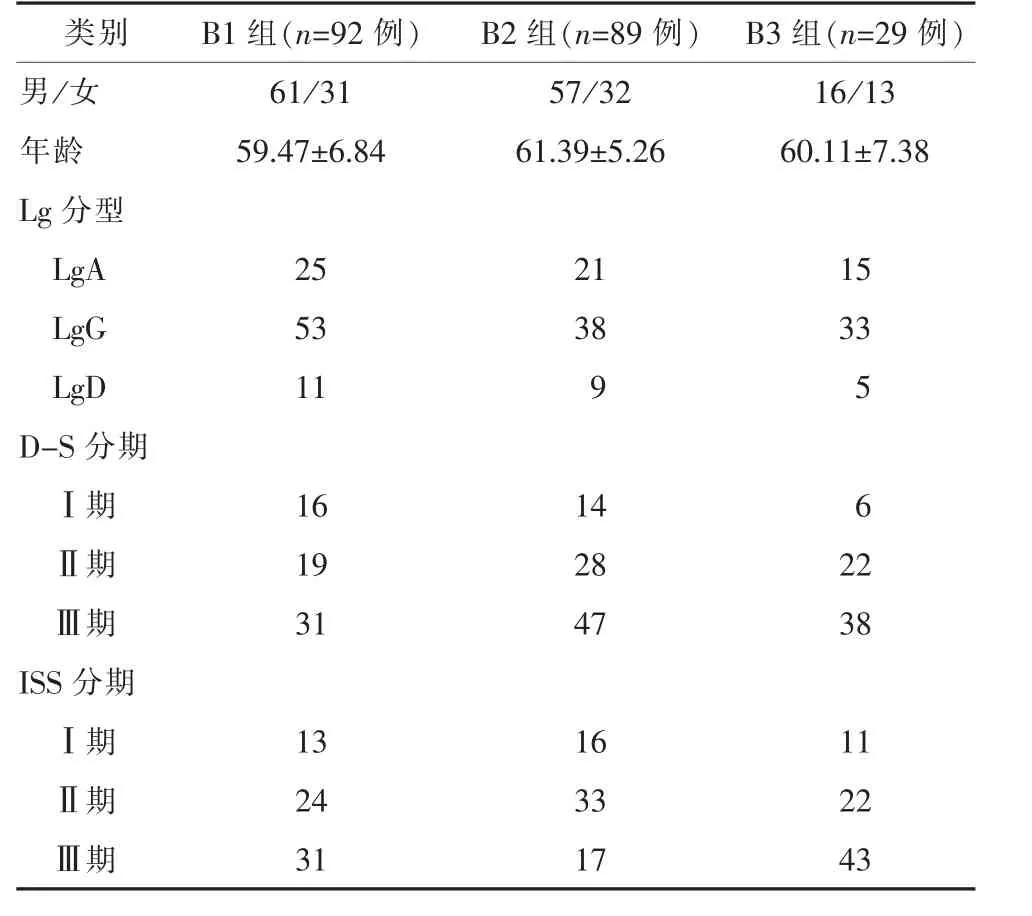
表1 三组多发性骨髓瘤一般资料
2.2 三组患者治疗后临床疗效评估比较研究表明,联合化疗方案中,B1组治疗后有效率为80.43%,B2组治疗后有效率为86.52%,B3组治疗后有效率为93.11%,三组比较,B3组治疗后有效率略高于B2组和B1组的治疗后有效率(P=0.0145);B2组治疗后有效率略高于B1组(P=0.0386),见表2。
2.3 三组患者各临床指标及基数资料与PFS、OS的相关性210例患者中,≥60岁患者的PFS明显低于<60岁患者 (P=0.0295),≥60岁患者的OS明显低于<60岁患者(P=0.0017),证明了低年龄患者的PFS、OS明显优于高年龄患者;血清白蛋白指标比较,≥35 g/L患者的PFS显著多于<35 g/L患者(P=0.0384);β2微球蛋白比较中,<3500 μg/L患者PFS明显高于3500~5000 μg/L患者(P=0.0096),而3500~5000 μg/L的患者PFS略高于>5000 μg/L的患者(P=0.0228),比较具有统计学意义;在不同D-S分期和ISS分期情况下,PFS也有所不同,D-S分期中,Ⅰ期患者的PFS显著小于Ⅱ期患者 (P=0.0176),而Ⅱ期患者的PFS显著大于Ⅲ期患者(P=0.0426),Ⅰ期、Ⅲ期患者的PFS无显著差异,比较无统计学意义(P>0.05);ISS分期中,Ⅰ期患者的PFS显著高于Ⅱ期患者(P=0.0205),而Ⅱ期患者的PFS明显小于Ⅲ期患者(P=0.0329),Ⅰ期、Ⅲ期患者的PFS无显著差异,比较无统计学意义(P>0.05);骨髓原始浆细胞比率比较,≥10%患者的PFS显著低于<10%患者(P=0.0191);血红蛋白比较,≥90 g/L患者的PFS显著高于<90 g/L患者(P=0.0314);乳酸脱氢酶水平比较,≥250 U/L患者的PFS明显低于<250 U/L的患者(P=0.0097)。见表3。

表2 三组患者治疗后临床疗效评估比较
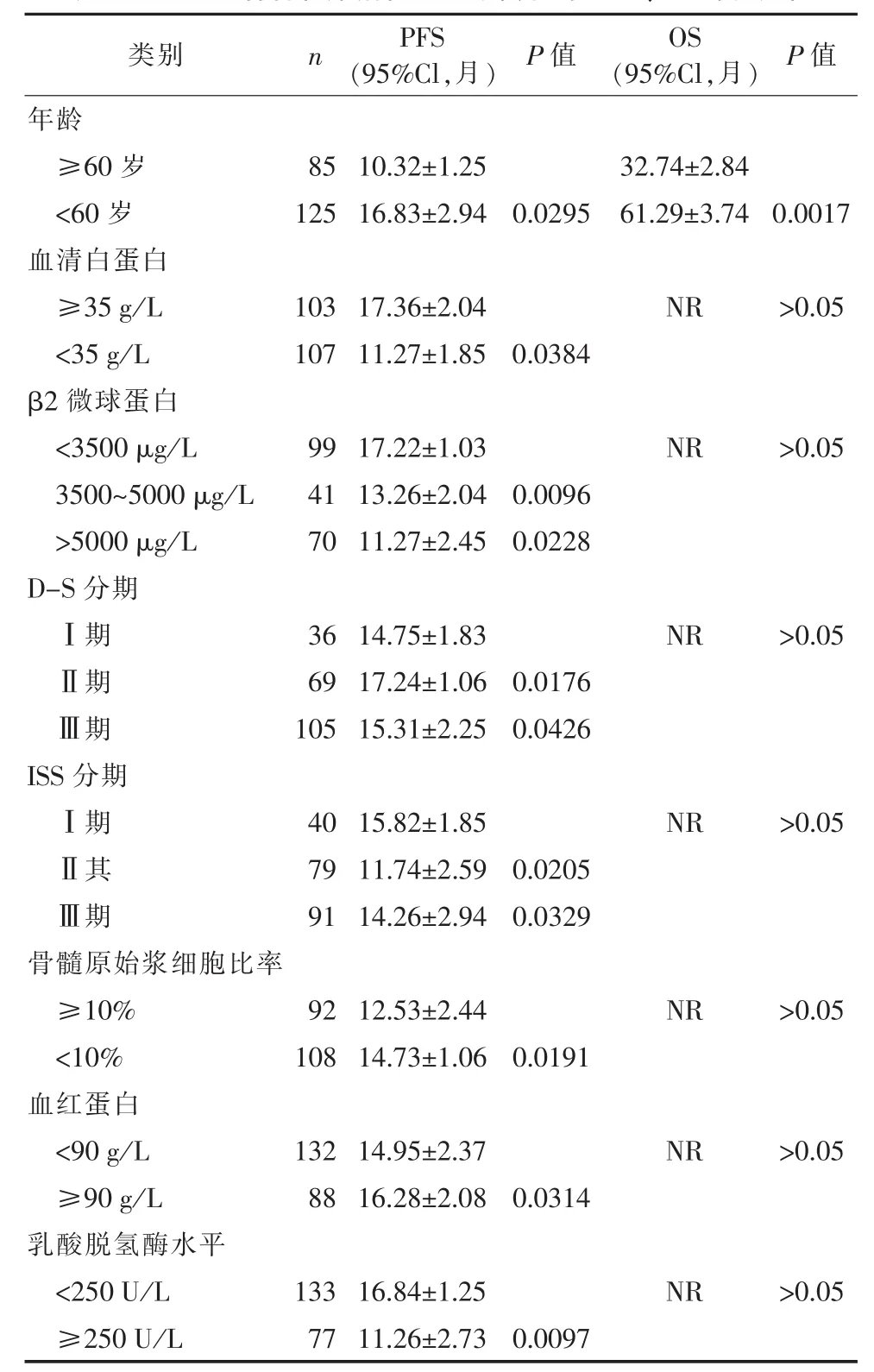
表3 三组患者各临床指标及基数资料与PFS、OS的相关性
2.4 化疗后各组的不良反应发生情况比较粒细胞降低中B1组发生率小于B2组 (P=0.0392),B2组小于B3组(P=0.117);血小板降低情况中,B2组发生率明显高于B3组(P=0.046),B3组发生率明显高于B1组(P=0.029);疲乏患者中,B3组发生率明显高于B2组(P=0.028),而B2组与B1组间无显著差异(P=0.938);病毒疱疹中,B1组发生率明显高于B2组(P=0.006)和B3组(P=0.018),而B3组发生率明显高于B2组(P=0.033),比较差异具有统计学意义;贫血、感染、腹泻、腹水并发症发生情况中,三组间无显著差异,比较无统计学意义(P>0.05),见表4。
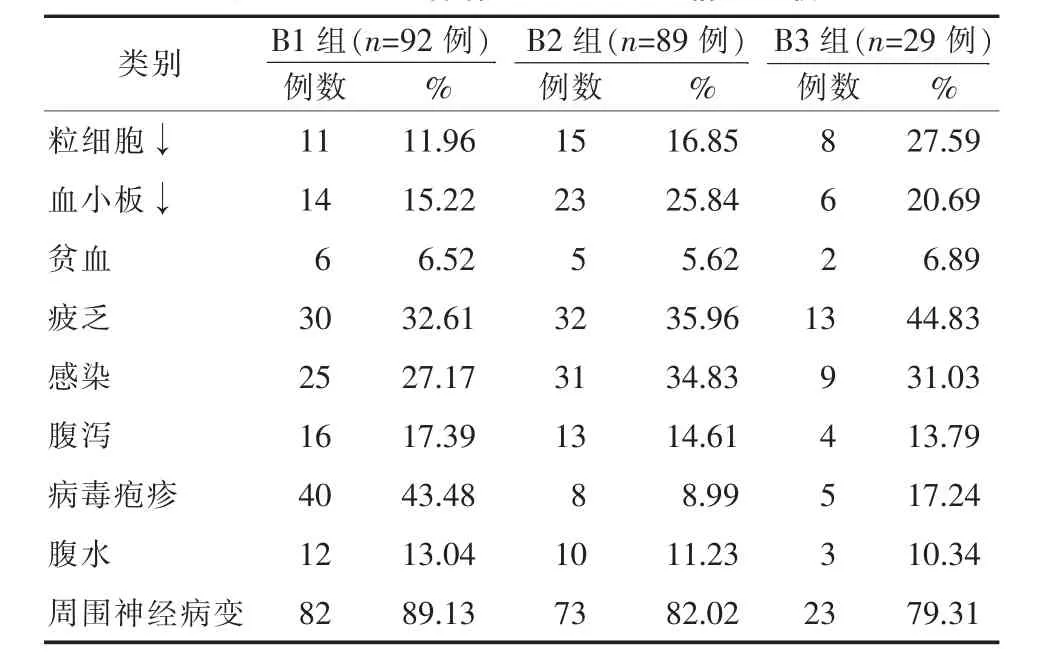
表4 三组患者治疗后不良反应情况比较
3 讨论
多发性骨髓瘤是临床上较为常见的恶性肿瘤,其治疗后的症状缓解程度与患者的生活质量、生存时间之间紧密相连[5]。硼替佐米(万珂)的作用主要是将细胞内控制细胞凋亡和传导信号的蛋白质阻断降解,最终是肿瘤细胞凋亡,降低或抑制血管新生细胞因子表达,阻碍肿瘤细胞和其基质互相附着,疗效显著,不良反应较其他同类药物更少[6]。
沙利度胺作为谷氨酸衍生物的镇静药和止痛药,可用于抗肿瘤、血液系统疾病的治疗。可以刺激血管生成的主要为血管内皮生长和成纤维细胞因子,其特异性受体可以和刺激信号结合转化传导,导致内皮细胞增多[7]。沙利度胺可以减少成纤维细胞和血管内皮生长因子分泌,导致血管生成收到抑制。有研究表明[8],沙利度胺除了对血管生成具有抑制作用外,还可使整合素亚基减少合成,也是此药比较重要的抗肿瘤机制。
环磷酰胺对恶性淋巴瘤、多发性骨髓瘤具有较好的临床效果。药物在人体内通过肝、肿瘤内的磷酰胺酶或磷酸酶水解,使之成为活化型磷酰胺氮芥,其作用和氮芥相似,可以达到DNA的合成抑制作用,属细胞周期非特异性药物。阿霉素是抗肿瘤抗生素药物,其可对DNA、RNA的合成起到抑制,对RNA抑制作用最强,对临床较多肿瘤均有一定的作用,同样也属于周期非特异性药物[9]。
以上药物在临床上治疗肿瘤已得到广泛使用,其作用机制与硼替佐米并不相同,因此该研究在硼替佐米和地塞米松联合应用的基础上,加入环磷酰胺和阿霉素,分别组成BDT(硼替佐米、地塞米松、沙利度胺)、BCD(硼替佐米、地塞米松、环磷酰胺)、BAD(硼替佐米、地塞米松、阿霉素)化疗方案,本研究采用三种化疗方案对210例初诊行多发性骨髓瘤患者进行治疗,其中BDT组治疗后有效率为80.43%,BCD组治疗后有效率为86.52%,BAD组治疗后有效率为93.11%,三组比较,BAD组治疗后有效率略高于BCD组和BDT组的治疗后有效率 (P=0.0145);而BCD组治疗后有效率略高于BDT组(P=0.0386)。
该研究认为,多发性骨髓瘤患者治疗后恢复期情况主要与年龄、血清白蛋白、β2微球蛋白、D-S分期、ISS分期、骨髓原始浆细胞比率等有关。210例患者中,≥60岁患者的PFS明显低于<60岁患者 (P=0.0295),≥60岁患者的 OS明显低于<60岁患者(P=0.0017),证明了低年龄患者的PFS、OS明显优于高年龄患者;血清白蛋白≥35 g/L、β2微球蛋白<3500 μg/L、骨髓原始浆细胞比率<10%、血红蛋白≥90 g/L、乳酸脱氢酶<250 U/L患者均具有较长的PFS。D-S分期中,Ⅱ期患者的PFS最长,Ⅰ期、Ⅲ期患者PFS无显著差异,比较无统计学意义 (P>0.05);ISS分期中,Ⅰ期、Ⅲ期患者的PFS相对较长,Ⅱ期PFS有所缩短。
不良反应是化疗后经常出现的问题,该研究结果显示不同联合药物所出现的不良反应发生率也有所不同,粒细胞降低发生率中,BDT组<BCD组<BAD组;血小板降低发生率中,BCD组>BAD组>BDT组;疲乏患者中,BAD组>BCD组,BDT组与BCD组间无显著差异(P=0.938);病毒疱疹发生率中,BDT组>BAD组>BCD组,比较差异具有统计学意义;而贫血、感染、腹泻、腹水并发症发生情况中,三组间无显著差异。值得注意的是,各种联合治疗方案治疗后的周围神经病变均较高,有研究表明[10,11]硼替佐米(万珂)的主要不良反应为周围神经病,在使用此药物时,需监测患者神经病表现,如感觉过敏、减退、异常、不适感或神经痛。如果患者出现新的周围神经病或其症状加重,则需对治疗方案进行调整。
综上所述,以硼替佐米为主的联合化疗方案BDT、BCD、BAD治疗初诊多发性骨髓瘤均可取得较好的临床疗效,尤其以BAD的联合用药有效率最高。但是由于该研究的病例尚数量不足,何种方案最优还需进一步研究,对于临床医师的选择应用还需其根据患者的具体情况进行制定。对不良反应方面,该研究认为应尽量避免与其他具有神经毒性药物同阶段应用。
[1]徐 源.DC-CIK治疗难治性多发性骨髓瘤的临床研究[J].实用癌症杂志,2015,30(3):454-456.
[2]庄 韵,沈 群.多发性骨髓瘤维持治疗的最新进展[J].中国实验血液学杂志,2015,23(1):250-254.
[3]中国多发性骨髓瘤工作组.中国多发性骨髓瘤诊治指南2011年修订[J].中华内科杂志,2011,50(10):892-896.
[4]钟国成,颜 斌,孙 薏,等.DC-CIK过继免疫联合化疗治疗多发性骨髓瘤的疗效分析[J].中华血液学杂志,2012,33(12):1000-1003.
[5]周仲昊,王 智.蛋白酶体抑制剂治疗多发性骨髓瘤临床观察[J].中华全科医学,2012,11(3):1739-1740.
[6]梁赜隐,任汉云,岑溪南,等.硼替佐米为基础的化疗方案治疗多发性骨髓瘤患者的疗效及预后因素分析[J].中华血液学杂志,2014,35(3):225-230.
[7]Attal M,Lauwers-Cances V,Marit G,et al.Lenalidomide maintenance after stem-cell transplantation for multiple myeloma[J].N Engl J Med,2012,366(19):1782-1791.
[8]陈 飞,王玉娟,张克俭,等.硼替佐米联合地塞米松及沙利度胺治疗多发性骨髓瘤临床观察[J].临床血液学杂志,2011,24(3):176-177.
[9]徐淑芬,白 海,王存邦,等.硼替佐米为主方案与常规化疗方案治疗多发性骨髓瘤疗效比较[J].现代肿瘤医学,2015,23(11):1585-1588.
[10]徐丽丽,邱慧颖,胡晓霞,等.含硼替佐米的联合化疗方案治疗初诊多发性骨髓瘤患者的疗效比较[J].中华血液学杂志,2014,35(5):448-450.
[11]黄晓晖.硼替佐米及沙利度胺联合VAD方案治疗难治复发性多发性骨髓瘤疗效观察[J].临床血液学杂志,2010,23(1):36-37.
[2015-10-16收稿,2015-11-14修回]
[本文编辑:董冰媛]
Contained-bortezomib BDT,BCD or BAD chemotherapy for newly diagnosed multiple myeloma
DONG Yue-hua,XV Feng-hua,ZHAO Li-jun.
The First Internal Medicine Dept.of Beijing General Troop's Hospital of Armed Police,Beijing 100027,China
ObjectiveTo investigate the overall clinical efficacy and adverse reaction of BDT,BCD or BAD combination chemotherapy based on bortezomib for patients with newly diagnosed multiple myeloma.Methods The 210 patients with newly diagnosed multiple myeloma treated in author's hospital from January 2011 to June 2015 were retrospectively analyzed.Among them,92 cases received BDT chemotherapy(B1 group),89 cases received BCD chemotherapy(B2 group)and 20 cases received BAD chemotherapy(B3 group).Results In combination chemotherapy,the effective rate after treatment was 80.43%in B1 group,86.52%in B2 group and 93.11%in B3 group respectively.Among these three groups,the effective rate after treatment was slightly higher in B3 group than that of B2 and B1 group(P=0.0145);In addition,the effective rate after treatment was slightly higher in B2 group than that of B1 group(P=0.0392);Through comparing incidences of adverse effects in different groups,the incidence of reducing granulocyte in B1 group was lower than that of B2 group(P=0.0392)and B2 group was lower than B3 group(P=0.117);There was significantly higher incidence of reducing platelet in B2 group than that of B3 group(P=0.046),and B3 group was significantly higher than B1 group(P=0.029);B3 group had higher incidence of fatigue than that of B2 group(P=0.028),however,there was no significant difference between B2 and B1 group(P=0.938);The incidence of herpes was significantly higher in B1 group than that of B2 group(P=0.006)and B3 group(P=0.018),and B3 group was significantly higher than B2 group(P=0.033),with a statistically significant difference.There were no significant differences in the incidence of complications such as anemia,infection,diarrhea and ascites between three groups,without a statistically significant difference(P>0.05).ConclusionsAll the BDT,BCD or BAD combination chemotherapy based on bortezomib for patients with newly diagnosed multiple myeloma can achieve good clinical efficacy,among them,BAD is especially the most effective therapy.However,as for the limited number of cases included in this study,further studies are needed to decide which therapy is the best.Thus,for practical choice in clinic,it should be based on specific conditions.
Multiple myeloma;Bortezomib;Combination chemotherapy
R733.3
A
10.14172/j.issn1671-4008.2016.04.005
100027北京,武警北京总队医院内一科(董月华,徐风华,赵丽君)
