大孔树脂对甘草渣总黄酮吸附分离特性及工艺研究
2016-02-09袁茹楠胡浩斌韩舜禹王宗博
袁茹楠,胡浩斌,2,*,韩舜禹,王宗博
(1.甘肃农业大学 食品科学与工程学院,甘肃兰州 730070;2.陇东学院 化学化工学院,甘肃庆阳 745000;3.庆阳市中凯农产品有限责任公司,甘肃庆阳 745000)
大孔树脂对甘草渣总黄酮吸附分离特性及工艺研究
袁茹楠1,胡浩斌1,2,*,韩舜禹1,王宗博3
(1.甘肃农业大学 食品科学与工程学院,甘肃兰州 730070;2.陇东学院 化学化工学院,甘肃庆阳 745000;3.庆阳市中凯农产品有限责任公司,甘肃庆阳 745000)
探讨了大孔吸附树脂富集甘草渣中总黄酮的吸附分离特性并确定纯化工艺。通过对5种树脂进行静态吸附解吸实验,筛选出适宜的大孔树脂(AB-8和SP825)对其热力学、动力学特性进行考察,并优化分离纯化工艺条件。动力学研究表明,拟二级动力学模型能很好的描述2种大孔树脂(AB-8和SP825)的整个吸附过程。热力学研究表明,2种树脂对甘草渣总黄酮的吸附符合Freundlich等温吸附方程,吸附过程是放热的,而且是物理吸附的过程。AB-8大孔树脂对甘草渣总黄酮的最佳分离纯化工艺为:甘草渣提取液上样浓度1.089 mg/mL,上样体积2 BV,上样流速3 mL/min,之后用3 BV 80%乙醇洗脱,洗脱流速1.5 mL/min,此时解吸率达91.67%,此条件纯化后总黄酮的纯度提高到53.43%。AB-8大孔树脂用于甘草渣总黄酮的纯化效果最佳。
大孔吸附树脂,甘草渣,总黄酮,吸附特性,纯化
甘草(Glycyrrhiza)又名甜草根、灵通、国老等,豆科蝶形花亚科甘草属多年生草本植物[1],也是近年来国内外重点开发的“食药同源”植物。甘草中主要有效成分是甘草酸和黄酮类化合物[2]。甘草黄酮具有抑菌、抑酶、抗肿瘤、抗HIV、抗心律失常、抗氧化、保肝等多种药理功能[3-7],可广泛应用于食品、药品、化妆品等领域。长期以来,工业化生产着重提取甘草中的甘草酸为主要药效成分[8],将提取后的残渣废弃。研究表明[9-10],残渣富含大量黄酮类化合物,其结构与甘草中的黄酮类化合物基本相同,这造成甘草资源的极大浪费。因此,合理、有效的开发甘草资源,对甘草资源进行深加工和综合利用就显得十分重要[10]。
大孔吸附树脂是近年来发展的一类有机高聚物吸附剂,是结合了吸附性与筛选性的多孔材料。由于其不溶于酸碱、稳定性强、比表面积大、吸附解吸容易、可重复利用、寿命长等优点[11-12],近年来广泛应用于中药材有效成分的纯化分离[13]。本文比较5种不同类型的树脂,通过对甘草渣总黄酮的静态吸附解吸实验选择适宜的树脂,探究了2种较优树脂的吸附解吸条件,建立热力学和动力学模型。此外,优化AB-8大孔树脂纯化工艺条件,为甘草渣总黄酮的提取分离提供技术参数,也促进了甘草资源的有效利用。
1 材料与方法
1.1 材料与仪器
甘草渣 由庆阳市中凯农产品有限责任公司提供。经除杂、晾干后用粉碎机粉碎过60目筛,备用;芦丁标准品购自中国药品生物制品研究所。AB-8、S-8和D4020大孔树脂 山东西亚化学工业有限公司,SP825和XAD-16大孔树脂 郑州勤实科技有限公司。
氢氧化钾、无水乙醇、氢氧化钠等 分析纯,西安化学试剂厂。
NJL07-5型实验室超声微波炉 南京杰全微波设备有限公司;7230G型可见分光光度计 上海精密科学仪器有限公司;CHA-S气浴恒温振荡器 江苏省金坛市医疗仪器厂;RE-5203型旋转蒸发器 上海亚荣生化仪器厂;FZ102型微型植物试样粉碎机 北京中兴伟业仪器有限公司;SHZ-D型循环水式真空泵 河南省巩义市英峪仪器一厂;BS110S型电子天平 北京赛多利斯天平有限公司;DZF-6020型真空干燥箱 上海一恒科技有限公司。
1.2 实验方法
1.2.1 样品溶液的提取 精确称取6.0 g烘干的甘草渣粉(60目),置于500 mL烧杯中,加入300 mL 80%乙醇水溶液,超声-微波协同提取30 min,过滤,滤渣再加入200 mL 80%乙醇水溶液提取1次,合并2次提取液。在0.05 MPa、65 ℃旋转蒸发1 h回收乙醇,得到甘草渣总黄酮浸膏,阴凉避光处常温晾干备用。
1.2.2 总黄酮的含量 取矢量甘草总黄酮浸膏用乙醇溶解,并配成一定浓度的溶液备用。准确吸取1.0 mL提取液,置于10 mL的容量瓶,加入0.5 mL的KOH溶液作为显色剂,室温放置5 min,用80%的乙醇定容,摇匀。在最大吸收峰409 nm处测定吸光度。确定总黄酮的含量。
1.2.3 树脂的筛选 将5种大孔树脂(AB-8、SP825、XAD-16、S-8和D4020)用无水乙醇浸泡24 h,之后用去离子水洗至完全无醇味,用5%的NaOH(m/m)浸泡6 h,用去离子水洗至滤液近中性,之后用5%的HCl(v/v)浸泡6 h,之后用去离子水洗至滤液近中性[14]。
1.2.4 树脂对总黄酮的静态吸附率与解吸率测定
1.2.4.1 树脂静态吸附量测定 准确称取2.0 g经预处理过的树脂,装入带磨口塞的三角瓶中,准确加入过量(约30 mL)已知浓度的甘草渣总黄酮样品溶液。振荡24 h,转速150 r/min,温度30 ℃,过滤,测定滤液中剩余总黄酮浓度C2(mg/mL),做3个平行,按下式计算吸附率(%)和吸附量(mg/mL):
式中:E:吸附率(%);C:吸附前溶液浓度(mg/mL);C2:吸附后溶液浓度(mg/mL);Q:吸附量(mg/mL);V1:溶液体积(mL);W:树脂体积(g)。
1.2.4.2 树脂静态解吸率测定 吸附饱和的树脂,加入质量分数80%乙醇浸泡振摇24 h,过滤,测定滤液中甘草渣总黄酮浓度C1(mg/mL),按下式计算解吸率。
式中:P:解吸率(%);C1:流出液的浓度(mg/mL);V2:洗脱液体积(mL)。
1.2.5 树脂静态吸附解吸实验
1.2.5.1 大孔树脂对甘草渣总黄酮的吸附动力学实验 精密称取已预处理的树脂(AB-8和SP825)约2.0 g,置于不同的锥形瓶内,加入已知浓度的甘草渣总黄酮的粗提液。将锥形瓶用塞子密封,置于恒温振荡器。整个吸附过程温度为30 ℃,转速为150 r/min持续1440 min。分别在2、4、6、8、10、15、20、25、30、40、50、60、120、180、240、360、480、720、1440 min时取出1 mL提取液,测定每个样品中总黄酮的含量并且分别建立每种树脂的动力学方程。
1.2.5.2 大孔树脂对甘草渣总黄酮的吸附热力学实验 精确称取2种大孔树脂各2.0 g,分别转移至5个100 mL的锥形瓶中,每个锥形瓶的树脂用不同浓度(0.0070、0.0158、0.0299、0.0536、0.0932 mg/mL)的总黄酮提取液(30 mL)浸泡,在不同的温度(分别为25、35、45、55 ℃)分别进行恒温振荡,转速为150 r/min。吸附时间由吸附动力学决定。上清液中即为总黄酮的含量。根据此建立吸附热力学方程。
1.2.5.3 大孔树脂对甘草渣总黄酮的解吸实验 称取6份一定量的树脂,以动力学和热力学得到的最佳条件充分吸附。将溶液移除,残渣保留在烧杯内,此时达到吸附平衡。用不同浓度的乙醇水溶液(0%、20%、40%、60%、80%和100%)与上述吸附平衡的6组大孔树脂混合。将所有的锥形瓶置于恒温振荡器上,45 ℃,150 r/min振荡120 min。之后按顺序提取1 mL溶液测定其解析率。
表1 5种树脂的吸附率及解吸率
Table 1 The adsorption and desorption rate of the five macroporous resins to total flavones from Glycyrrhiza residues
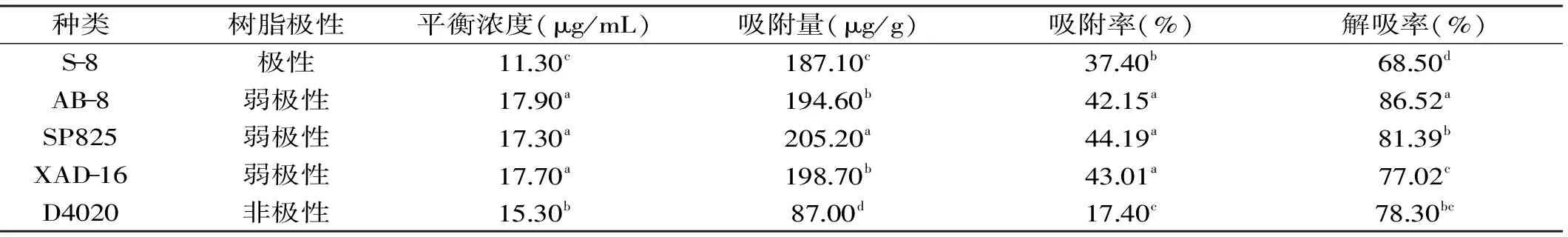
种类树脂极性平衡浓度(μg/mL)吸附量(μg/g)吸附率(%)解吸率(%)S-8极性1130c18710c3740b6850dAB-8弱极性1790a19460b4215a8652aSP825弱极性1730a20520a4419a8139bXAD-16弱极性1770a19870b4301a7702cD4020非极性1530b8700d1740c7830bc
注:同一列数字后的不同小写字母表示在0.05水平上差异显著,图2、图3、图5~图9同。
称取一定量树脂,适宜温度吸附最佳时间,用80%的乙醇解吸。置于恒温振荡器中,调节不同温度25、35、45、55 ℃,150 r/min振荡120 min。即得出树脂的解析率和最佳解吸温度。
1.2.6 实验中所用到的方程
拟一级动力学模型[15]ln(qe-qt)=-k1t+lnqe
粒子扩散动力学模型qt=kd×t1/2+c
式中:qt,qe,qm分别代表在t时,吸附平衡时,梯度洗脱最大时树脂对总黄酮吸附量(mg/g干树脂);Ce:吸附平衡时总黄酮的浓度(mg/mL);C:粒子扩散动力学模型的常数;K1,K2,Kd分别代表吸附过程中拟一级,拟二级,粒子扩散方程中的常量;KL:树脂与黄酮的相关系数(mL/mg);KF:树脂的吸附量;1/n:树脂的吸附强度;R:通用气体常数(8.314 J/mol·K);T:吸附温度(K);A:为常数。
1.2.7 树脂动态吸附分离甘草渣总黄酮工艺参数考察 通过树脂对甘草渣总黄酮的静态吸附实验,筛选出一种最佳的树脂。对其进行上样液浓度、上样流速、洗脱剂的浓度和洗脱流速等工艺参数的考察。将预处理好的树脂,湿法装入玻璃柱中。柱床体积为16 mL。将一定浓度甘草渣总黄酮的粗体液上样,上样体积为2 BV[17],控制流速。之后用不同浓度的乙醇进行洗脱,控制流速。最后分别测定吸附率和解吸率。
1.2.8 纯度的测定 总黄酮粗体液经过上述最佳工艺纯化,收集洗脱液在0.05 MPa、65 ℃旋转蒸发1 h回收乙醇,阴凉避光处晾干。精确称取0.2 g纯化后干燥的总黄酮粉末,用80%的乙醇溶解定容至100 mL。准确吸取1 mL置于10 mL的容量瓶内,加入0.5 mL的KOH显色,室温放置5 min,定容,在409 nm处测定吸光度。按下式计算总黄酮的纯度。
式中:n:稀释倍数(mL);V:溶液体积(mL);X:比色液中总黄酮的含量(mg/mL);A:取样体积(mL);m:称取纯化后总黄酮重量(g)。
2 结果与分析
2.1 树脂筛选的结果
5种大孔树脂的吸附率、解吸率测定如下表1。
由表1可知,在同一条件下进行静态吸附解吸实验,由于大孔树脂极性、比表面积等物理化学性质不同,吸附解吸的能力也不同。弱极性树脂AB-8、SP825、XAD-16平衡浓度和吸附率显著高于极性树脂S-8和非极性树脂D4020,且非极性树脂D4020树脂的吸附率最差,不足20%。AB-8和SP825树脂的解吸率显著高于其他类型树脂,超过80%。XAD-16树脂的吸附率也相对较高,但不易洗脱。D4020树脂的吸附率和解吸率都较低。综合考虑,AB-8和SP8252种树脂是较为适宜纯化分离甘草渣总黄酮的树脂类型。
2.2 2种树脂对甘草渣总黄酮的吸附动力学研究
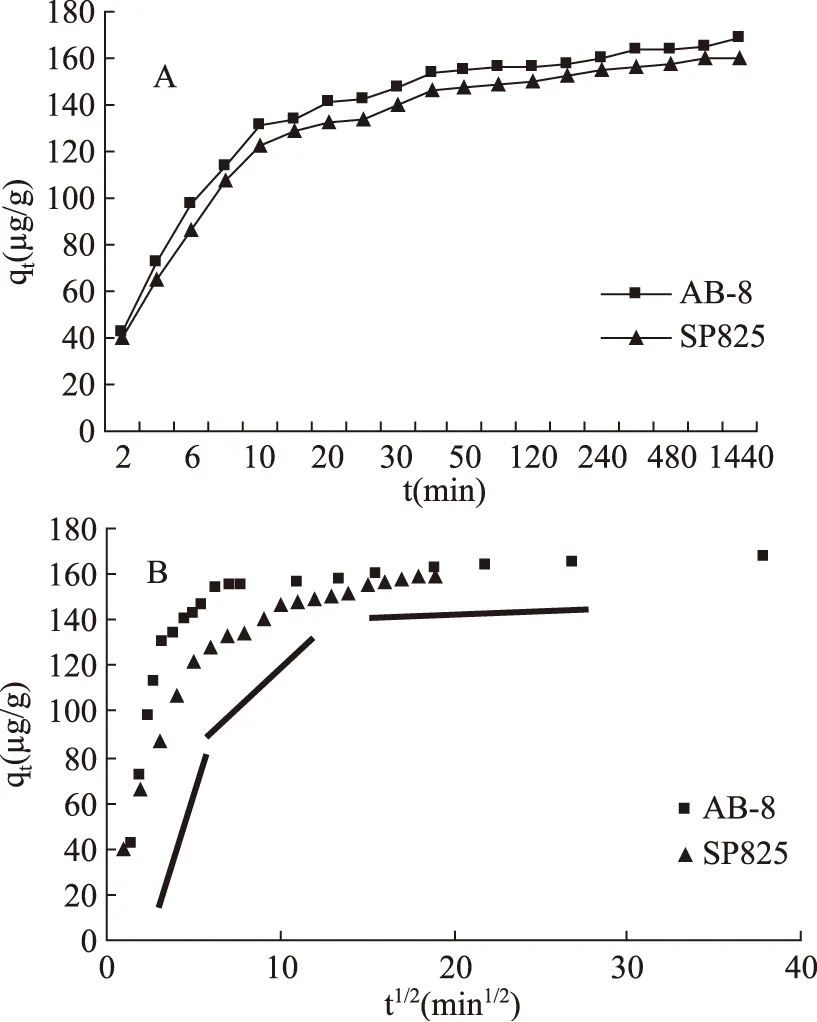
图1 2种树脂的吸附曲线Fig.1 The adsorption curve of the two macroporous resins to total flavones from Glycyrrhiza residues注:图A为吸附曲线。图B为粒子扩散曲线。图B中的黑色粗线代表吸附的不同阶段。
2种树脂的吸附动力学曲线见图1。在吸附过程中,2种树脂表现出三个阶段的变化,在40 min后达到吸附平衡。第一阶段,AB-8和SP825树脂的吸附能力在前10 min表现出线性快速增长的趋势。第二阶段(10~40 min),2种树脂都有缓慢的增长。最后一个阶段,2种树脂从40 min至1440 min达到吸附平衡。表明AB-8和SP825树脂都是快速吸附树脂。
表2 动力学方程及相关系数
Table 2 The Dynamic equations and associated model parameters

树脂动力学方程相关系数R2动力学参数AB-8lnqe-qt()=-k1t+lnqey=0157221-e-015368x()098803K1=015368 Qe=015722tqt=1k2q2e×t+1qey=59544x+371611099993K2=09546 Qe=016790qt=kd×t1/2+cy=000211x+011588061220Kd=000211 c=011588SP825lnqe-qt()=-k1t+lnqey=0150931-e-014258x()096500K1=014258 Qe=015093tqt=1k2q2e×t+1qey=624921x+3271753099999K2=11939 Qe=01600qt=kd×t1/2+cy=000212x+010908062057Kd=000212 c=010908
2种树脂的粒子扩散曲线(坐标t1/2和qt)如图1B所示。在实验所选时间内,曲线表现出很弱的线性趋势。整个过程分为三个阶段,表明2种树脂对甘草渣总黄酮的吸附过程包括多重扩散。这三阶段的扩散包括边界层扩散阶段(0~10 min),逐渐吸附阶段(10~40 min)和平衡阶段(40~1440 min)。由于曲线并不是过原点的一条直线。因此,边界层扩散和颗粒内扩散并不是控制吸附过程的限速步骤[18]。因为相关性较差,不能用粒子内扩散模型很好的描述2种树脂吸附的过程[19]。
为了阐明2仲树脂的吸附性能和机理,选择拟一级动力学方程、拟二级动力学方程和粒子扩散动力学模型来拟合吸附过程。所得的方程及其参数总结在表2中。根据其良好的相关系数,选择拟二级动力学方程作为2种树脂对甘草渣总黄酮吸附过程最有可能的模型。
2种树脂对总黄酮的吸附40 min后达到平衡,2种树脂的吸附量分别为:AB-8树脂153.50 μg/g,SP825树脂146.00 μg/g。作为比较,根据拟二级动力学模型,2种树脂的理论吸附量分别为:AB-8树脂167.90 μg/g,SP825树脂160.00 μg/g。计算值很符合实验结果,说明拟二级动力学模型很适合预测2种树脂对甘草渣总黄酮的吸附过程。
2.3 2种树脂对甘草渣总黄酮的吸附解吸
温度和乙醇浓度对2种树脂解吸过程的影响如图2所示。

图2 2种树脂的解吸曲线Fig.2 The desorption curve of the two macroporous resins to total flavones from Glycyrrhiza residues
结果表明,乙醇浓度和解吸温度显著影响树脂的解吸过程。随着乙醇浓度的增加,2种树脂对甘草渣总黄酮的解吸率随之增加。AB-8树脂的解吸率由0.65%增加到99.66%,SP825树脂的解吸率由0.65%增加到98.31%。用80%的乙醇解吸时,解吸率显著的高于60%的乙醇解吸,且解吸率高达80%。出于对乙醇成本和后期浓缩蒸发耗能耗时的综合考虑,树脂对总黄酮解吸时选择80%的乙醇。事实上,这一结果与一些酚类和黄酮的解吸研究的结果一致[20]。与此同时,随着解吸温度的升高,2种树脂的解吸率有显著提高。当温度从25 ℃升高到55 ℃时树脂的解吸率均有提高:AB-8树脂的解吸率由75.78%增加到95.34%,SP825树脂的解吸率由63.52%增加到83.53%。随后解吸率不会随着温度的升高而进一步增加。
总之,以上动力学和解吸的结果表明这2种树脂都有相似的吸附解吸特性和良好的吸附能力。AB-8和SP825大孔树脂都是聚苯乙烯型树脂。研究表明[21],聚苯乙烯型树脂能够较好实现对总黄酮的分离。与此同时,树脂相似的化学组成和物理结构对树脂的吸附能力都很关键[15]。黄酮拥有两个苯环可以吸附适宜颗粒大小、比表面积、孔径的非极性,弱极性和中等极性的物质。黄酮中的π-π共轭和树脂的苯环是2种树脂的吸附过程中的主要原因[22]。因此,大孔树脂对总黄酮的吸附习性与其化学组成和物理特性有着协同作用。
2.4 2种树脂对甘草渣总黄酮的吸附热力学研究
吸附温度对2种大孔树脂吸附能力的影响见图3。随着吸附温度的升高,2种树脂的吸附率也随之显著下降。AB-8树脂的吸附率由34.59%下降到19.20%,SP825树脂的吸附率由40.98%下降到23.46%。
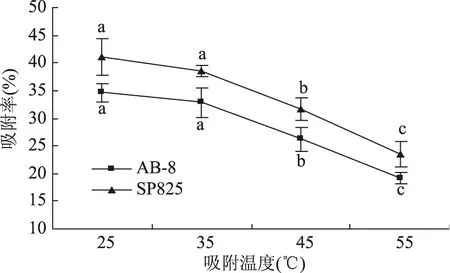
图3 2种树脂的热力学曲线Fig.3 The Adsorption thermodynamics on two macroporous resins
继续对2种树脂进行吸附热力学研究。AB-8树脂和SP825树脂的吸附等温线如图4所示。随着温度的逐渐升高,AB-8树脂和SP825树脂的qe明显下降。
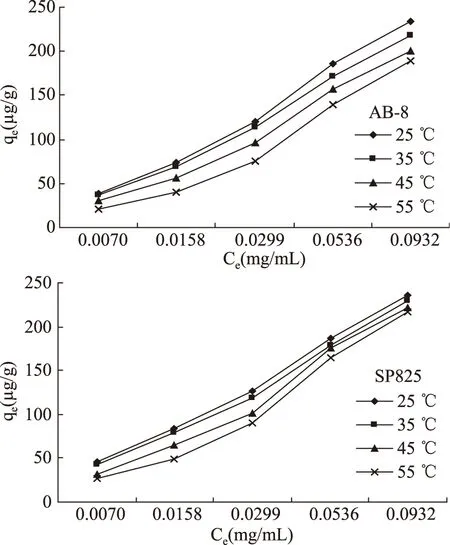
图4 2种树脂的吸附等温线Fig.4 The adsorption isotherm of the two macroporous resins to total flavones from Glycyrrhiza residues
通过对Langmuir方程和Freundlich方程的拟合,如下表3所示,Langmuir方程对树脂拟合相关性并不是很好。AB-8树脂和SP825树脂对甘草渣总黄酮的Freundlich热力学模型如下表4所示。在不同温度下,Freundlich热力学模型都能很好的描述吸附平衡过程。
根据范德霍夫方程,AB-8树脂和SP825树脂的焓变(ΔH)分别为-0.0050 kJ/mol和-0.0071 kJ/mol。2种树脂的焓变(ΔH)是负值,说明树脂的吸附过程是放热的,低温更适宜树脂的吸附[23]。不同温度下的ΔG值也均为负值,表明吸附过程是自发进行的。与此同时,XAD-16和SP825树脂的焓变(ΔH)的绝对值都小于43 kJ/mol,表明树脂的物理结构是决定甘草渣总黄酮在树脂表面吸附的重要因素[24]。
表3 Langmuir热力学方程及相关系数
Table 3 The Langmuir thermodynamics equations and associated model parameters

树脂温度(K)Langmuir热力学模型KLqmR2AB-82981444720410309960030814954203757099488318107542040690985733284557406498088258SP8252981897550367509973430817549403672099379318103989045610978633285665206449091633
表4 Freundlich热力学方程及相关系数
Table 4 The Freundlich thermodynamics equations and associated model parameters

树脂温度(K)Freundlich热力学模型KF1/nR2ΔH(kJ/mol)AB-82981368507073099565308123890697509958931813274076000996373281608208738099650-00050SP8252981170406441099592308115130653409971631814990076840995243281807308508099612-00071
2.5 AB-8大孔树脂对甘草渣总黄酮的纯化工艺研究
由于大孔吸附树脂不同的物理化学性质,其对甘草渣黄酮的吸附解吸能力具有一定的差异。静态吸附解吸实验结果如上表1所示,3种弱极性树脂AB-8、SP825、XAD-16的平衡浓度和吸附率显著的高于其他树脂,AB-8和SP825树脂的解吸率显著高于XAD-16。但是,树脂的解吸率对于树脂对总黄酮的纯化至关重要,AB-8树脂的解吸率显著的高于SP825树脂,所以选择AB-8大孔树脂对甘草渣总黄酮进行纯化。
2.5.1 上样流速的影响 控制不同的粗提液上样速度分别为1.5、3、6 mL/min。粗提液上样流速对树脂吸附过程的影响如下图5所示。甘草渣总黄酮的提取液上样流速对树脂的吸附特性的影响较为突出。当流速超过3 mL/min时,树脂的吸附率有明显的下降。当粗提液流速为1.5 mL/min和3 mL/min时,树脂对总黄酮的吸附率显著的高于其他流速。出于节约时间的角度考虑,选择最佳上样流速为3 mL/min。
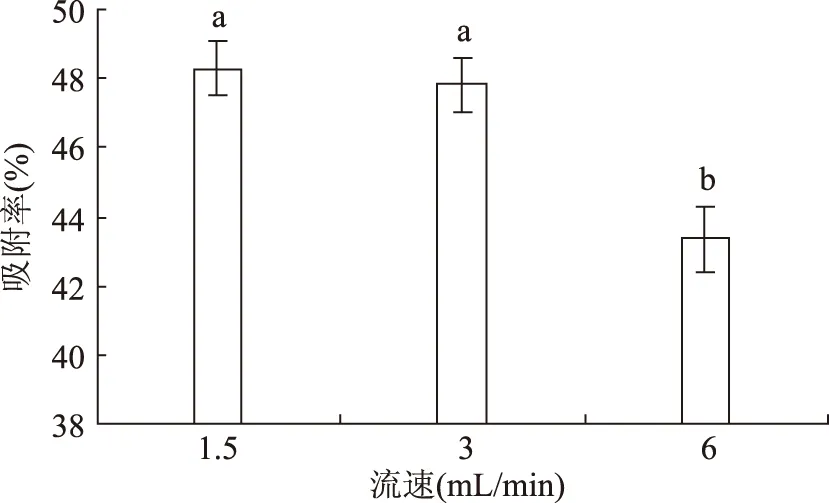
图5 流速对吸附率的影响Fig.5 Influence of flow velocity on adsorption rate
2.5.2 上样液浓度的影响 上样液浓度对树脂纯化过程的影响也较为明显。提取不同浓度的甘草渣总黄酮粗提液,以3 mL/min的流速上样,上样液浓度对树脂吸附过程的影响如下图6所示。在较低浓度时,树脂的吸附率随浓度的增加而升高,当浓度到达1.089 mg/mL时,吸附率最大。当甘草渣总黄酮的浓度大于1.089 mg/mL时,树脂对其的吸附能力下降。总黄酮浓度太大会使杂质的质量随之增加,与黄酮竞争吸附。使得树脂吸附饱和甚至降低[25]。因此,适宜大孔树脂纯化甘草渣总黄酮的上样液浓度为1.089 mg/mL。

图6 上样液浓度对吸附率的影响Fig.6 Influence of sample concentration on adsorption rate
2.5.3 洗脱剂浓度的影响 由于黄酮类物质易溶于醇,选择乙醇作为洗脱剂。乙醇浓度对树脂解吸率的影响如图7所示。随着乙醇体积分数的不断增加,解吸率也越来越高。乙醇的体积分数超过60%时,解吸率的增加较为平缓。当用无水乙醇洗脱时,解吸率达到99.23%。出于对乙醇成本和后期蒸发的综合考虑,若选择100%的乙醇洗脱,耗费的乙醇量较多,且洗脱后旋转蒸发所需的时间较长。我们选择80%的乙醇作为洗脱剂,此时,AB-8大孔树脂对甘草渣总黄酮的解吸率达到83.42%。
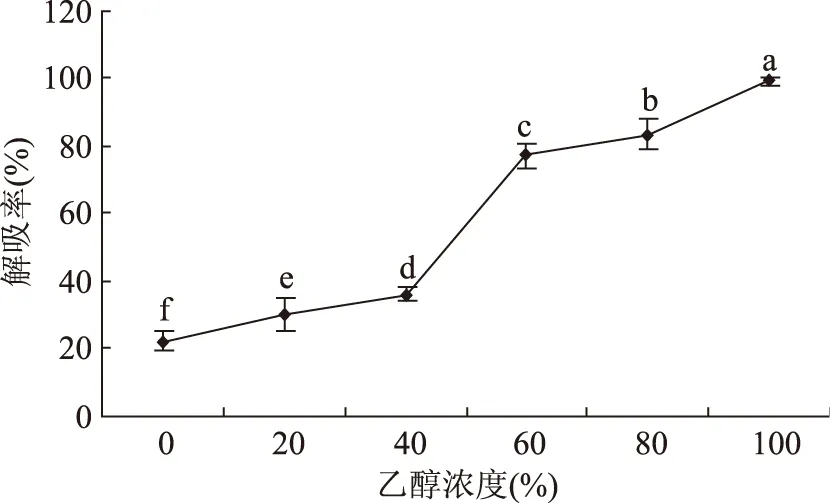
图7 洗脱剂浓度对解吸率的影响Fig.7 Influence of eluant concentration on desorption rate
2.5.4 洗脱流速的影响 洗脱的流速对大孔树脂纯化过程也有较显著的影响,如图8所示。控制80%乙醇洗脱剂的流速分别为1.5、3、6 mL/min。随着洗脱剂的流速的加快,解吸率下降较为明显。若流速太快,总黄酮来不及洗脱下来,解吸率自然较低。当洗脱的流速为1.5 mL/min时,其解吸率显著的高于其他流速。若选择更低的流速,在洗脱过程中会耗费大量的时间。综合考虑,选择80%乙醇洗脱剂对总黄酮的洗脱流速为1.5 mL/min较为适宜,此时树脂的解吸率为91.67%。

图8 流速对解吸率的影响Fig.8 Influence of flow velocity on desorption rate
2.5.5 解吸曲线 由图9可以看出,用80%的乙醇对总黄酮进行洗脱。洗脱峰较为明显,也较为对称,没有拖尾现象。当洗脱到20 mL时,流出液的浓度达到最大。之后随着洗脱体积的增加,总黄酮的含量下降。3 BV(48 mL)时,流出液中黄酮的浓度已经很低了,说明3 BV 80%的乙醇就可以将树脂上吸附的大部分黄酮洗脱下来。

图9 洗脱曲线Fig.9 Desorption curve
2.5.6 AB-8大孔树脂对甘草渣总黄酮的纯化效果 依照上述最佳纯化工艺条件,对甘草渣粗提物进行纯化验证实验,结果见表5。甘草渣粗提物的总黄酮纯度是47.70%,纯化后总黄酮的纯度可达53.43%。
表5 纯化前后总黄酮的纯度
Table 5 Purities of flavonoids before and after optimized purification using AB-8 resin

成分粗提物总黄酮纯化后总黄酮总黄酮含量(mg/g)47705343总黄酮纯度(%)47705343
3 结论
通过比较不同类型的树脂对甘草渣总黄酮进行静态吸附解吸实验,结果表明AB-8和SP825这2种弱极性的树脂对其吸附和解吸的能力较好,其吸附率分别为42.15%和44.19%,解吸率分别为86.52%和81.39%,优于相同实验条件下的其他树脂,出于吸附和解吸的综合考虑所以选择AB-8和SP825这2种树脂研究其动力学和热力学特性。动力学模型分析表明,拟二级动力学方程是描述2种树脂吸附解吸过程的最佳模型,相关系数分别达到0.99993和0.9999。进一步通过等温线模型分析,表明不同温度下Freundlich热力学模型适宜预测2种树脂的吸附平衡。在25 ℃的吸附条件下,AB-8和SP825树脂的拟合相关系数分别为0.99565和0.99592,而且吸附过程是放热的,是物理吸附的过程。总之,大孔树脂能够显著的富集总黄酮,其化学组成和物理结构都能影响树脂的吸附解吸能力。
选择AB-8大孔树脂,对其进行上样液浓度、上样流速、洗脱剂的浓度和洗脱流速等工艺参数进行考察。确定最佳纯化工艺条件为:甘草渣提取液浓度1.089 mg/mL,上样体积2 BV,上样流速3 mL/min,3 BV 80%乙醇洗脱,洗脱流速1.5 mL/min,此时解吸率高达91.67%。总黄酮的含量由纯化前的477.0 mg/g提高到纯化后的534.3 mg/g,富集效果良好。该工艺操作简单、重复率好,是AB-8大孔树脂分离纯化甘草渣总黄酮的有效途径。
[1]谷会岩. 中国甘草资源生态学研究[D]. 哈尔滨:东北林业大学,2001:5-10.
[2]崔永明. 甘草次生代谢产物分离纯化研究[D]. 武汉:华中科技大学,2005:1-20.
[3]Kim Y W,Ki S H,Lee J R,et al. Liquiritigenin,an aglycone of liquiritin in Glycyrrhiza Radix,prevents acute liver injuries in rats induced by acetam inophen with or without buthionine sulfoximine[J]. Chemico-biological interactions,2006,161(2):125-138.
[4]赵虹,蒋江涛,郑秋生. 甘草查尔酮A药理作用研究进展[J]. 中国中药杂志,2013,38(22):3814-3818.
[5]吴碧华,龙存国. 甘草总黄酮清除羟自由基作用的体外实验探讨[J]. 川北医学院学报,2001,16(3):3-5.
[6]Tamir S,Eizenberg M,Somjen D,et al. Estrogen-like activity of glabrene and other constituents isolated from licorice root[J]. Journal Steroid Biochemistry and Molecular Biology,2001,78(3):291-298.
[7]方诗琦,冷康,段金廣,等. 甘草药渣中黄酮类成分及其抗氧化活性的研究[J]. 中成药,2015,37(11):2443-2448.
[8]Zhou B,Zhang J Z,WuS S,et al. The influence of compatibility of processed radix aconite kusnezoffii on the pharmacokinetic of four components in Glycyrrhiza uralensis Fisch[J]. Journal of Ethnopharmacology,2015,169(2):1-7.
[9]Trupti W C,Virednra K R. Separation of glycyrrhizic acid from
licorice root extract using macroporous resin[J]. Food and Bioproducts Processing,2015,93(12):51-57.
[10]马彩梅. 甘草及甘草渣的综合利用研究进展[J]. 现代农业科技,2015,13(1):121-122.
[11]李俶,倪永年,李莉. 大孔吸附树脂分离纯化槲寄生中黄酮的研究[J]. 食品科学,2008,29(2):68-71.
[12]Dong Y,Zhao M M,SunD G. Absorption and desorption behaviour of the flavonoids from Glycyrrhiza glabra L. leaf on macroporous adsorption resins[J]. Food Chemistry,2015,168(2):538-545.
[13]王国军,唐辉,张淑兰,等. 大孔树脂纯化核桃隔膜总黄酮的工艺研究[J]. 中草药,2013,44(19):2688-2692.
[14]洪雪娥,高荫榆,罗丽萍,等. 大孔树脂对薯蔓黄酮吸附分离特性研究[J]. 食品科学,2006,27(10):423-427.
[15]Lin L Z,ZhaoH F,Ding Y,et al. Macroporous resin purification behavior of phenolics and rosmarinic acid from Rabdosia serra(Maxim)Hara leaf[J]. Food Chemistry,2012,130(1):417-424.
[16]Gulay B,Beguma,Yakupa M. Adsorption kinetics and thermodynamic parameters of cationic dyes from aqueous solutions by using a new strong cation-exchange resin[J]. Chemical Engineering Journal,2009,152(2-3):339-346.
[17]廉宜君,孙萍,陈韩英,等. 大孔树脂吸附解吸甘草黄酮效果研究[J]. 中国中医药信息杂志,2013,20(9):49-52.
[18]Guo B,Hong L,Jiang H X. Macroporous,poly(calcium acrylate-divinylbenzene)bead-A selective orthophosphate sorbent[J]. Industrial and Engineering Chemistry Research,2003,42(22):5559-5567.
[19]Ayrancie,Hoda N. Adsorption kinetics and isotherms of pesticides onto activated carbon-cloth[J]. Chemosphere,2005,60(11):1600-1607.
[20]Silva E M,Rogez H,Silva Iq,et al. Improving the desorption of Inga edulis flavonoids from macroporous resin:Towards a new model to concentrate bioactive compounds[J]. Food and Bioproducts Processing,2012,167(4):358-364.
[21]Francisco A,Tomas B,Blazquzema,et al. A comparative study of different amberlite XAD resins in flavonoid analysis[J]. Phytochemical Analysis,1992,3(4):178-181.
[22]Liu Y F,Liu J X,Chen X F,et al. Preparative separation and purification of lycopene from tomato skins extracts by macroporous adsorption resins[J]. Food Chemistry,2010,123(4):1027-1034.
[23]Gokmen V,Serpen A. Equilibrium and kinetic studies on the adsorption of dark colored compounds from apple juice using adsorbent resins[J]. Journal of Food Engineering,2002,53(3):221-227.
[24]董媛媛,邓翀,柴思佳. 大孔树脂吸附南五味子总三萜的动力学和热力学分析[J]. 中国实验方剂学杂志,2014,20(17):5-9.
[25]焦岩,王振宇. 大孔树脂纯化大果沙棘果渣总黄酮的工艺研究[J]. 食品科学,2010,31(16):16-20.
Absorption and desorption behaviour of the total flavones from Glycyrrhiza residues on macroporous adsorption resins
YUAN Ru-nan1,HU Hao-bin1,2,*,HAN Shun-yu1,WANG Zong-bo3
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.College of Chemistry and Chemical Engineering,Longdong University,Qingyang 745000,China;3.Qingyang Zhongkai Agricultural Products Limited Liability Company,Qingyang 745000,China)
The adsorption and desorption behaviours of macroporous resins for enriching total flavonoids fromGlycyrrhizaresidues were investigated. Five macroporous resins were studied using the static adsorption method. Additionally two representative resins(AB-8 and SP825)were chosen for adsorption thermodynamics and kinetics model studies,the conditions for purifying were optimized. The kinetics results showed that the whole adsorption process can be described better by the pseudo-second order kinetics model. The thermodynamics results showed that the adsorption process fited the Freundlich isothermal model,the adsorption of the representative resins was an exothermic and physical adsorption process. The optimum process conditions for purifying the total flavonoids fromGlycyrrhizaresidues using AB-8 resin were determined as follows:sample concentration of 1.089 mg/mL,flow velocity of 3 mL/min,sample volume of 2 BV,and amount of 80% ethanol as desorption solvent 3 BV,flow velocity of 1.5 mL/min. By this time the desorption rate was 91.67%. The purity was increased to 53.43%,which showed that AB-8 macroporou resin had better adsorption property. It can be used to purify and separate total flavonoids fromGlycyrrhizaresidues.
macroporous adsorption resins;Glycyrrhizaresidues;total flavonoids;adsorption behaviours;purification
2016-04-27
袁茹楠(1992-),女,硕士研究生,研究方向:营养与食品卫生学,E-mail:18153950877@163.com。
*通讯作者:胡浩斌(1969-),男,博士,教授,研究方向:营养与食品卫生学,E-mail:2396402556@qq.com。
甘肃省科技支撑项目(1604NKCM082) ;庆阳市科技合作项目(kh2014-03)。
TS201.1
B
1002-0306(2016)23-0199-07
10.13386/j.issn1002-0306.2016.23.029
