粪产碱杆菌AF01产可溶性胞外多糖发酵条件的优化
2016-02-09蒋樟丽韩福霞金泽霖高红亮常忠义贾彩凤
蒋樟丽,韩福霞,金泽霖,张 翼,高红亮,常忠义,贾彩凤
(上海市华东师范大学生命科学院,上海 200241)
粪产碱杆菌AF01产可溶性胞外多糖发酵条件的优化
蒋樟丽,韩福霞,金泽霖,张 翼,高红亮,常忠义,贾彩凤*
(上海市华东师范大学生命科学院,上海 200241)
粪产碱杆菌(AlcaligenesFaecalis)AF 01产可溶性胞外多糖(EPS),本文采用单因素和正交实验设计,对其进行发酵优化研究。实验结果表明,最优发酵培养基:蔗糖50 g/L,KNO31.1 g/L,酵母膏0.5 g/L,CaCO315 g/L;最优发酵条件为:发酵时间4 d,初始pH7.0,接种量为2.5%,转速200 r/min,温度30 ℃。在此条件下,该菌株可溶性胞外多糖的产量有了极大的提高,达到10.8 g/L,为该胞外多糖的规模化生产提供了重要的参考。
粪产碱杆菌,可溶性胞外多糖,发酵优化
胞外多糖(exopolysaccharide,EPS)是微生物在生长代谢过程中产生并分泌到细胞外的长链、高分子聚合物[1]。因其产糖周期短、自然因素干扰小、产品容易分离的生产优势,胞外多糖在工业上受到日益重视,已作为稳定剂、胶凝剂、成膜剂、乳化剂等被广泛应用于食品、石油、制药、化妆品等领域,具有广阔的应用前景。
早在1965年,科学家从粪产碱杆菌发酵液中得到一种新的酸性可溶性多糖-琥珀酰多糖[2],该多糖是由D-葡萄糖和D-半乳糖组成的八糖重复单位,其中含有丙酮酸、乙酸及丁二酸取代基,分子量在6×106~1.5×107u之间[3]。随后该多糖相继被报导从黄杆菌属[4]、放射性土壤杆菌[5-6]和其他粪产碱杆菌中[7]产生。由于该多糖具有酸性、且可溶于水的特性,已经应用于化妆保健[8]、医药[9-10]等领域。但目前国内关于粪产碱杆菌发酵所产生的可溶性胞外多糖生产方面的研究尚未有报导,因此这种胞外多糖还具有巨大的探究空间。本文对粪产碱杆菌AF 01产可溶性的胞外多糖的发酵条件进行优化,以期对该多糖的进一步研究与开发应用奠定基础。
1 材料与方法
1.1 材料与仪器
粪产碱杆菌AF 01 由华东师范大学生命科学学院微生物与发酵实验室保存。
斜面培养基(g/L):葡萄糖40,酵母膏5,CaCO310,琼脂20,pH7.0。种子培养基(g/L):葡萄糖20,酵母膏10,CaCO33,pH7.0[11]。基础发酵培养基(g/L):葡萄糖40,NH4Cl 1.5,酵母膏1,CaCO35,MgSO4·7H2O 0.5,K2HPO41.71,KH2PO42.72,pH7.0[11]。所用试剂均为AR级 购自国药集团化学试剂有限公司。
电子天平,精密度为0.1 mg,梅特勒-托利多仪器 (上海)有限公司;超净工作台 北京东联哈尔仪器制造有限公司;恒温培养箱 北京东联哈尔仪器制造有限公司;CR21N型立式离心机 天美(中国)科学仪器有限公司;DHG-9246A型烘箱 上海精宏实验设备有限公司;DK-S24型恒温水浴锅 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 培养条件 将两环斜面种子接入30 mL种子培养基中,30 ℃,200 r/min振荡培养24 h,作为种子液。培养好的液体种子以5%接种量接入250 mL锥形瓶装液30 mL发酵培养基中,30 ℃,200 r/min振荡培养。
1.2.2 发酵液的取样处理 取发酵液,90 ℃水浴加热3 min使蛋白变性凝结,冷却后,室温 9000 r/min离心10 min,分离上清和沉淀备用。
1.2.3 胞外可溶性多糖产量的测定 取发酵液上清0.5 mL,通过苯酚-硫酸法[11]在OD490条件下进行检测。
1.2.4 菌体干重的测定 取发酵液沉淀,加入蒸馏水重悬,1000 r/min离心5 min,弃去沉淀CaCO3,菌体悬液9000 r/min离心5 min,用蒸馏水洗涤菌体沉淀,重复2次,将沉淀在80 ℃烘箱中烘干过夜至恒重[12]。
1.3 实验设计
首先利用单因素实验筛选对粪产碱杆菌EPS产量影响显著的因素,选择影响显著的因子进行3水平的正交实验设计。
1.3.1 单因素实验
1.3.1.1 最佳碳源的选择 分别以40 g/L的葡萄糖、麦芽糖、乳糖、蔗糖、淀粉和甘油替换基础发酵培养基中的碳源,其它培养基成份不变,30 ℃,200 r/min振荡培养粪产碱杆菌AF 01 4d,用以考察碳源对可溶性EPS产量的影响。
然后基础培养基中分别添加质量浓度为20、30、40、50、60 g/L的蔗糖,培养4d后,检测碳源浓度对EPS产量的影响。
1.3.1.2 最佳无机氮源的选择 以优选后的蔗糖为碳源,分别以1.5 g/L NH4Cl、(NH4)2SO4、NH4H2PO4、KNO3、NH4NO3、草酸铵替换基础培养基中无机氮源,培养粪产碱杆菌4 d,考察无机氮源对EPS产量的影响。
基础培养基中分别添加质量浓度为0.7、1.1、1.5、1.9、2.3 g/L的KNO3,培养4 d后,考察无机氮源浓度对EPS产量的影响。
1.3.1.3 酵母膏浓度对可溶性EPS产量的影响 在基础培养基中,分别添加质量浓度为0.5、1、3、5、7 g/L的酵母膏,发酵结束后,检测酵母膏浓度对EPS产量的影响。
1.3.1.4 CaCO3添加量对可溶性EPS产量的影响 在基础培养基中,分别添加质量浓度为1、5、10、15、20 g/L的CaCO3,发酵结束后,检测CaCO3添加量对EPS产量的影响。
1.3.1.5 pH、接种量、温度、转速及发酵时间的优化 选用优化后的产糖培养基进行发酵条件优化。在接种量5%、温度30 ℃、转速200 r/min 的条件下培养4 d,测定发酵培养基不同初始pH(5、6、7、8、9)对EPS 产量的影响。在培养基初始pH为7、温度30 ℃、转速200 r/min 的条件下培养4 d,测定接种量(1%、2.5%、5%、7.5%、10%)对EPS 产量的影响。在培养基初始pH7、接种量5%、转速200 r/min的条件下培养4 d,测定发酵温度(25、28、30、33、37 ℃)对EPS 产量的影响。在培养基初始pH为7、接种量5%、温度30 ℃的条件下培养4 d,测定转速(160、180、200、220 r/min)对EPS产量的影响。在pH7、接种量5%、温度30 ℃、转速200 r/min 的条件下培养,测定发酵时长(1、2、3、4、5、6 d)对EPS产量的影响。
1.3.2 正交实验优化发酵产EPS的培养条件 通过以上一系列单因素实验探究,选择对菌体产胞外多糖较为显著的蔗糖浓度、酵母膏浓度、菌液接种量和发酵温度作为实验因子,分别以四个因素的最佳条件为参考各设置3个水平,进行L9(34)正交实验,设计如表1所示。
表1 正交实验因素水平表L9(34)
Table 1 Factors and levels of L9(34)orthogonal design

水平因素A蔗糖浓度(g/L)B酵母膏浓度(g/L)C接种量(%)D发酵温度(℃)13005152524012530350153535
1.4 统计分析
所有实验做3个平行,利用Excel和SPSS对实验结果进行数据分析。
2 结果与分析
2.1 培养基成份对可溶性EPS产量的影响
2.1.1 碳源种类和浓度对EPS产量的影响 碳源作为细胞生长最重要的能量与营养来源,对EPS产生具有重要作用。所选择的不同碳源对可溶性EPS产量的影响如图1A所示,而蔗糖为碳源时EPS产量显著高于其他碳源(p<0.05),达到5.90 g/L,因此我们选择蔗糖为碳源做进一步的研究。

图1 碳源种类及浓度对可溶性EPS产量的影响Fig.1 Effect of carbon source type and concentration on soluble EPS yield
图1B可知,随着蔗糖浓度升高,菌体干重逐渐增加,EPS产量不断提高,当蔗糖浓度为40 g/L时,胞外多糖产量达到最高值,为6.57 g/L。随着蔗糖浓度的进一步升高,EPS产量稍有下降。其原因是蔗糖含量过低时,由于碳源被过早消耗,所以影响了胞外多糖的产生;蔗糖含量过高,会抑制菌体的生长和胞外多糖的合成产生,影响EPS的产量,这与王爽[13]等报道的结果一致,因此选用蔗糖浓度为40 g/L做进一步的研究。
2.1.2 无机氮源种类和浓度对可溶性EPS产量的影响 由图2A可知,粪产碱杆菌可以利用不同的无机氮源产生EPS,采用KNO3作为无机氮源时,EPS产量最高,达到6.04 g/L。因此选择KNO3为最佳的无机氮源,进行下一步的研究。
如图2B所示,随着无机氮源KNO3浓度的增加,菌体干重增多,但当KNO3浓度超过1.5 g/L后,菌体干重无显著性增加,说明过高的无机氮源限制了菌体的生长。当KNO3质量浓度较低时,随着KNO3质量浓度的增大,无机氮源供应增多,EPS产量增加,当KNO3质量浓度为1.1 g/L时,EPS产量达到最高点。KNO3质量浓度继续增大,产生的大量菌体要消耗更多的碳源来维持自身的生长和代谢,导致胞外多糖产量相对下降。因此,1.1 g/L为KNO3最佳质量浓度。
2.1.3 酵母膏浓度对EPS产量的影响 培养基中加入少量酵母膏可以促进菌体生长,其中的生长因子对发酵后期产物的合成也有一定的促进作用[14]。基础培养基中加入不同质量浓度的酵母膏对EPS产量的影响如图3所示。

图3 酵母膏浓度对可溶性EPS产量的影响Fig.3 Effect of yeast extract concentration on soluble EPS yield
由图可知,酵母膏浓度为1 g/L时,菌体胞外多糖产量达到最高,之后随着酵母膏质量浓度的增加,菌体干重继续增多,但胞外多糖的产量逐渐降低,故酵母膏最佳质量浓度为1 g/L。
2.1.4 最佳CaCO3添加量的确定 粪产碱杆菌在生长过程会使培养基pH降低,为了维持培养液的pH范围,更利于菌体的生长,在培养基中分别加入不同质量的CaCO3,结果如图4所示。

图4 CaCO3添加量对可溶性EPS产量的影响 Fig.4 Effect of CaCO3 concentration on soluble EPS yield
随着CaCO3浓度的增高,菌体干重不断增加,EPS产量逐渐上升。原因可能是菌体代谢产生了酸性环境,而CaCO3的添加抑制了酸性环境对菌体生长的影响。当CaCO3的添加量为15 g/L时,菌体胞外多糖产量达到最高值,随着CaCO3添加量继续增加,胞外多糖产量会略有下降,故CaCO3的最佳添加量应该为15 g/L。
2.2 培养条件对EPS产量的影响
2.2.1 发酵时长对EPS产量的影响 以蔗糖作为基础发酵培养基的碳源,其余培养基成份不变,30 ℃,200 r/min振荡培养,探究发酵时长对EPS产量影响的结果如图5所示。
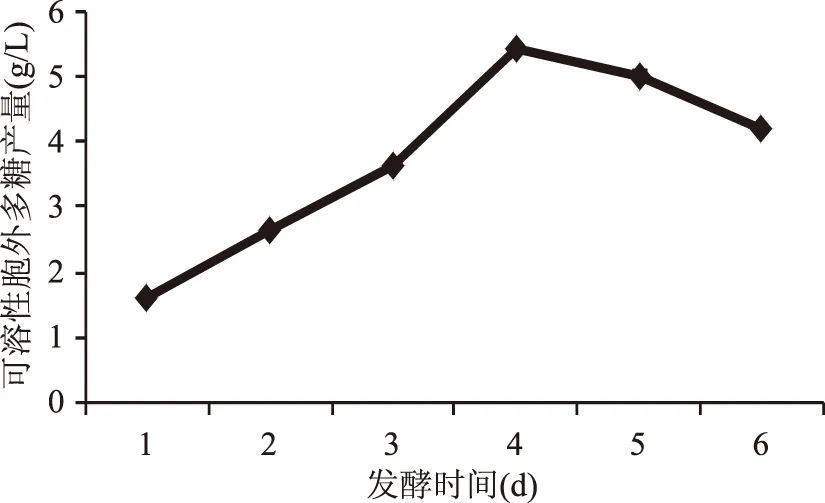
图5 发酵时间对可溶性EPS产量的影响Fig.5 Effect of culture time on soluble EPS yield
随着培养时间的延长,EPS的产量缓慢上升,到第4 d达到最高值5.44 g/L,之后逐渐下降。这是由于培养前期随着菌体的生长,菌体代谢所产胞外多糖产量逐渐增加,而第4 d后,培养基中碳源不足,菌体转而利用自身所产多糖作为碳源维持自身代谢及繁殖[15]。因此发酵时长4 d为最佳培养时间。
2.2.2 菌液接种量对EPS产量的影响 接种量直接影响发酵液内的最初活菌数,从而影响菌体的生长以及EPS 的生物合成。如图6所示,菌体干重随着接种量的增大而增加,而胞外多糖产量出现先增多后下降的趋势。接种量过少,菌体需更多时间繁殖,从而延迟了多糖的产生;接种量过多,菌体间竞争过于激烈,且需要更多碳源维持大量菌体生长,使其产糖受到抑制。故选择2.5%作为产EPS的最适接种量,这一结果与蹇华丽等[16]的报道一致。
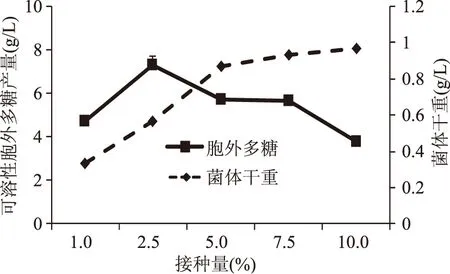
图6 接种量对可溶性EPS产量的影响Fig.6 Effect of inoculation amount on soluble EPS yield
2.2.3 培养基初始pH对EPS产量的影响 pH能改变微生物的相关酶活性与菌体代谢途径,因此微生物的生长及代谢产物的合成受到培养基pH的影响。如图7所示,初始pH偏低或偏高,会影响菌体的生长,同时影响EPS的生成。培养基初始pH为7.0时菌体干重达到最高值,EPS产量也达到最高点。
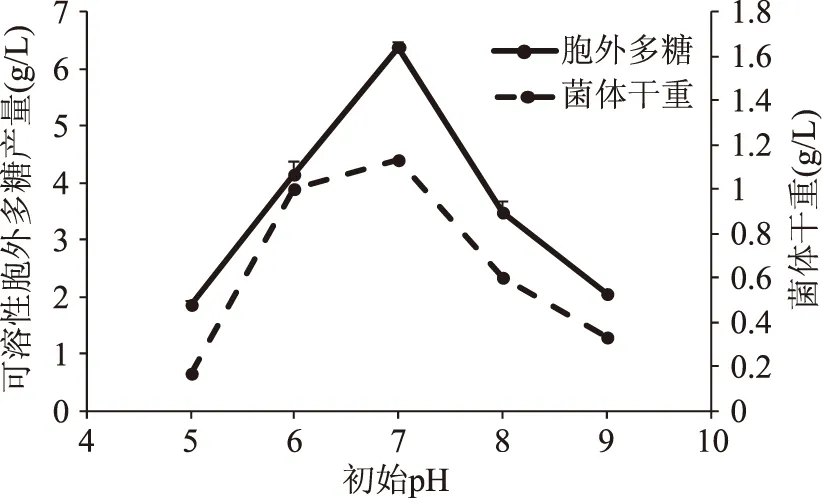
图7 培养基初始pH对可溶性EPS产量的影响Fig.7 Effect of initial pH on soluble EPS yield
2.2.4 发酵温度对EPS产量的影响 如图8所示,发酵温度为28~30 ℃时,EPS产量较高且菌体干重也较多。当温度较低时,菌体生长、代谢缓慢,EPS产生受到影响;温度较高时,会影响到菌体内酶的活性,从而影响菌体的生长代谢及EPS的产生。
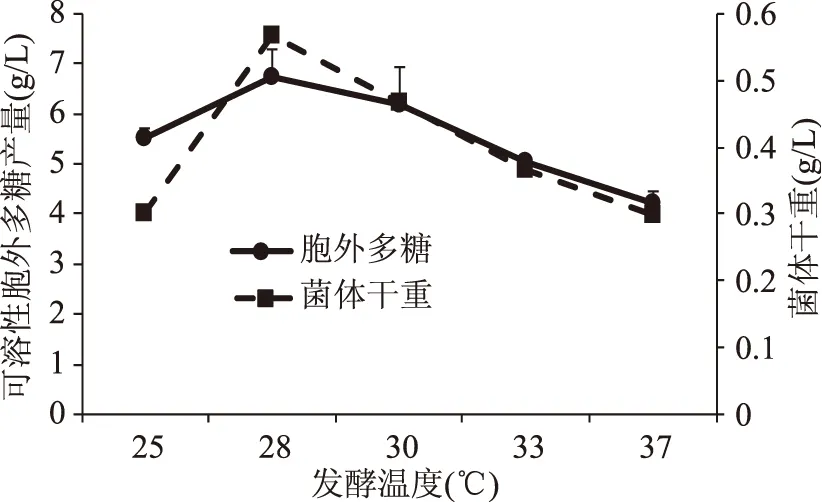
图8 发酵温度对可溶性EPS产量的影响Fig.8 Effect of fermentation temperature on soluble EPS yield
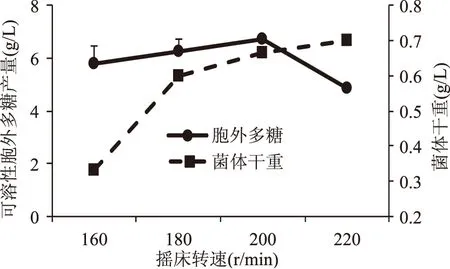
图9 摇床转速对可溶性EPS产量的影响Fig.9 Effect of rotation speed on soluble EPS yield
2.2.5 摇床转速对EPS产量的影响 粪产碱杆菌是好氧菌,摇床转速会影响供氧量,从而使菌体的生长代谢及其产物的合成受到影响。如图9所示,摇床转速过低,会导致供氧不足,菌体会生长缓慢,EPS产量较低;摇床转速过高,培养基溶氧量过高,细胞呼吸、代谢旺盛,会使其过早衰亡,从而导致菌体对碳源等物质的利用及产物的合成受到影响,EPS产量下降。因此,最佳摇床转速应设置为200 r/min。
2.3 正交实验确定产EPS的最佳培养条件
通过单因素实验,初步确定组成如下的最佳培养基配方:蔗糖40 g/L,KNO31.1 g/L,酵母膏1 g/L,CaCO315 g/L;最佳发酵培养条件:菌液接种量2.5%,初始pH7.0,发酵温度30 ℃,摇瓶转速200 r/min。
选择对产EPS影响较为显著的蔗糖浓度、酵母膏浓度、菌液接种量和发酵温度作为实验因子,分别以四个因子的最佳条件为参考各设置3个水平,进行L9(34)对产EPS发酵培养基组成进行优化,设计与结果见表2。
由表2极差分析可知,4个因素对粪产碱杆菌产EPS影响的大小顺序为:蔗糖>酵母膏>发酵温度>菌液接种量。综合比较各因素不同水平胞外多糖产量,最终确定该四因素最佳组合条件:蔗糖50 g/L,酵母膏0.5 g/L,菌液接种量2.5%,发酵温度30 ℃。按照该条件进行3次验证实验,得到的EPS的平均值为10.8 g/L,显著提高了EPS的产量。
表2 正交实验表设计和结果分析
Table 2 The orthogonal design scheme and result analysis

实验号ABCD胞外多糖产量(g/L)1111145962122233223133310714212370135223149426231264447313210753832133308933218462k12996745447836000k26133385762666840k37508532655893797R4512359714833043因素主次排序1243
3 结论
通过单因素实验,从培养基组成和培养条件探讨了粪产碱杆菌产EPS的最佳条件,然后在此基础上,选择对EPS产量影响较为显著的蔗糖浓度、酵母膏浓度、菌液接种量和发酵温度,进行了L9(34)正交实验设计。最终得到的最优化培养条件为:蔗糖50 g/L,KNO31.1 g/L,酵母膏0.5 g/L,CaCO315 g/L,MgSO4·7H2O 0. 5 g/L,KH2PO42. 72 g/L,K2HPO41.71 g/L;发酵培养的最佳条件为:发酵时间4 d,菌液接种量2.5%,培养基初始pH7.0,发酵温度30 ℃,摇瓶转速200 r/min。在此最优方案下,粪产碱杆菌AF 01胞外多糖的产量达到10.8 g/L。
因此,优化得到最优粪产碱杆菌产EPS的发酵条件真实可靠,具有实际意义,对今后该多糖的进一步研究奠定了基础。
[1]曹永强,王辑,赵笑,等. 植物乳杆菌YW11生产胞外多糖的发酵条件研究[J]. 食品科学技术学报,2016,34(1):42-49.
[2]Hisamatsu M,Abe J,Amemura A,et al. Formation of an oligosaccharide,the repeating unit of succinoglucan,by Alcaligenes faecalis,var. myxogénes[J]. Carbohydrate Research,1978,66(1):289-294.
[3]Nishida M C S C.Composition for external use containing succinoglucan,clay mineral and an alkyl acrylate/methacrylate copolymer:EP,EP 0988854 B1[P]. 2004.
[4]Amemura A,Moori K,Harada T. Purification and properties of a specific,inducibleβ-glucanase,succinoglucan depolymerase from Flavobacterium[J]. Biochimica et Biophysica Acta(BBA)-Enzymology,1974,334(2):398-409.
[5]Linton J D,Evans M W,Jones D S,et al. Exocellular Succinoglucan Production by Agrobacterium radiobacter NCIB 11883[J]. Microbiology,1987,133(11):2961-2969.
[6]Dussap C G,Vita D D,Pons A. Modeling growth and succinoglucan production byAgrobacterium radiobacter NCIB 9042 in batch cultures[J]. Biotechnology & Bioengineering,1991,38(1):65-74.
[7]Harada T,Yoshimuka T,Hidaka H,et al. Production of a New Acidic Polysaccharide,Succinoglucan by Alcaligenes faecalis var. myxogenes[J]. Bioscience Biotechnology & Biochemistry,2014,29(8):757-762].
[8]Hori T,Ishii T,Yamaki K. Body cosmetic for wet skin:EP,EP 2174639 A1[P]. 2010.
[9]中村茂义,久保贵史,沓挂裕美. 皮肤用粘合剂、皮肤用粘合片及造口术器具底板:CN,CN 101909667 A[P]. 2010.
[10]Flock S T,Marchitto K S. Adhesive Laminates for Rapid Wound Occlusion:US,US 20120065672
[11]Harada T,Masada M,Hidaka H,et al. Production of a Firm,Resilient Gel-forming Polysaccharide by a Mutant of Alcaligenes faecalis var. myxogenes 10 C3[J]. Agricultural & Biological Chemistry,1966,30(2):196-198.
[12]Harada T,Yoshimuka T,Hidaka H,et al. Production of a New Acidic Polysaccharide,Succinoglucan by Alcaligenes faecalis var. myxogenes[J]. Bioscience Biotechnology & Biochemistry,2014,29(8):757-762.
[13]王爽,王璐,许春雨,等. 银杏内生菌Endo Gin Ya6合成胞外多糖培养条件的优化[J]. 大连工业大学学报,2016(01):1-5.
[14]Jin W. Lee,Walter G. Yeomans,Alfred L. Allen,et al. Exopolymers from curdlan production:incorporation of glucose-related sugars by Agrobacterium,sp. strain ATCC 31749[J]. Canadian Journal of Microbiology,1997,43(2):149-156.
[15]上官王丽. 产胞外多糖细菌多样性及其对土壤团聚体形成作用的研究[D]. 南京:南京农业大学,2013.
[16]蹇华丽,田文祥,杨幼慧,等.多黏类芽孢杆菌PS04 产胞外多糖发酵条件优化[J].食品科技,2013,38(1):26-30.
Optimization of fermentation conditions for soluble extracellular polysaccharide production by Alcaligenes Faecalis AF 01
JIANG Zhang-li,HAN Fu-xia,JIN Ze-lin,ZHANG Yi,GAO Hong-liang,CHANG Zhong-yi,JIA Cai-feng*
(School of Life Sciences,East China Normal University,Shanghai 200241 China)
For the production of exopolysaccharide(EPS)fromAlcaligenesFaecalisAF01,single-factor test and orthogonal experimental design were employed to optimize the fermentation conditions. The results showed that the optimal medium components were consisted of 50 g/L sucrose,1.1 g/L KNO3,0.5 g/L yeast extract and 15 g/L CaCO3. The optimal fermentation conditions were incubation time of 4 d,the initial pH of 7.0,2.5% inoculum amount,shaking speed of 200 r/min and culture temperature of 30 ℃.Under the optimized conditions,the yield of the soluble extracellular polysaccharide was significantly improved and a maximum EPS yield of 10.8 g/L was achieved. The optimized medium and our results provided some important data for commercial production of this polysaccharide.
Alcaligenesfaecalis;soluble extracellular polysaccharide;fermentation condition optimization
2016-06-24
蒋樟丽(1994-),女,在读本科,研究方向:食品微生物,E-mail:zljiang1994@163.com。
*通讯作者:贾彩凤(1979-),女,博士,高级实验师,研究方向:食品微生物,E-mail:cfjia@bio.ecnu.edu.cn。
TS201.3
A
1002-0306(2016)23-0165-05
10.13386/j.issn1002-0306.2016.23.023
