南美白对虾酚氧化酶催化不同底物的生化特性研究
2016-02-09吕艳芳张思涵蔡路昀励建荣杨铭铎
吕艳芳,张思涵,蔡路昀,励建荣,杨铭铎
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076; 2.渤海大学食品科学与工程学院,辽宁锦州 121013)
南美白对虾酚氧化酶催化不同底物的生化特性研究
吕艳芳1,2,张思涵2,蔡路昀2,励建荣2,杨铭铎1,*
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076; 2.渤海大学食品科学与工程学院,辽宁锦州 121013)
为揭示南美白对虾酚氧化酶(phenoloxidase,PO)催化不同底物时的生化特性,本文以L-多巴、甲基多巴、邻苯二酚为底物,分别测定南美白对虾酚氧化酶催化这三种底物时的最适温度、最适pH,酶促动力学常数Km、Vmax值、活化能。结果表明,南美白对虾PO酶催化三种底物的最适温度分别为45、40、30 ℃,最适pH分别为6.8、7.2、8.0,酶促动力学常数Km分别为2.5003、5.8661、1.8429 mmol/L,Vmax分别为0.0624、0.1008、0.1692 ΔA/min,活化能Ea分别为15.2158、18.1981、10.4696 kJ/mol;邻苯二酚与PO酶的结合能力较强,但其结合受外界温度的影响较大;而PO酶与L-多巴和甲基多巴的结合受外界温度影响较小。由此可得,底物结构越简单,越容易与PO酶活性中心结合;底物与酶的结合能力越强,酶活化底物时所需的活化能越小;在PO酶研究中,如果影响因素有温度这一条件时,不应该选择邻苯二酚作为底物。
南美白对虾,酚氧化酶,酶促反应,动力学,活化能
生物酶是生物体活细胞产生的、具有催化作用的有机物,大部分为蛋白质,也有极少部分为RNA,具有高效性、专一性、降低底物反应活化能等特性。一种酶只能专一地催化特定的一种或一类物质,同一种酶作用不同的底物,其催化能力有很大差别,研究任何一种酶,选择合适的底物是研究的基础。虾类非常容易发生黑变,主要是由于虾体内含有酚氧化酶(phenoloxidase,PO),近年来对其生化性质和酶活性抑制方法的研究比较多,但在研究中选用的底物不一样,Qian等[1]在研究南美白对虾气调包装后,腐败微生物与虾黑变关系时,测定PO酶活性时,使用的底物是邻苯二酚;Nirmal等[2]在研究儿茶素和阿魏酸抑制南美白对虾PO酶动力学时,使用的底物是L-多巴;Manheem等[3],Huang等[4]在研究加热对南美白对虾PO酶活性影响时,使用的底物是L-多巴。PO酶催化不同底物的生化特性区别,目前研究的比较少,本研究在前人的研究基础上,对南美白对虾(Penaeusvannamei)PO酶进行分离纯化,然后研究其作用双酚底物(L-DOPA、甲基多巴、邻苯二酚)的生化特性,为对虾酚氧化酶的研究提供参考资料。
1 材料与方法
1.1 材料与仪器
南美白对虾 辽宁锦州水产市场,购买时为活虾,平均质量为每个虾15±2 g,将虾保持鲜活状态运到实验室,用冰猝死,自来水冲洗,将其头胸部剪下,贮藏于-80 ℃超低温冰箱备用。
邻苯二酚BR级 北京中生瑞泰科技有限公司;甲基多巴(L-3-(3,4-二羟基苯基)-2-甲基-L-丙氨酸)、L-多巴(L-β-(3,4-二羟基苯)-丙氨酸);L-DOPA)BR级,十二烷基聚乙二醇醚(Brij-35)Sigma-Aldrich 北京中生瑞泰科技有限公司;DEAE Sepharose Fast Flow GE Healthcare 北京德美中贸国际贸易有限公司;SDS-PAGE电泳试剂 Sigma北京中生瑞泰科技有限公司;其他试剂均为分析纯 上海国药集团化学试剂有限公司。
UV-2550紫外-可见分光光度计 日本岛津公司;蛋白电泳仪、GS-800图像扫描仪 美国Bio-Rad;Milli-Q超纯水装置 美国Millipore公司;DK8D型电热恒温水槽 上海一恒科技有限公司;Biofuge stratos台式冷冻高速离心机 美国Thermo Scientific公司;AF-10制冰机 美国Scotsman公司;蛋白质层析系统 上海青浦沪西仪器厂;智能编程层析柜CX-1型 上海嘉鹏科技有限公司。
1.2 实验方法
1.2.1 南美白对虾 PO酶分离纯化 将冷冻于-80 ℃超低温冰箱的南美白对虾头胸部的甲壳部及肌肉去掉,然后使用液氮研磨,称取100 g粉末加入到400 mL、0.067 mol/L、pH为7.2的预冷磷酸缓冲液中(含有0.1% Brij-35),混合后置于4 ℃下,浸提2 h,期间不断搅拌,然后用尼龙网布(300目)过滤,滤液使用高速冷冻离心机在4 ℃下10000 r/min离心20 min,弃沉淀,上清液使用尼龙网布(500目)将飘浮的虾青素过滤掉,收集上清液,获得的上清液即为粗酶液。
前期将粗酶液使用硫酸铵分段盐析,结果发现50%硫酸铵盐析出的蛋白质具有很高的酶活,以此作为盐析沉淀PO酶的实验依据。将饱和硫酸铵溶液缓慢加入粗酶液中,使硫酸铵浓度依次达到30%、40%和50%,每级沉淀都在4 ℃下静置2 h,4 ℃下10000 r/min 离心20 min,将30%、40%硫酸铵沉淀的蛋白质弃去,收集50%硫酸铵沉淀的酶蛋白,溶于适量的磷酸缓冲液。将上述酶液于4 ℃下进行透析,在pH为7.2、0.067 mol/L磷酸缓冲液中透析16 h,期间更换两次透析液,聚乙二醇浓缩后离心,收集上清。取12 mL透析、浓缩后的PO酶液上样于DEAE Sepharose Fast Flow弱阴离子交换柱(1.6 cm×25 cm),分别用含0、0.1、0.2、0.3、0.4、0.5、0.6 mol/L NaCl,pH为7.2、0.02 mol/L的磷酸缓冲液进行洗脱,每个梯度洗脱70 mL,流速1 mL/min,每5 mL收集1管,检测各管的酶活性和蛋白含量,合并酶活性较高的峰,使用10 ku超滤离心管浓缩,然后保存于-80 ℃超低温冰箱中备用。
1.2.2 SDS-PAGE电泳 酚氧化酶的纯度检测采用SDS-PAGE电泳检测[5]。浓缩胶和分离胶质量分数分别为4%和12%。电泳后,蛋白质用考马斯亮蓝R-250染色液进行染色。
1.2.3 蛋白质含量测定 蛋白质含量的测定采用Bradford 法进行[6]。蛋白质与考马斯亮蓝G-250 染料相结合,形成的复合物在595 nm处形成最大吸收峰,吸光度A595 nm与蛋白质浓度成正比。以牛血清蛋白(BSA)标准品作为标准蛋白,绘制标准曲线。根据标准曲线计算样品中蛋白质的浓度。
1.2.4 PO酶分别催化三种底物生成的产物最大吸收波长的测定 反应体系含有1.8 mL、0.067 mol/L的磷酸缓冲液(pH为各底物的最适pH),0.4 mL酶液,1.8 mL、20 mmol/L底物(L-DOPA、邻苯二酚、甲基多巴)混合后,置于各底物的最适温度下水浴5 min,取出立即放入冰中终止反应,用紫外分光光度计在300~700 nm波长范围内每隔2 nm进行扫描,确定PO酶催化各底物的产物最大吸收波长(λmax)。
1.2.5 酶活测定 通过测定反应体系中醌类物质形成的初始速度来计算酶的活性,使用紫外分光光度计在产物最大吸收波长处测定反应初期产物生成量的变化[7]。将1.8 mL的底物和1.8 mL的磷酸缓冲液(pH为各底物的最适pH)混合,置于各底物的最适温度下水浴2 min,然后加入预先在最适温度下预热2 min的PO酶0.4 mL,立即将混合液置于比色皿中,选择紫外可见分光光度计动力学模块,在产物的最大吸收波长(λmax)下测定反应液的吸光度,每隔5 s记录1次吸光值,测定6 min,选取反应体系吸光值A直线上升区间数据计算酶活,此阶段属于酶促反应的初速度阶段。
一个酶活力单位(U)定义为,单位体积酶液(mL)在单位时间(min)内使酶促反应体系吸光值增加0.001,定义为1个酶活力单位[8-9],用U(或U/mL)表示,见公式(1)。
式(1)
其中,ΔA为吸光值变化量,t为反应时间(min),D为反应体系总体积(mL)/参加反应的酶液(mL)。
本实验中相对酶活性表示为被测酶活性与该检测组中最大酶活之间的比值,见公式(2)。

式(2)
酶促反应速率以单位时间内(min)的吸光值(A)的增加量表示,见公式(3)。
式(3)
1.2.6 PO酶分别催化三种底物的最适温度的测定 用0.067 mol/L、pH6.8的磷酸缓冲液配置0.02 mol/L的L-DOPA,0.02 mol/L的邻苯二酚,0.015 mol/L的甲基多巴三种底物。L-DOPA在pH6.8、甲基多巴在pH7.2、邻苯二酚在pH8.0条件下,测定25~70 ℃(每隔5 ℃)下,PO酶催化三种底物的最适温度,操作步骤参考1.2.5,以相对酶活性表示酶的活性[10]。
1.2.7 PO酶分别催化三种底物的最适pH的测定 配制0.05 mol/L的不同缓冲液:醋酸-醋酸钠缓冲液提供pH为4.4~5.6的反应环境;磷酸氢二钠-磷酸二氢钾缓冲液提供pH为6~8.4的反应环境;甘氨酸-氢氧化钠缓冲液提供pH为8.8~9.2的反应环境。用不同pH的缓冲液分别配制0.02 mol/L的L-DOPA、0.02 mol/L的邻苯二酚,0.015 mol/L的甲基多巴作为反应底物。L-DOPA在45 ℃、甲基多巴在40 ℃、邻苯二酚在30 ℃条件下,测定不同pH(4.4~9.2)条件下PO酶的活性,操作步骤参考1.2.5,以相对酶活性表示酶的活性[10]。
1.2.8 PO酶分别催化三种底物的酶促动力学常数Km、Vmax值测定 反应温度为45 ℃、pH为6.8条件下,测定当L-DOPA在反应体系中不同浓度(2.5、5、7.5、10、12.5、15 mmol/L)下,反应体系的反应速率;反应温度为40 ℃、pH为7.2条件下,测定当甲基多巴在反应体系中不同浓度(10、20、30、40、50、60 mmol/L)下,反应体系的反应速率;反应温度为30 ℃、pH为8.0条件下,测定当邻苯二酚在反应体系中不同浓度(10、20、30、40、50、60 mmol/L)下,反应体系的反应速率。然后采用Lineweaver-Burk作图法计算出PO酶催化每种底物的Km、Vmax值。
1.2.9 温度对酶促反应动力学参数的影响 L-DOPA在pH6.8、甲基多巴在pH7.2、邻苯二酚在pH8.0条件下,反应温度选30、40、50 ℃,测定反应体系中L-DOPA不同浓度(2.5、5、7.5、10、12.5、15 mmol/L)、甲基多巴不同浓度(5、10、15、20、25、30 mmol/L)、邻苯二酚不同浓度(5、10、15、20、25、30 mmol/L)下,PO酶的催化速率,然后采用Lineweaver-Burk作图法计算出Km、Vmax值。
1.2.10 PO酶分别催化三种底物活化能计算 酶催化底物的实质是降低底物参加反应时的活化能,反应温度不同,酶促反应速度也不同。温度对酶促反应的影响可以利用Arrhenius公式来进行分析:
K=K0e(-Ea/RT)
式(4)
公式两边取对数变为
式(5)
式(6)
其中,K为平衡常数;K0为指数系数,Ea为活化能;R为气体常数。
由于反应速度V与反应速度常数K成正比,从公式(5)可知LnK与1/T成反比,以LnK为纵坐标,I/T为横坐标做图,由回归方程直线斜率公式(6)求出PO酶活化不同底物表观活化能Ea[11-12]。
2 结果与分析
2.1 南美白对虾酚氧化酶纯化结果
经50%硫酸铵沉淀收集的PO酶透析除盐,然后用DEAE Sepharose Fast Flow弱阴离子交换柱进一步纯化,选用含NaCl的磷酸缓冲液进行洗脱,洗脱曲线如图1A所示。从图1A可以看出,当采用不含NaCl的平衡缓冲液进行洗脱时,出现一个蛋白峰,但其酶活很低,说明此峰为穿透峰,蛋白质大部分为杂蛋白,PO酶蛋白基本都牢固地吸附在柱子上;采用含0.1~0.6 mol/L 的NaCl磷酸缓冲液进行梯度洗脱,含0.3 mol/L和0.4 mol/L NaCl的磷酸缓冲液洗脱时PO酶活性较高,但含0.3 mol/L NaCl的磷酸缓冲液洗脱的酶杂蛋白含量较高,所以收集含0.4 mol/L NaCl的磷酸缓冲液洗脱的收集管,浓缩后贮藏于-80 ℃冰箱中备用。

图1 南美白对虾PO酶纯化结果 Fig.1 Purification and profile of PO from Litopenaeus vannamei注:(A)PO酶经DEAE Sepharose Fast Flow弱阴离子交换柱纯化(B)SDS-PAGE检测不同步骤对PO酶纯化效果。M:蛋白MAK;泳道1:粗酶液;泳道2:50%硫酸铵沉淀;泳道3:DEAE Sepharose Fast Flow纯化结果。
采用SDS-PAGE凝胶电泳检测纯化后的酶液,考马斯亮蓝R-250进行蛋白染色,结果见图1B,粗酶液(泳道1)、经50%硫酸铵沉淀(泳道2)、经DEAE Sepharose Fast Flow弱阴离子交换柱后(泳道3),可以看出杂蛋白逐渐减少,泳道3共有5个较明显的亚基带,分子量约为66.2 ku和40 ku的蛋白亚基较强。PO酶经过这两步纯化后,酶的比活力为517.24 U/mg(946.55 U/mL),是粗酶液纯度的8.55倍,结果见表1,可以满足研究酶与底物作用特点实验的需求。
表1 南美白对虾PO酶提取过程比活力及纯化倍数变化
Table 1 Fold change of specific activity ofLitopenaeusvannameiPO enzyme extraction and purification

纯化步骤总酶活(U)体积(mL)蛋白浓度(mg/mL)总蛋白(mg)比活力(U/mg)回收率(%)纯化倍数粗酶28328832400117146846048100150%(NH4)2SO41148937566101667056171344056283DEAESepharoseFastFlow3975507421837686517241403855
2.2 PO酶分别催化三种底物生成的产物最大吸收波长、最适温度、最适pH
本研究中对PO酶催化L-DOPA、甲基多巴、邻苯二酚形成的产物最大吸收波长进行了测定;因提取酶的缓冲溶液、底物的性质、同工酶的形式、实验中缓冲液的类型都有可能影响到酶催化底物的最适温度与最适pH[8,13],所以研究中对南美白对虾PO酶在本实验条件下催化三种底物的最适温度、最适pH也进行了测定,具体结果见表2。
表2 PO酶催化三种底物生成的产物最大吸收波长、最适温度、最适pH
Table 2 The maximum absorption wavelength, optimum temperature and optimum pH of PO enzymatic products with different substrates

底物产物最大吸收波长(nm)最适温度(℃)最适pHL-DOPA4704568甲基多巴4534072邻苯二酚5253080
2.3 PO酶分别催化三种底物的酶促动力学常数Km、Vmax值
表3 PO酶催化三种底物的Lineweaver-Burk方程及动力学参数
Table 3 Lineweaver-Burk equation and kinetic parameters of PO catalyzed substrates

底物Lineweaver-BurkR2Km(mmol/L)Vmax(ΔA/min)L-DOPA1/V=400889/[S]+160338098372500300624甲基多巴1/V=581748/[S]+99171098435866101008邻苯二酚1/V=108932/[S]+59109099281842901692
Km是酶与底物结合的特征性物理常数,与反应条件有关。在特定的反应条件下,Km值的大小只与酶的性质有关,与酶的浓度无关,同一酶催化不同的底物有不同的Km值,酶与底物的结合能力与1/Km成正比。南美白对虾PO酶催化L-DOPA、甲基多巴、邻苯二酚酶促反应的Lineweaver-Burk双倒数作图结果见图2,根据回归方程计算得到PO酶催化三种底物的动力学参数Km值和Vmax值,具体结果见表3。从结果中可知PO酶与三种底物的结合能力从大到小依次为邻苯二酚、L-DOPA、甲基多巴。研究发现酚氧化酶的活性中心除了有与底物羟基结合的位点,还有两个和芳香基团结合的位点,这个结构是酶与底物结合的专一性的基础[14]。本研究选择的三个双酚底物的结构,从简单到复杂依次是邻苯二酚、L-多巴,甲基多巴,所以由此可以推测,底物结构越简单,越容易与酶活性中心结合。

图2 PO酶催化三种底物的Lineweaver-Burk图 Fig.2 Lineweaver-Burk plot of PO
2.4 PO酶分别催化三种底物的活化能
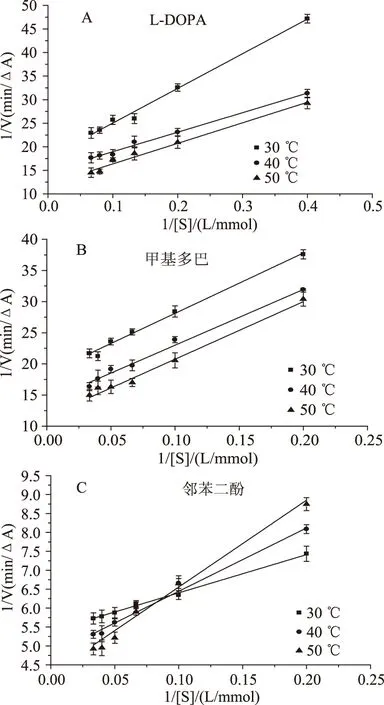
图3 不同温度下PO酶催化三种底物的Lineweaver-Burk图Fig.3 Effect of temperature on PO enzymatic activity with different catalytic substrates
2.4.1 温度对酶促反应动力学参数的影响 在不同温度下南美白对虾PO酶催化三种底物的酶促反应Lineweaver-Burk双倒数作图结果见图3,根据回归方程计算得到不同温度下PO酶催化同一底物的动力学参数,结果见表4。从结果中可以看出,随着反应温度的增加,PO酶催化同一底物的反应体系的Vmax都增加,说明在酶不发生变性的温度范围内,随着外界温度的增加,单位时间内被活化的底物分子的量在增加。从Km值的变化可以看出,在这个温度范围内,随着外界温度的增加,PO酶与L-DOPA的结合能力在增加,而PO酶与甲基多巴和邻苯二酚的结合能力在降低。同时根据Vmax/Km比值的变化,也可以得出,PO酶与邻苯二酚的结合受外界温度的影响最大,随着反应温度的增加,Vmax/Km比值逐渐降低,酶与邻苯二酚的结合能力降低明显,说明PO酶催化邻苯二酚的生化反应稳定的温度范围较小。PO酶催化L-DOPA、甲基多巴的Vmax/Km比值随反应温度的变化不大,说明酶与底物的结合能力受温度的影响较小。如果在PO酶活性研究中,影响因素有温度这一条件时,不应该选择邻苯二酚作为底物。
表4 不同温度下PO酶催化三种底物的Lineweaver-Burk方程及动力学参数
Table 4 Lineweaver-Burk parameters of PO with different catalyzed substrates at different temperatures
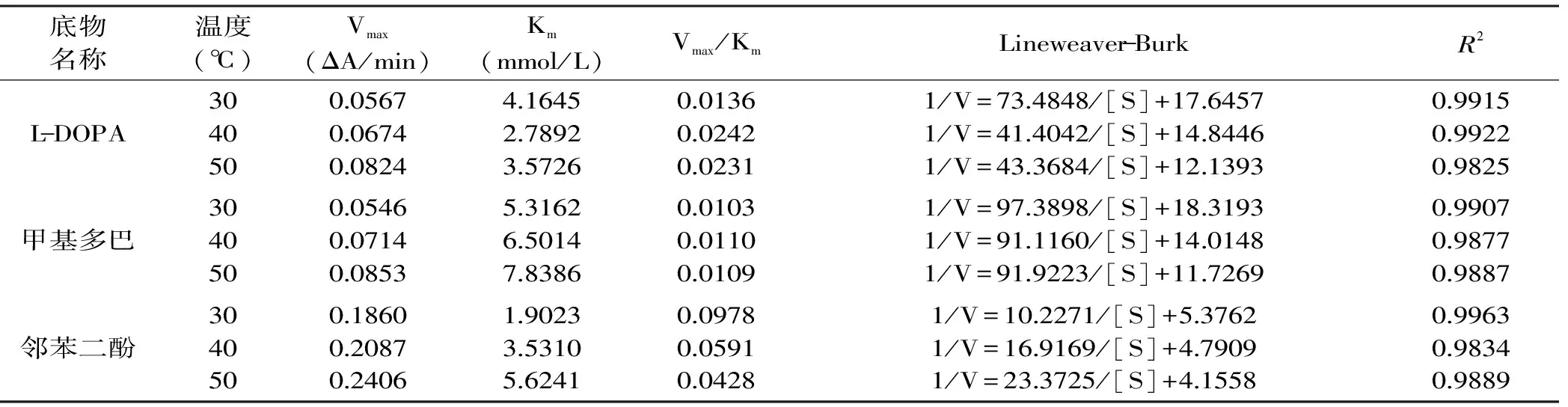
底物名称温度(℃)Vmax(ΔA/min)Km(mmol/L)Vmax/KmLineweaver-BurkR2L-DOPA3040500056700674008244164527892357260013600242002311/V=734848/[S]+1764571/V=414042/[S]+1484461/V=433684/[S]+121393099150992209825甲基多巴3040500054600714008535316265014783860010300110001091/V=973898/[S]+1831931/V=911160/[S]+1401481/V=919223/[S]+117269099070987709887邻苯二酚3040500186002087024061902335310562410097800591004281/V=102271/[S]+537621/V=169169/[S]+479091/V=233725/[S]+41558099630983409889
2.4.2 PO酶催化三种底物的活化能 化学反应中,反应物分子从基态转变为容易发生化学反应的活跃状态所需要的最小能量称为活化能。由Arrhenius(阿伦尼乌斯)公式推导出来的活化能,又称阿伦尼乌斯活化能或表观活化能。根据温度对酶促反应动力学参数的影响结果(表4),以LnK(即各温度下的LnVmax)为纵坐标,I/T为横坐标做图,结果为图4,由回归方程直线斜率求出PO酶活化不同底物的表观活化能Ea,结果见表5。由结果可知,PO酶催化L-DOPA,甲基多巴,邻苯二酚生成醌类物质过程中,PO酶与底物形成中间产物,底物被活化,所需的表观活化能分别是15.2158、18.1981、10.4696 kJ/mol。这个结果与2.3结果中PO酶与三种底物的结合能力统一分析可以得出,底物与酶的结合能力越强,酶活化底物时所需的表观活化能越小。

图4 PO酶催化三种底物的l/T-Ln(Vmax)图Fig.4 l/T - Ln(Vmax)graph of PO with different catalytic substrates
表5 PO酶催化三种底物的表观活化能(Ea)
Table 5 Activation energy of PO with different catalytic substrates

底物温度(℃)Ln(Vmax)回归方程lnK=lnK0-EaRTR2表观活化能(kJ/mol)L-DOPA304050-28705-26976-24964Ln(Vmax)=-18301418/T+3160109923152158甲基多巴304050-29080-26401-24619Ln(Vmax)=-21888476/T+4324609812181981邻苯二酚304050-16820-15667-14245Ln(Vmax)=-12592795/T+2466309876104696
3 结论
研究中采用50%硫酸铵盐析、DEAE Sepharose Fast Flow弱阴离子交换柱层析对南美白对虾PO酶进行分离,经过这两步纯化后,酶的比活力为517.24 U/mg(946.55 U/mL),是粗酶液纯度的8.55倍。PO酶与三种双酚底物的结合能力从大到小依次是邻苯二酚、L-DOPA、甲基多巴;催化三种底物的活化能从小到大依次是邻苯二酚、L-DOPA、甲基多巴。PO酶与邻苯二酚的结合能力较强,同时活化邻苯二酚的活化能最小,这可能是因为邻苯二酚结构比L-DOPA和甲基多巴简单,更容易与酶的活性中心结合有关,但PO酶与邻苯二酚的结合受外界温度的影响较大,随着反应温度的增加,酶与邻苯二酚的结合能力降低比较快,所以,在研究虾类PO酶活性时,如果影响因素有温度这一条件时,那么不应该选择邻苯二酚作为底物。
[1]Qian Y F,Xie J,Yang S P,et al.Invivostudy of spoilage bacteria on polyphenoloxidase activity and melanosis of modified atmosphere packaged Pacific white shrimp[J]. Food Chemistry,2014,155:126-131.
[2]Nirmal N P,Benjakul S. Inhibition kinetics of catechin and ferulic acid on polyphenoloxidase from cephalothorax of Pacific white shrimp(Litopenaeus vannamei)[J]. Food Chemistry,2012,131(2):569-573.
[3]Manheem K,Benjakul S,Kijroongrojana K,et al. The effect of heating conditions on polyphenol oxidase,proteases and melanosis in pre-cooked Pacific white shrimp during refrigerated storage
[J]. Food Chemistry,2012,131(4):1370-1375.
[4]Huang W Y,Ji H W,Liu S C,et al. Inactivation effects and kinetics of polyphenol oxidase from Litopenaeus vannamei by ultra-high pressure and heat[J]. Innovative Food Science and Emerging Technologies,2014,26:108-115.
[5]Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227:680-685.
[6]Bradford M M. A rapid sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistr,1976,72:248-254.
[7]Simpson B K,Marshall M R,Otwell W S. Phenoloxidase from shrimp(Penaues setiferus):purification and some properties[J]. Journal of Agricultural and Food Chemistry,1987,35:918-921.
[8]Palma-Orozco G,Ortiz-Moreno A,Dorantes-álvarez L,et al. Purification and partial biochemical characterization of polyphenol oxidase from mamey(Pouteria sapota)[J]. Phytochemistry,2011,72(1):82-88.
[9]任佩,王莹,金玉兰,等.章鱼消化道蛋白酶的分离纯化及性质[J].食品科学,2012,33(7):168-171.
[10]ünal M ü,Sener A. Two-year comparison of the biochemical properties of polyphenol oxidase from Turkish Alyanak apricot(Prunus armenica L.)[J]. Food Chemistry,2016,190,741-747.
[11]王磊.马铃薯酶促褐变机理研究[D].南昌:南昌大学,2012.
[12]Batista K A,Batista G L A,Alves G L,et al. Extraction,partial purification and characterization of polyphenol oxidase from Solanum lycocarpum fruits[J]. Journal of Molecular Catalysis B:Enzymatic,2014,102:211-217.
[13]Liu F,Zhao J H,Gan Z L,et al. Comparison of membrane-bound and soluble polyphenol oxidase in Fuji apple(Malus domestica Borkh. cv. Red Fuji)[J]. Food Chemistry,2015,173:86-91.
[14]林敏.抑制剂对蘑菇酪氨酸酶与马铃薯多酚氧化酶抑制效应的比较研究[D].厦门:厦门大学,2007.
Biochemical characteristics of phenol oxidase in Penaeus vannamei on different substrates
LV Yan-fang1,2,ZHANG Si-han2,CAI Lu-yun2,LI Jian-rong2,YANG Ming-duo1,*
(1.College of Food Engineering,Harbin University of Commerce,Harbin 150076,China; 2.College of Food Science and Technology,Bohai University,Jinzhou 121013,China)
To reveal the changes of biochemical characteristics(phenoloxidase,PO)ofPenaeusvannameiin catalyze with different substrates. In this paper,L-dopa,methyldopa,catechol were taken as substrates,the optimum temperature of PO were measured by enzymatic oxidation with the three substrates,the pH optimum,enzyme kinetics constants Km,Vmaxthe value of activation energy were determined. The results showed that when PO enzyme catalyzed L-dopa,methyldopa and catechol,the optimum temperature were 45,40,30 ℃,the optimum pH was 6.8,7.2,8.0,the enzymatic kinetic constants were 2.5003,5.8661,1.8429 Kmmmol/L and Vmaxwere 0.0624,0.1008,0.1692 ΔA/min,activation energy Ea were 15.2158,18.1981,10.4696 kJ/mol,respectively. Catechol binding with PO was stronger,but the combination was greatly influenced by the outside temperature,while the effects of temperature on PO combination with L-dopa and methyldopa were less. So it can be speculated that the simpler the substrate structure was the easier the combination with the active center of the PO;the stronger the enzyme substrate binding ability was the less activation energy was desired. In PO enzyme studies,if the temperature was included in factors,catechol should not be chosen as a substrate.
Penaeusvannamei;phenoloxidase;enzymatic reactions;kinetics;activation energy
2016-05-12
吕艳芳(1977-),女,在读博士,讲师,研究方向:水产品贮藏加工,E-mail:lvyanfang2003@126.com。
*通讯作者:杨铭铎(1956-),男,博士,教授,研究方向:烹饪科学与传统食品工业化技术,E-mail:yangmingduo5663@163.com。
辽宁省科技攻关项目(2015103020)。
TS254.1
A
1002-0306(2016)23-0139-06
10.13386/j.issn1002-0306.2016.23.018
