聚球藻7002藻蓝蛋白的分离纯化研究
2016-02-09李思梦高风正曾名湧
李思梦,高风正,曾名湧
(中国海洋大学食品科学与工程学院,山东青岛 266003)
聚球藻7002藻蓝蛋白的分离纯化研究
李思梦,高风正,曾名湧*
(中国海洋大学食品科学与工程学院,山东青岛 266003)
本文研究了聚球藻7002藻蓝蛋白的分离纯化工艺,为提高聚球藻7002藻蓝蛋白的纯度和提取率提供一定技术指导。采用组织捣碎法、超声波法、反复冻融法对细胞进行破碎提取藻蓝蛋白,比较了不同破壁法提取藻蓝蛋白的纯度和总蛋白提取率,采用响应面法确定了最佳破壁条件,通过硫酸铵盐析、羟基磷灰石层析法提纯藻蓝蛋白,对结果进行SDS电泳鉴定。实验显示反复冻融法破壁效果最佳,响应面实验确定了最佳破壁条件为菌体浓度3.53 mg/mL、冻融次数6次、解冻温度37 ℃、最佳盐析浓度为硫酸铵55%,经羟基磷灰石层析后藻蓝蛋白纯度可达3.79。最终本实验得到了分离纯化聚球藻7002藻蓝蛋白的最佳工艺方法。
聚球藻7002,藻蓝蛋白,反复冻融,响应面优化,分离纯化
微藻是一种光合自养微生物,是生产药品、食品高价值生物活性物质和生物燃料的细胞“工厂”[1]。蓝细菌聚球藻在海洋浮游植物中占有优势组分的地位。聚球藻7002(Synechococcussp.PCC7002)是一种单细胞蓝藻生物,是一类超微型(0.5~2 μm)球粒状光合自养原核生物[2],是海洋微藻的重要组成部分,全球碳循环的主要参与者和初级生产力的主要贡献者之一[3]。聚球藻 7002(Synechococcussp.PCC7002)是目前发现的细胞倍增时间最短的蓝细菌,是发酵生产海洋活性物质的理想生物反应器。本文对聚球藻7002进行了成分测定,发现其蛋白质含量高达40%以上,是获得海洋活性蛋白质的理想原料。
藻蓝蛋白(C-Phycocyanin,C-PC)是藻类中一种重要生理活性的色素蛋白,它常见于蓝藻中,是藻胆蛋白中的一种。藻蓝蛋白在藻体中以藻胆蛋白体的形式存在,藻胆蛋白体由多种藻胆蛋白及连接蛋白或多肽组成。藻胆蛋白是强荧光的色素-蛋白络合物,是藻体中重要的捕光色素蛋白。目前的研究发现,藻蓝蛋白包含一个蛋白和一个发色团,蛋白是由相对分子量分别在18 ku和20 ku的α和β亚基组成,其单体(αβ)分子共含有3个发色团,分别位于α亚基的Cys84和β亚基的Cys84,Cys155。α和β亚基通过分子间的各种相互作用力先形成单体(αβ),单体之间借助连接多肽的作用再聚合成(αβ)3和(αβ)6。藻蓝蛋白的亚基主要以三聚体和六聚体形式存在,此外还有二聚体和比六聚体聚集度更高的聚集体[4]。藻蓝蛋白作为天然色素蛋白在药物和食品领域以及免疫学、细胞学等方面有重要应用。大量体外和体内实验发现其通过驱除自由基从而表现出抗炎活性[5-6],研究还发现其具有一定的抗癌活性。此外,藻蓝蛋白具有较高的促红细胞生成素活性,有刺激骨髓造血的功效。
目前,国内外关于藻蓝蛋白的研究主要集中在螺旋藻,其分离纯化方法主要有以下几种:硫酸铵盐析与多次柱层析结合、等电点沉降法、十二烷基苯磺酸钠处理与柱层析结合分离法、氯化钾溶菌酶联合处理法或冻融法、分段梯度盐析与柱层析结合分离法、双水相萃取与离子交换层析结合分离法等[7]。关于聚球藻7002藻蓝蛋白提取分离纯化研究相对匮乏,本文以实验室培养得到的聚球藻7002藻粉为原料,对藻蓝蛋白进行提取纯化,寻找聚球藻7002藻蓝蛋白的最优提取工艺,以期为聚球藻7002开发利用提供科学指导。
1 材料与方法
1.1 材料和仪器
聚球藻7002干粉 聚球藻7002(Synechococcussp. PCC 7002)由北京大学生命科学学院赵进东院士惠赠。聚球藻7002培养于优化后的Medium A中,并在培养基中添加1 g/L半乳糖,以照明日光灯做光源全光照于光生物反应器中培养,培养8 d到达对数期后收集藻粉冷冻干燥储存。
硫酸铵、氯化钠、磷酸二氢钠、磷酸氢二钠、氯化钾、冰醋酸、丙烯酰胺、十二烷基硫酸钠、羟基磷灰石 均购于国药集团化学试剂有限公司,其他试剂 均为国产分析纯。
TGL-20B型高速台式离心机 上海安亭科学仪器厂;Power Wave XS2型酶标仪 Gene Company Limited;PHS-3C型精密pH计 上海雷磁仪器厂;JY92-2D 型超声波细胞粉碎仪 上海安亭科学仪器厂;DK-420 型电热水浴锅 上海第二分析仪器厂。
1.2 实验方法
1.2.1 聚球藻7002的培养及藻粉的获取 挑取聚球藻7002接种于优化好的 Medium A[8]液体培养基中,并添加1 g/L半乳糖,调节培养基pH7.5,装瓶量30%,摇速 150 r/min,温度32 ℃,光照强度光强100 μE/(m2·s),以照明日光灯做光源全光照培养至对数生长期后收集并冷冻干燥以获取优质藻粉。
1.2.2 聚球藻7002蛋白质总量测定 利用凯氏定氮法测定聚球藻7002中的总蛋白含量。
1.2.3 提取液中蛋白含量测定 通过实验确定的最佳破碎方法对聚球藻7002藻粉进行破碎,离心获取上清液即为提取液。采用福林酚法对提取液进行蛋白含量测定,按照试剂盒说明进行操作,设置三组平行实验,以标准牛血清蛋白的质量浓度(0、25、50、100、150、200、250 μg/mL)为横坐标,OD640值为纵坐标绘制标准曲线,作为定量的依据。
1.2.4 细胞破碎方法
1.2.4.1 组织捣碎法破碎聚球藻7002 称取一定质量的聚球藻7002干粉,加入10 mmol/L pH7.0的磷酸盐缓冲液使藻体溶液浓度达到2 mg/mL,在4 ℃条件下将组织捣碎机按转10 s,停20 s,重复捣碎40次,取出藻体溶液在4 ℃下10000 r/min,离心15 min,取上清测定吸光值(A280、A620、A650)。
1.2.4.2 不同超声功率破碎聚球藻7002 按1.2.4.1制备藻体溶液,并等体积分装在21个相同的离心管中,用超声波破碎仪冰浴超声藻体溶液,将功率分别设置为50、100、200、300、400、500、600 W,工作10 s,间歇5 s,超声时间为20 min。4 ℃下10000 r/min离心15 min,取上清测定吸光值(A280、A620、A650)。
1.2.4.3 反复冻融法破碎聚球藻7002 按1.2.4.1制备藻体溶液,搅拌均匀后在-20 ℃冰箱中冷冻90 min,30 ℃的恒温水浴锅中溶解,反复冻融6次。4 ℃下10000 r/min离心15 min,取上清测定吸光值(A280、A620、A650)。
1.2.5 单因素实验设计 通过单因素实验,分别考察不同菌体浓度、冻融次数、解冻温度对聚球藻7002藻蓝蛋白纯度和总蛋白提取率的影响。
1.2.5.1 菌体浓度对聚球藻7002藻蓝蛋白纯度和蛋白提取率的影响 固定冻融次数为6次,解冻温度30 ℃,菌体浓度分别为0.5、1、1.5、2、2.5、3、3.5 mg/mL的条件下提取聚球藻7002藻蓝蛋白。
1.2.5.2 冻融次数对聚球藻7002藻蓝蛋白纯度和蛋白提取率的影响 固定菌体浓度为2 mg/mL,解冻温度为30 ℃,冻融次数分别为2、3、4、5、6、7、8次的条件下提取聚球藻7002藻蓝蛋白。
1.2.5.3 解冻温度对聚球藻7002藻蓝蛋白纯度和蛋白提取率的影响 固定菌体浓度为2 mg/mL,冻融次数为6次,解冻温度分别为10、15、20、25、30、35、40、45、50 ℃的条件下提取聚球藻7002藻蓝蛋白。
1.2.6 响应面实验设计 本实验采用Design Expert8.0软件中的Box-behnken design(BBD)设计原理[9]设计响应面实验。根据单因素实验结果,选取菌体浓度、冻融次数、解冻温度3个因素作为实验因素,以藻蓝蛋白纯度和总蛋白质提取率为响应值设计实验,以期获得最优破碎条件[10],实验因素及水平见表1。
表1 响应曲面分析因素与水平
Table 1 Factors and level of the response surface methodology
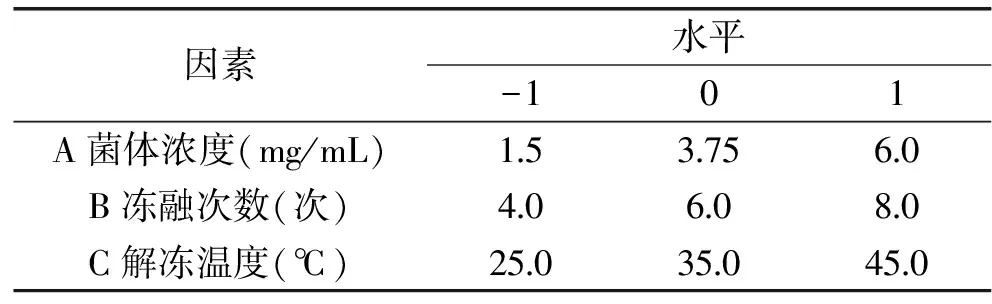
因素水平-101A菌体浓度(mg/mL)1537560B冻融次数(次)406080C解冻温度(℃)250350450
1.2.7 硫酸铵盐析法 实验证明,硫酸铵分步盐析法可以显著提高藻蓝蛋白纯度[11],在响应面优化后的细胞破碎条件下提取藻蓝蛋白得到蓝色上清液,将冻融所得蓝色上清液采用10%~60%梯度饱和硫酸铵溶液进行盐析,饱和硫酸铵溶液梯度设置如下:10%、20%、25%、30%、35%、40%、45%、50%、55%、60%。4 ℃过夜,4 ℃下1000 r/min离心15 min收集沉淀并用低浓度磷酸盐缓冲溶液溶解后测吸光度(A280、A620、A650)。
1.2.8 藻蓝蛋白纯化及电泳鉴定
1.2.8.1 HA柱层析纯化聚球藻7002藻蓝蛋白 将1.2.7中的溶解液在4 ℃进行超滤浓缩脱盐后,采用经10 mmol/L(pH7.0)磷酸盐缓冲液预平衡的羟基磷灰石(HA)柱进行层析[12]。在洗脱过程中不断增加磷酸缓冲液的离子强度(用10、20、50、100、200 mmol/L,pH7.0磷酸盐缓冲液,并加0.1 mol/L NaCl洗脱),洗脱速度控制在0.7 mL/min,收集峰尖部分[13],立即进行光谱测定,再将620 nm处有特征吸收峰的藻蓝蛋白洗脱液合并,最后超滤浓缩脱盐。
1.2.8.2 SDS-PAGE电泳 采用垂直板不连续电泳系统,分离胶浓度为15%,浓缩胶浓度为5%。样品在浓缩胶中电泳电压为 80 V,进入分离胶后电压为120 V,剥胶后,以0.1%考马斯亮蓝 R-250染色,用30%甲醇、10%乙酸的脱色液脱色。
1.2.9 藻蓝蛋白分析方法及数据统计分析 藻蓝蛋白纯度参照Herrera等[14]的方法。藻蓝蛋白浓度以Soni[15]推荐的公式计算。如下所示:
式中:P为藻蓝蛋白纯度;[PC]为藻蓝蛋白浓度;V为提取液体积(mL);k1为藻蓝蛋白提取液稀释倍数;m为藻粉质量;k2为藻粉蛋白质含量。
1.3 数据统计分析
以上实验均平行测定三次,利用Design-Expert 8.0和SPSS19.0对所得数据进行统计分析。
2 结果与讨论
2.1 蛋白质标准曲线
测得蛋白质标准曲线为:Y=0.0022X+0.0741,R2=0.9978。式中Y为OD640值,X为溶液中蛋白质含量(μg/mL)。
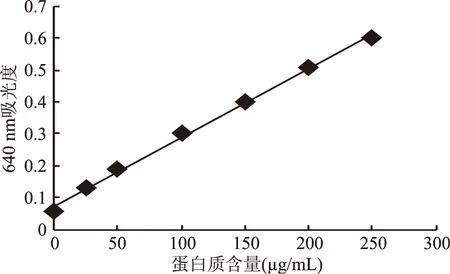
图1 蛋白质标准曲线Fig.1 Calibration curve of the chlorella protein
2.2 组织捣碎法和冻融法的破碎效果
组织捣碎法和冻融法对藻蓝蛋白纯度和总蛋白提取率的影响如表2所示,从表中可以看出,组织捣碎法提取的藻蓝蛋白提取率和纯度较低,原因是聚球藻7002藻体微小,在组织捣碎过程中藻体不能完全均匀接触组织捣碎机导致藻体细胞破碎率低下,蛋白质提取率较低。组织捣碎过程中由于机械做工产热使得藻体温度升高,当温度超过40 ℃[16],藻蓝蛋白易变性使其纯度降低,冻融法可以充分接触藻体细胞且蛋白质不易变性,综上所述冻融法破碎藻体效果好于组织捣碎法。
表2 组织捣碎法和冻融法对藻蓝蛋白纯度和总蛋白提取率的影响
Table 2 The effect of Tissue-trituration method and thawing method to the purity and production of C-PC

方法C-PC纯度蛋白提取率(%)组织捣碎法031±0051123±023冻融法042±0022445±012
2.3 超声波破碎法效果
采用超声波法对细胞进行破碎时,不同超声功率对破碎效果的影响如图2所示。
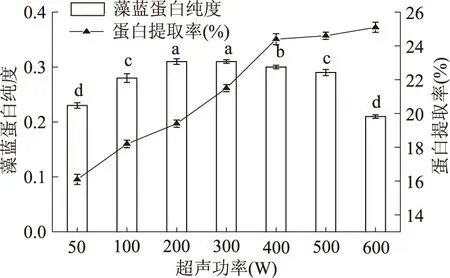
图2 超声破碎法对聚球藻7002藻蓝蛋白的纯度和蛋白提取率的影响Fig.2 The effect of ultrasonic method on the purity and production of C-PC注:不同小写字母代表差异性显著(p<0.05)。
由图2可以看出随着超声波功率的增加,蛋白的溶出率增加,功率为400 W时,继续提高超声功率对破碎细胞的作用不大,蛋白质提取增幅显著下降(p<0.05);另一方面,随着超声波功率增加,破碎细胞液温度也在增加,容易引起蛋白变性,造成藻蓝蛋白纯度下降。当功率达到400 W时,藻蓝蛋白纯度明显下降(p<0.05)。
综合表2和图2可知,对于超声功率而言,对细胞破碎具有一定的影响。超声功率越大,它所产生的超声波越强,对细胞的破坏性也越大。从结果看,也符合这一规律。随着超声功率的加强,提取液中藻蓝蛋白的含量也有增加的趋势;但超声波的热效应亦在不断增强,可能会造成局部蛋白的变性[17]。冻融法既可以得到纯度较高的藻蓝蛋白,蛋白提取率也显著高于组织捣碎法,比较而言冻融法细胞破碎和藻蓝蛋白提取的综合效果最好。
2.4 单因素实验结果
2.4.1 菌体浓度对聚球藻7002藻蓝蛋白纯度和蛋白提取率的影响 冻融法破碎细胞的原理是藻体在冻结过程中,细胞内外的液态水形成冰晶体,造成体积膨大,对藻体细胞壁和细胞膜产生破坏作用,使其通透性加大,内容物流出。因此加水量对细胞壁膜有影响。菌体浓度对聚球藻7002藻蓝蛋白纯度和蛋白提取率的影响如图3所示,可以看出菌体浓度对蛋白提取率有较大影响,对藻蓝蛋白纯度影响较小(p>0.05)。在菌体浓度较低时,蛋白提取率随着菌体浓度增大而显著提高(p<0.05),在菌体浓度达到2.5 mg/mL时,蛋白提取率达到最高,继续增加菌体浓度,蛋白提取率反而显著下降(p<0.05)。这是因为菌体浓度较小时,溶液的黏度较大,分子扩散速度低,提取率小,随着菌体浓度提高,溶液中蛋白浓度降低,使更多的蛋白质从藻体中释放出来,提取率升高。当菌体浓度达到一定值后,蛋白质提取率变化幅度很小,是因为此时溶液中蛋白质浓度与藻体中蛋白质浓度相当,使得藻体内外蛋白质的浓度差消失,蛋白质的溶出趋于平衡[18],因此,提取率几乎不再变化。随着菌体浓度增大,聚球藻7002藻蓝蛋白纯度从0.42下降到0.36,这是因为菌体浓度的增大导致所需实验操作时间加长容易引起蛋白质可逆或不可逆变性,但蛋白纯度变化不明显(p>0.05),综合考虑,菌体浓度以2.5 mg/mL为宜。
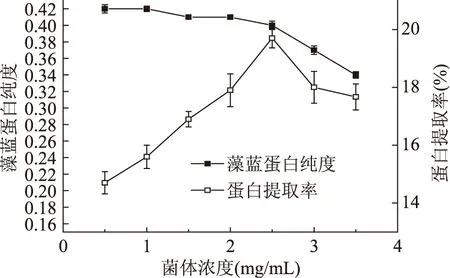
图3 菌体浓度对聚球藻7002藻蓝蛋白纯度和蛋白提取率的影响Fig.3 The effect of concentration of bacteria on the purity and protein production of C-PC in Synechococcus sp.PCC 7002
2.4.2 冻融次数对聚球藻7002藻蓝蛋白纯度和蛋白提取率的影响 每次冻融易生成细小冰晶体的地方不一样,即在细胞内外形成冰晶的部位是不同的,这会对细胞不同部位的细胞壁和细胞膜产生破坏,因而多次冻融能使破碎效果提高。由图4可知,增加冻融次数有助于藻蓝蛋白的溶出,蛋白提取率随着冻融次数的增加而增大,同时藻蓝蛋白的纯度也随之提高。冻融4次后,蛋白提取率增加趋于平缓,增加幅度不显著(p>0.05),冻融6次后,藻蓝蛋白纯度显著下降(p<0.05),这是由于冻融反复时间长了,胞内的蛋白酶分解了部分蛋白。综合破碎效果和破碎时间及冻融成本,冻融循环次数以6次为宜。
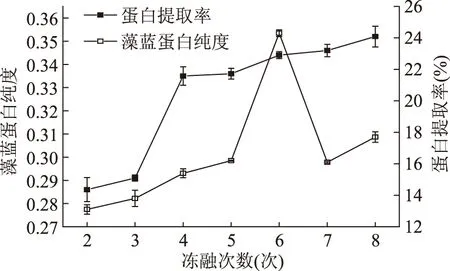
图4 冻融次数对聚对球藻7002藻蓝蛋白纯度和蛋白提取率的影响Fig.4 The effect of cycles of freezing and thawing on the purity and protein production of C-PC in Synechococcus sp.PCC 7002
2.4.3 解冻温度对聚球藻7002藻蓝蛋白纯度和蛋白提取率的影响 由图5可知,随着融化温度的增加,藻蓝蛋白纯度和蛋白提取率都在显著升高(p<0.05),当温度超过一定范围后,藻蓝蛋白纯度和蛋白提取率出现明显下降。分析其原因,反复冻融破坏了细胞膜的疏水键结构,增加了细胞膜的通透性,同时细胞内的水反复结冰、融化,形成的冰晶越来越大,加剧了冰晶对细胞壁的破坏作用[19]。一定范围内的温度升高能够加速冰晶的溶胀速度,提高藻体细胞的破碎效果,但当温度超过35 ℃时,藻蓝蛋白纯度和蛋白提取率出现明显下降(p<0.05)。因此,解冻温度为35 ℃为宜。

图5 解冻温度对聚球藻7002藻蓝蛋白纯度和蛋白提取率的影响Fig.5 The effect of thawing temperature on the purity and protein production of C-PC in Synechococcus sp.PCC 7002
2.5 响应面实验
2.5.1 响应面实验结果与分析 根据以上单因素实验的结果,对菌体浓度(A)、冻融次数(B)、解冻温度(C)三个因素进行Box-Behnken实验设计,按照表1因素的水平编码,实验结果如表3所示。
表3 Box-Behnken 中心组合实验设计方案与结果
Table 3 Box-Behnken central composite design matrix and corresponding experimental results

实验号ABC藻蓝蛋白纯度蛋白提取率(%)110-10.37±0.01116.81±0.622-1010.31±0.02321.43±0.213-1100.42±0.01520.52±0.3240000.45±0.03123.33±0.3550110.29±0.02818.73±0.466-1010.37±0.00622.57±0.24701-10.35±0.01219.46±0.3981-100.34±0.02819.79±0.6390000.43±0.02624.11±0.52100000.40±0.00523.56±0.19110-1-10.29±0.01819.32±0.22120-110.24±0.01418.27±0.43130000.45±0.00724.16±0.51141010.35±0.00322.37±0.16150000.42±0.05124.18±0.4216-1-100.37±0.02718.71±0.56171100.39±0.01920.75±0.33
2.5.2 回归模型的建立及其显著性检验 利用Design Expert8.0软件对实验数据进行多元二次回归拟合,得到的回归方程模型为:藻蓝蛋白纯度=0.44+0.054A+0.025B-13.88C-0.22AB+0.032AC-3.79BC+0.046A2-0.054B2-0.084C2;蛋白提取率(%)=18.95-13.34A+0.17B+4.30C-0.35AB+5.49AC+0.08BC-9.02A2-2.89B2-2.03C2。藻蓝蛋白纯度和蛋白提取率的回归方程及偏回归系数方差分析结果分别见表4和表5。
由表4、表5可以看出,两个方程的p值<0.01,失拟项均大于0.05,说明这两个模型的回归方程显著,失拟项不显著,方程模型可用。R2分别为0.9462、0.9108,说明方程的线性关系良好,能较好地反映各因素与响应值变化的关系,可用于聚球藻7002藻蓝蛋白纯度和蛋白提取率的理论预测。藻蓝蛋白纯度回归方程中B、C、B2、C2对藻蓝蛋白纯度影响显著。
蛋白提取率回归方程中C、AC、B2、C2对蛋白提取率影响显著。通过响应面的数字最优组合分析得到细胞破碎的最佳条件为:菌体浓度3.53 mg/mL,冻融次数6次,解冻温度37 ℃。预测值分别为:藻蓝蛋白纯度0.44,蛋白提取率为24.62%。
表4 藻蓝蛋白纯度回归方程的方差分析
Table 4 Analysis of variance in regression of the purity of C-PC
2.5.3 响应面分析及验证 两因素之间的交互作用见图6、图7。响应面等高线的形状反映出交互效应的强弱,椭圆形表示两因素交互作用显著[20-21]。由图6可知,菌体浓度和解冻温度的交互作用对蛋白纯度有一定影响。由图7可知,菌体浓度和解冻温度的交互作用对藻蓝蛋白得率提取率有着显著影响,固定菌体浓度时,随着解冻温度的升高,藻蓝蛋白的得率先升高后降低,固定解冻温度时,随着菌体浓度的升高,藻蓝蛋白得率先升高后降低。
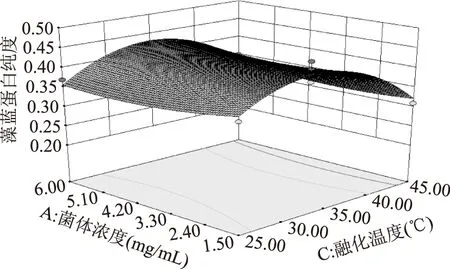
图6 菌体浓度和解冻温度对藻蓝蛋白纯度的交互作用Fig.6 The interactive effects of the concentration of bacteria and the thawing temperature on the purity of C-PC

图7 菌体浓度和解冻温度对蛋白提取率的交互作用Fig.7 The interactive effects of the concentration of bacteria and the thawing temperature on the protein production
表5 蛋白提取率回归方程的方差分析
Table 5 Analysis of variance in regression of the production of protein

项目自由度平方和均方F值p显著性回归模型98233915103600028∗∗A115415417402281B111511513002914C162266275000290∗AB17168E-0067168E-0068119E-00609978AC115931593180500038∗∗BC100260026002908696A2115415417502275B2135093509397400004∗∗C2117421742197400030∗∗残差7618088失拟项3556185119601182纯误差4062015总和168851
注:**极显著(p<0.01),* 表示显著(p<0.05)。
按最优组合方案中的提取条件进行验证实验重复3次,取平均值,测得藻蓝蛋白纯度0.47,蛋白提取率为25.17%,相对误差分别为0.03%和0.55%。进一步验证了数学回归模型的准确性。
2.6 硫酸铵盐析法
盐析现象的发生是由于高浓度的盐结合了大量的水,降低了水的活度,并且脱去蛋白质分子表面的水化层,加强了蛋白质分子间的直接作用。盐析法是常用的沉淀蛋白质的方法,其具有不易导致蛋白质变性的优势[22]。如图8所示,藻蓝蛋白纯度和得率随着硫酸铵饱和度的升高呈现先升高后下降的趋势。在饱和度为45%以下时,总蛋白盐析随盐饱和浓度增加的效果明显。饱和度45%~55%时,蛋白析出效果稳定。而当饱和度超过55%时,蛋白得率以及纯度略有下降,原因是在较高的盐浓度下,蛋白质分子表面的水化层被硫酸铵脱去,加强了蛋白质分子之间的直接作用,引起了部分变性。在硫酸铵饱和度为55%时纯度显著提高至0.79(p<0.05),藻蓝蛋白得率显著提高到0.62%(p<0.05)。由图可知,藻蓝蛋白提取液经过一步盐析后纯度提高了一倍。因此,硫酸铵盐析时以55%的饱和度为宜。

图8 硫酸铵饱和度对藻蓝蛋白纯度和得率的影响Fig.8 The effect of ammonium sulfate saturation to the purity and production of C-PC
2.7 藻蓝蛋白纯化及电泳鉴定
2.7.1 HA柱层析纯化聚球藻7002藻蓝蛋白 如图9所示,一定浓度的藻蓝蛋白经过羟基磷灰石层析柱后,出现5个峰。峰1为穿过组分,为粗藻蓝蛋白提取液中的杂质蛋白、核酸等杂质,目标蛋白组分主要集中在峰2、峰3,因为经过分光光度计检测在620 nm有最大吸收峰且其纯度为A620/A280=3.79,峰4和峰5的洗脱组分经过收集后检测其A620/A280=2.18。所以目标蛋白主要集中在峰2和峰3。将提取得到的藻胆蛋白经过收HA柱层析后,得到了药品纯级别的藻蓝蛋白[23]。羟基磷灰石(HAP)是一种磷酸钙晶体,具有好的生物相容性[24]。羟基磷灰石吸附技术对于蛋白质,酶,核酸等生物大分子的分离和纯化具有良好的选择性。使用该技术往往能呈现良好的分离性能。而且它价格低廉,用它作为色谱填充料,可作为制备色谱,具有易于放大的优势。

图9 藻蓝蛋白经HA柱的层析峰图Fig.9 HA elution profile of C-PC
2.7.2 SDS-PAGE电泳 如图10所示,SDS-PAGE蛋白电泳显示两条带,在11 ku和22 ku间,是藻蓝蛋白的α、β亚基,与文献报导的α亚基的分子量13~20 ku,β亚基的分子量14~24 ku相一致[25],且与藻蓝蛋白标准品条带接近,这证明了纯化后的蛋白质是藻蓝蛋白。由电泳图也可清晰看到,纯化后的藻蓝蛋白有两个明显的条带,而电泳级别的藻蓝蛋白一般只有一个条带,所以本次纯化的藻蓝蛋白纯度达到药品级但尚未达到电泳纯级别[27]。

图10 聚球藻7002藻蓝蛋白SDS-PAGE电泳结果Fig.10 SDS-PAGE of the purified phycocyanin from Synechococcus sp.PCC 7002注:1为纯化后的聚球藻7002藻蓝蛋白;2为藻蓝蛋白标准品;3为marker。
3 结论
聚球藻在生长过程中会产生多种活性物质[26],藻蓝蛋白是其中重要的活性物质,藻蓝蛋白的提取方法很多,本文讨论了组织捣碎法、反复冻融法、超声波破碎法。实验结果表明,超声波破碎法虽然可以显著提高藻蓝蛋白的提取率,但超声中产生的高温易使藻蓝蛋白变性从而降低藻蓝蛋白纯度。组织捣碎法虽然操作简便但其破碎聚球藻7002效果差,藻蓝蛋白提取率较低。反复冻融法通过细胞内冰粒的形成和剩余细胞液盐浓度的增高引起溶胀,使细胞壁、细胞膜破碎,藻胆体内的藻蓝蛋白溶出,不仅保证了藻蓝蛋白在低温下有较好的稳定性,使其纯度达到了0.42,提取率达到了24.45%,且其操作简便,生产成本较低,可以规模化放大生产。
在单因素实验的基础上,应用响应面法优化了反复冻融法的最佳破壁条件。聚球藻7002反复冻融的最佳破壁条件为:菌体浓度3.53 mg/mL、冻融次数6次、解冻温度37 ℃,在此条件下提取聚球藻7002藻蓝蛋白可使藻蓝蛋白纯度达到0.47,提取率达到25.17%,相对误差分别为0.03%和0.55%。建立了两个分别以聚球藻7002藻蓝蛋白纯度和蛋白提取率为目标值,以菌体浓度、冻融次数、溶解温度为因子的数学模型,在本实验范围内能够较为准确地预测聚球藻7002藻蓝蛋白的纯度和蛋白提取率。
本文通过硫酸铵一步盐析法确定了最佳硫酸铵饱和度为55%,通过硫酸铵盐析后藻蓝蛋白纯度提高了1倍,将藻蓝蛋白粗提液经过羟基磷灰石柱层析后得到了纯度为3.79的药品级(食品级>0.7,药品级>3.0和试剂级>4.0)[25]藻蓝蛋白。样品经过SDS-PAGE电泳显示的两个清晰条带进一步验证了其为藻蓝蛋白。硫酸铵一步盐析法结合羟基磷灰石层析法简化了藻蓝蛋白繁杂的纯化步骤。其成本低、耗能低、操作较简便,具有可以规模放大化的优势。
[1]Zahira Yaakob,Ehsan Ali,Afifi Zainal,et al.An overview:biomolecules from microalgae for animal feed and aquaculture[J]. Journal of Biological Research,2014,21(6):1-10.
[2]Johnson P W.Chroococcoid cyanobact eria in the sea:A ubiquitous and diverse phototrophic biomass.[J].Limnol Oceanogr,1979,24(5):928.
[3]马英,焦念志.聚球藻(Synechococcus)分子生态学研究进展[J].自然科学进展,2004,14(9):967-972.
[4]章申峰. C-藻蓝蛋白及其亚基的分离纯化和体外抗肿瘤研究[D].杭州:浙江大学,2005.
[5]程超,薛峰,汪兴平.藻胆蛋白提取纯化及生理活性研究进展[J].食品科学,2012,33(9):251-259.
[6]张唐伟,李天才.藻胆蛋白质的提取纯化与生物活性研究进展[J].生物技术通报.2010(01):9-13.
[7]徐长波,王巍杰.螺旋藻藻蓝蛋白的分离纯化研究进展[J].山东化工,2009,38(1):32-35.
[8]Casteholz RW. Culturing methods for cyanobacteria[J]. Methods of Enzymology,1988,167:68-93.
[9]Ferreira S L,Bruns RE,Ferreira H S,et al. Box-Behnkendesign:An alternative for the optimization of analytical method[J].Analytica Chimica Acta,2007,597(2):179-186.
[10]Lizotte D J,GreinerR,Schuurmans D. An experimental methodology for response surface optimization methods[J].Journal of Global Optimization,2012,53(4):699-736.
[11]朱丽萍,严世敢,李雁冰,等.硫酸铵盐析条件对多管藻R-藻红蛋白和藻蓝蛋白得率和纯度的影响[J].科技导报,2010,28(4):37-41.
[12]邵明飞,赵楠,刘冰,等. 规模化制备藻蓝蛋白工艺技术研究进展[J].食品与发酵工业,2013(2):135-139.
[13]LI Bing,Zhang Xue-cheng,Gao Mei-hua,et al. New research on extraction and purification of phycocyanin from Spirulina platensis[J].Marine Sciences,2007,31(8):48-52.
[14]Herrera A,Boussiba S,Napoleone V,et.al.Recoveroy of C-phycocyanin from the cyanobacterium Spirulina maxima[J]. Journal of Applied Phycology,1989,1:325-331.
[15]SoniB,KalavadiaB,Trivedi U,et al.Extraetion,purification and characterization of phycocyanin form Oscillatoria quadripunctulata-Isolate from the rocky shores of Bet-Dwarka,Gujarat,India[J].Process Bioehemistry,2006,41:2017-2023.
[16]张以方,刘旭川,李琦华. 螺旋藻藻蓝蛋白提取及稳定性实验[J]. 云南大学学报:自然科学版,1999,21(3):200-202.
[17]朱晓君,安辛欣,顾丽,等. 超声辅助同时提取条斑紫菜多糖及藻胆蛋白工艺的优化[J]. 食品科学,2008,29(5):241-244.
[18]李冰,张学成. 钝顶螺旋藻藻蓝蛋白提取纯化新工艺[J]. 海洋科学,2007,31:48-52.
[19]张静,韦玉春,王国祥,等.太湖蓝藻水样中藻蓝蛋白提取方法比较[J].湖泊科学2013(02):283-288.
[20]Anjum M F,Tasadduq I,Al-Sultan K. Rsponse surface methodology:A neural network approach[J].European Journal of Operational Research,1997,101(1):65-73.
[21]Chen W,Wang W P,Zhang H S,et al. Optimization of ultrasonic-assisted extraction of water-soluble polysaccharides from Boletus edulis mycelia using response surface methodology[J].Carbohydrate Polymers,2012,87(1):614-619.
[22]袁道强,黄建华.生物化学实验技术[M]. 北京:中国轻工业出版社,227-230.
[23]金怡雯,谢友坪. 螺旋藻藻蓝蛋白萃取条件的响应曲面优化[J]. 厦门大学学报:自然科学版,2014(4):593-597.
[24]孙彦. 生物分离工程[M]. 北京:化学工业出版社,2005:250.
[25]王广策,邓田,曾呈奎.藻胆蛋白的研究概括(Ⅰ)——藻胆蛋白的种类与组成[J].科学视野,2000,(24):22-25.
[26]赵小惠.聚球藻中活性化合物的分离及抗菌、抗氧化活性研究[D]. 烟台:烟台大学,2013(3):373-377.
[27]Patil G.Chethana S,Sridevi A.S,et.al.Method to obtain C-Phycocyanin of high Purity[J].Journal of Chromatography A,2006,1127:76-78.
Study on extraction and purification of C-phycocyanin inSynechococcussp.PCC 7002
LI Si-meng,GAO Feng-zheng,ZENG Ming-yong*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
In order to improve the purity and production of C-phycocyanin(C-PC)inSynechococcussp.PCC 7002,extraction and purification of C-phycocyanin inSynechococcussp.PCC 7002 was investigated. Tissue-trituration method,cycle of freezing and thawing method and ultrasonic method were applied and compared to the effection on the purity and production of C-phycocyanin. Response surface methodology(RSM)was used to optimize the best cell-disruption conditions. Futher purification was performed by means of ammonium sulphate precipitation and hydroxyapatite(HA)chromatography. The purified protein was examined through SDS-PAGE. The results showed that cycle of freezing and thawing method was the optimal cell-disruption method by the RSM experiment,the best cell-disruption conditions were that the concentration of bacteria was 3.53 mg/mL,the cycles of freezing and thawing was 6 times,the thawing temperature was 37 ℃,the best concentration of salting out was 55% ammonium sulfate,the purity of C-phycocyanin reached 3.79 through hydroxyapatite chromatography. The optimal method of extraction and purification of phycocyanin fromSynechococcussp.PCC 7002 was achieved.
Synechococcussp.PCC 7002;phycocyanin;cycle of freezing and thawing;response surface methodology;extraction and purification
2016-05-30
李思梦(1991-),女,硕士研究生,研究方向:水产品高值化利用,E-mail:478367302@qq.com。
*通讯作者:曾名湧(1965-),男,博士,教授,研究方向:水产品高值化利用,E-mail:mingyz@ouc.edu.cn。
高等学校博士学科点专项科研基金资助项目(20120132110022);山东省科技发展计划项目(2013GGE29003)。
TS254
A
1002-0306(2016)23-0096-08
10.13386/j.issn1002-0306.2016.23.010
