蓝莓成熟过程中花色苷组分的变化
2016-02-09徐玉娟吴继军移兰丽李春美肖更生
曾 丹,邹 波,徐玉娟,吴继军,移兰丽,李春美,肖更生,*
(1.广东省农业科学院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广东广州 510610;2.华中农业大学食品科技学院,湖北武汉 430070)
蓝莓成熟过程中花色苷组分的变化
曾 丹1,2,邹 波1,徐玉娟1,吴继军1,移兰丽1,李春美2,肖更生1,*
(1.广东省农业科学院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广东广州 510610;2.华中农业大学食品科技学院,湖北武汉 430070)
通过分析研究不同成熟度蓝莓果实的总花色苷含量及其花色苷组分的动态变化规律,以期为蓝莓采收和加工提供参考。采用pH示差法测得不同成熟度蓝莓的总花色苷含量,高效液相色谱质谱联用(HPLC-MS/MS)确定单个花色苷结构,用HPLC定量分析单个花色苷含量。结果表明:随着蓝莓果成熟度的增加,花色苷合成速率不断加快,花色苷含量逐渐积累,紫黑期含量达到最大值2827 mg/kg;蓝莓成熟过程中共有15种花色苷,分别为飞燕草色素、矢车菊色素、矮牵牛花色素、芍药色素、锦葵色素这5种花色苷元所连接的半乳糖、葡萄糖和阿拉伯糖3种糖残基;在蓝莓发育过程中,飞燕草素类、矮牵牛花素类、芍药素类、锦葵素类均呈显著增长趋势,而矢车菊素类增长至成熟后期开始明显减少。
蓝莓,花色苷,结构,成熟度
蓝莓又名越橘,属杜鹃花科(Ericaceae),越橘属(Vacciniumspp.)小浆果类[1],原产于北美、苏格兰和俄罗斯,为灌木,耐寒性及适应性极强,也有一部分蓝莓品种能耐一定程度的高温,是一种天然的野生资源[2]。近年来,我国蓝莓产业迅速发展,栽培区域广泛,东北地区、山东、江浙一带等均有种植[3]。广东地区雨量充沛,气候温暖,且具有大面积的酸性土壤,适合部分品种的蓝莓种植。目前在广东河源灯塔盆地已经成功种植蓝莓。
蓝莓果实中含有丰富的营养成分,其所含的花色苷、酚酸、黄酮等酚类化合物,具有抗氧化[4]、降血压[5]、抗癌[6]、保护视力[7]等功效,是世界粮农组织推荐的五大健康水果之一[8-9]。近年来,国内外对蓝莓花色苷的研究日益增多,如Liang[10]等研究了蓝莓花色苷降胆固醇是通过增强甾醇的排泄,同时下调NPC1L1,ACAT-2,MTP和ABCG 5/8等基因在肠道中的表达(NPC1L1将胆固醇从内脏运输到肠细胞,在肠细胞中通过ACAT-2胆固醇被转化为胆固醇脂;MTP把胆固醇脂运送给脂蛋白然后通过淋巴系统被吸收;ABCG 5/8运回肠细胞未吸收的胆固醇给肝脏);Ribnicky[11]等建立了TNO肠道模型(荷兰国家应用科学院的肠道模型,TIM-1),发现富含蛋白质的脱脂大豆粉对蓝莓花色苷在经过上消化道时具有保护作用;Kazan[12]等发现蓝莓汁的半抑制浓度对MCF-7(人乳腺癌细胞系)的作用与商业抗癌药品阿霉素相似。这些主要是研究蓝莓的生物活性,而有关不同成熟度蓝莓中花色苷种类的研究也很少见,并且品种和地区的差异也会导致蓝莓果中花色苷的种类及含量有所不同。目前,地处亚热带地区的广东河源引种蓝莓成功,但其成熟过程中花色苷的种类及含量未见报道。针对以上问题,本研究以该地区蓝莓为原料,探究了蓝莓成熟过程中花色苷的种类及含量的变化规律,为蓝莓果实加工及对花色苷的高效利用提供理论依据。
1 材料与方法
1.1 材料与仪器
兔眼蓝莓(Vacciniumspp.) 采摘于广东省河源市蓝莓果园;Folin-Ciocalteu试剂 上海源叶生物科技有限公司;飞燕草素半乳糖苷(Dp-gal),飞燕草素葡糖苷(Dp-glc),飞燕草素阿拉伯糖苷(Dp-ara),矢车菊素半乳糖苷(Cy-gal),矢车菊素葡糖苷(Cy-glc),矢车菊素阿拉伯糖苷(Cy-ara),矮牵牛花素半乳糖苷(Pet-gal),矮牵牛花素葡糖苷(Pet-glc),矮牵牛花素阿拉伯糖苷(Pet-ara),芍药素半乳糖苷(Peo-gal),芍药素葡糖苷(Peo-glc),芍药素阿拉伯糖苷(Peo-ara),锦葵素半乳糖苷(Mv-gal),锦葵素葡糖苷(Mv-glc),锦葵素阿拉伯糖苷(Mv-ara) 购于日本Funakoshi公司;乙腈(色谱纯) 美国Tedia公司;磷酸(色谱纯) 天津市科密欧化学试剂有限公司;甲酸(液相质谱纯)和乙腈(液相质谱纯) 购于德国Merck公司;其它试剂均为国产分析纯。
UV-1800型分光光度计 日本岛津公司;PB-10型pH计 赛多利斯公司;Biofuge Stratos Sorvall型台式高速冷冻离心机 Thermo Fisher Scientific公司;FS100S粉碎机 广州雷迈机械设备有限公司;LC-20A高效液相色谱仪 日本岛津公司;液质联用仪 HPLC-MS/MS,德国布鲁克公司。
1.2 实验方法
1.2.1 花色苷的提取 蓝莓洗净,自然晾干,液氮粉碎,称取粉碎后的样品5 g,用100 mL 50%(v/v)的乙醇(含0.5%的盐酸)超声波提取10 min,在4 ℃下5000 r/min离心10 min,沉淀继续提取两次,合并提取液。
1.2.2 花色苷总含量的测定 参照Giusti M[13]等的方法,取等体积待测样品,分别加入0.25 mol/L的KCl(浓盐酸调至pH1.0)和0.4 mol/L的CH3COONa(浓盐酸调至pH4.5)溶液,混合均匀,室温避光放置15 min,测定510 nm和700 nm处的吸光值。总花色苷含量(total anthocyanins content,TAC)按矢车菊素-3-葡萄糖苷表示,按如下公式[14]计算。
总花色苷含量(mg/kg)={(A510 nm-A700 nm}pH1-(A510 nm-A700 nm)pH4.5×M×DF×V×1000/ε×m×l
式中:M为矢车菊素-3-葡萄糖苷的摩尔质量(449.2 g/mol);DF为稀释倍数;V为提取液总体积(mL);ε为矢车菊素-3-葡萄糖苷的平均摩尔消光系数(26900 L/(mol·cm));l为1 cm光程比色皿;m蓝莓质量(g)。
1.2.3 HPLC-DAD分析单个花色苷含量 仪器为LC-20AT(日本岛津);色谱柱:Kinetex C18柱(150 mm× 4.6 mm,2.6 μm,美国菲罗门);流动相A为1.2%的磷酸溶液,流动相B为乙腈。梯度洗脱程序见表1,每个样品之间平衡15 min,进样量10 μL,流速0.5 mL/min,检测波长520 nm,柱温35 ℃。外标法定量分析单个花色苷的含量,称取一定量的标准品,分别用甲醇溶解,然后配置成混标,甲醇稀释至不同浓度,HPLC分析,根据标准品的浓度和峰面积绘制标准曲线,标曲浓度范围为2.5~100 μg/mL。
1.2.4 HPLC-MS/MS鉴定花色苷结构 HPLC-MS/MS分析蓝莓花色苷的组成。仪器为安捷伦1260 HPLC(美国安捷伦公司)串联布鲁克amaZon SL离子阱质谱仪(德国布鲁克公司);色谱柱:Kinetex C18柱(150 mm×4.6 mm,2.6 μm,美国菲罗门);流动相A为0.5%的三氟乙酸溶液,流动相B为乙腈。梯度洗脱程序见表1,每个样品之间平衡15 min,进样量10 μL,流速0.6 mL/min,检测波长520 nm,柱温35 ℃。质谱条件:电喷雾电离离子源(ESI),正离子扫描模式,扫描范围100~1000 u,毛细管电压4.5 kv,雾化器压力1.5 bar,干燥温度220 ℃,干燥气体流速6.0 L/min。
表1 HPLC和HPLC-MS/MS的梯度洗脱程序
Table 1 Gradient elution program of HPLC and HPLC-MS/MS
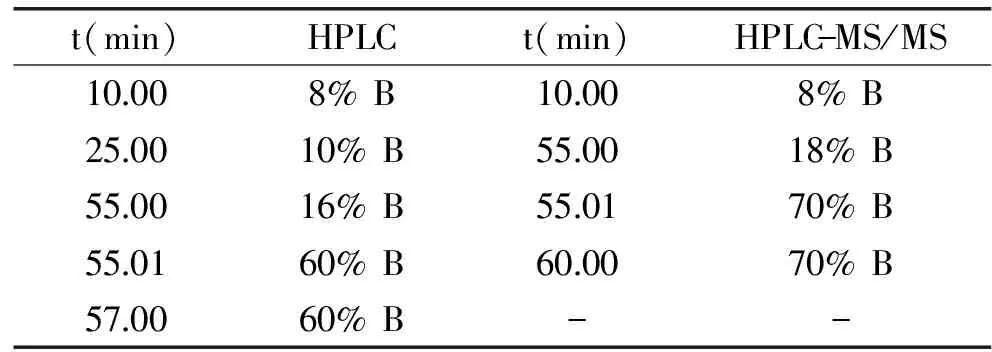
t(min)HPLCt(min)HPLC-MS/MS10008%B10008%B250010%B550018%B550016%B550170%B550160%B600070%B570060%B--
1.3 数据分析
实验数据采用SPSS 18.0软件进行统计分析,实验重复三次,结果以平均值±标准差表示。
2 结果与分析
2.1 不同成熟度蓝莓总花色苷含量的动态变化
不同发育期总花色苷含量变化趋势见图1。从鲜红期到紫黑期阶段,蓝莓中花色苷大量合成,随着成熟度的增加,花色苷合成速率加快,花色苷含量逐渐积累,紫黑期含量达到最大。蓝莓中花色苷主要在鲜红期到紫黑期阶段合成,在此发育阶段合成速率最高且合成量最大,总花色苷含量达2827 mg/kg,是粉红期的7.7倍。葡萄[15]、桑葚[16]等浆果类在成熟过程中总花色苷含量也呈现上升趋势,这与我们的研究结果类似。Jin[17]等检测了45种韩国种植的商业蓝莓,品种为北高丛和南高丛,其总花色苷含量为1676~6778 mg/kg,其中Croatan、Sierra等品种与我们的结果相近,这说明不同品种的蓝莓果,总花色苷的含量差异明显。Howard[18]等的研究也表明品种对花色苷的影响较大,其次,果实相对小的蓝莓其花色苷含量较高。另外,种植条件如灌溉、温度等对蓝莓花色苷的合成也有一定的影响。
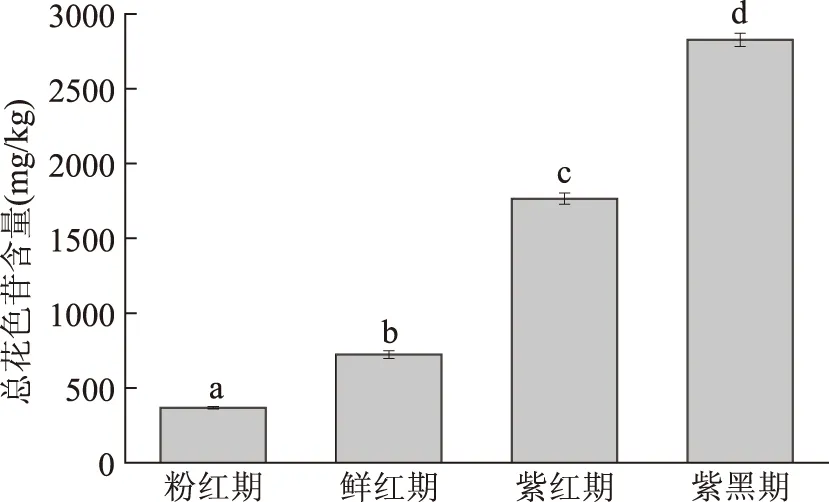
图1 蓝莓发育过程中总花色苷含量的变化Fig.1 Changes in total anthocyanins of blueberry during the ripening process 注:字母不同表示差异显著(p<0.05)。
2.2 蓝莓花色苷结构鉴定
为了研究蓝莓成熟过程中单个花色苷的变化规律,我们首先采用HPLC-MS/MS对花色苷的结构进行了鉴定。花色苷的结构根据分子离子峰、碎片以及标准品的保留时间来确定。以峰1、峰2和峰4为例,其分子离子[M]+分别为m/z 465.1、465.0、435.1,碎片离子均为飞燕草素的特征离子m/z 303,丢失碎片m/z 162为葡萄糖苷或半乳糖苷,m/z 132为阿拉伯糖苷,根据标准品的对照时间,结合资料分析[19-20],可以判断峰1、峰2和峰4分别为飞燕草素半乳糖苷,飞燕草素葡糖苷,飞燕草素阿拉伯糖苷。其他的结构鉴定类似,结果见图2和表2。其中峰11和峰12的MS数据均有两个分子离子峰,通过其分子碎片的不同和HPLC分析(图3),推测分别为芍药素葡糖苷、锦葵素半乳糖苷、芍药素阿拉伯糖苷、锦葵素葡糖苷。不同时期的蓝莓均有15种花色苷,色谱信息见图3。其中飞燕草素类(Dp)3种,分别为飞燕草素半乳糖苷(峰1),飞燕草素葡糖苷(峰2)和飞燕草素阿拉伯糖苷(峰4);矢车菊素类(Cy)3种,分别为矢车菊素半乳糖苷(峰3),矢车菊素葡糖苷(峰5)和矢车菊素阿拉伯糖苷(峰7);矮牵牛花类(Pt)3种,分别为矮牵牛花半乳糖苷(峰6),矮牵牛花葡糖苷(峰8)和矮牵牛花阿拉伯糖苷(峰10);芍药素类(Peo)3种,为芍药素半乳糖苷(峰9),芍药素葡糖苷(峰11)和芍药素阿拉伯糖苷(峰13);锦葵素类(Mv)3种,分别为锦葵素半乳糖苷(峰12),锦葵素葡糖苷(峰14)和锦葵素阿拉伯糖苷(峰15)。
表2 蓝莓果花色苷HPLC-MS/MS分离鉴定结果
Table 2 HPLC-MS/MS results of isolation and identification of anthocyanins from blueberry

峰号保留时间(min)分子离子M+(m/z)分子碎片(m/z)丢失碎片(m/z)推测结构126046513031162Dp-gal228846503031162Dp-glc331644912871162Cy-gal432843513031132Dp-ara534944912870162Cy-glc635747913170162Pet-gal738141912871132Cy-ara838547913171162Pet-glc940936313011162Peo-gal1042044913170132Pet-ara1144146313011162Peo-glc1244149313311163Mv-gal1347143313011132Peo-ara1447149303310162Mv-glc1550246313311132Mv-ara
注:Dp-飞燕草素;Cy-矢车菊素;Pt-矮牵牛花;Pn-芍药素;Mv-锦葵素;gal-半乳糖苷;glc-葡萄糖苷;ara-阿拉伯糖苷。
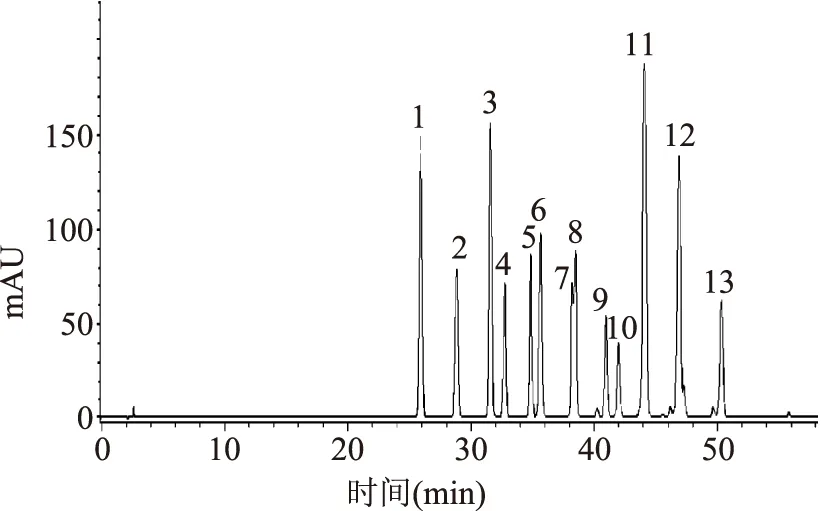
图2 蓝莓果实发育过程中花色苷HPLC-MS/MS色谱图Fig.2 HPLC-MS/MS chromatogram of anthocyanins during the ripening process of Blueberry
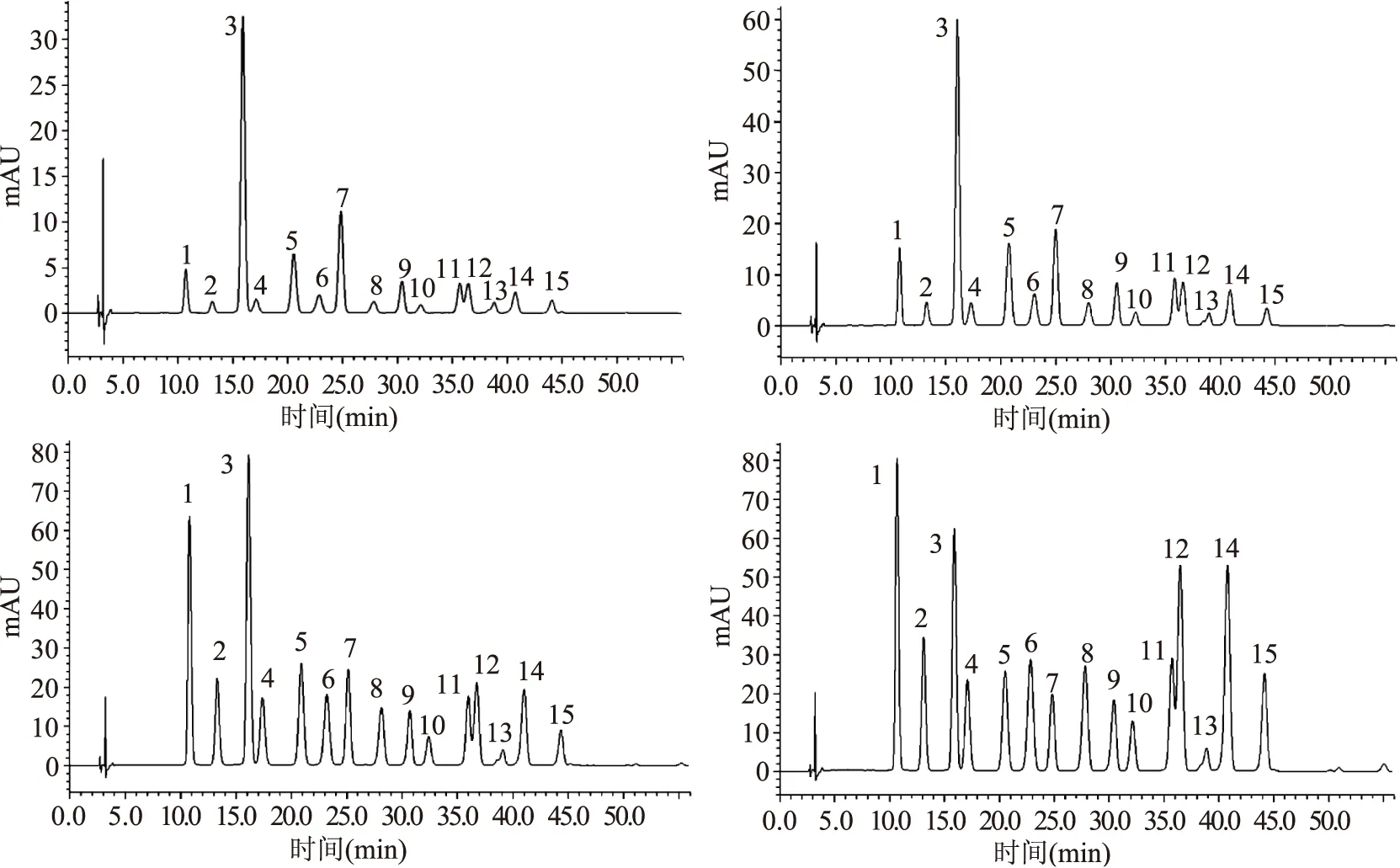
图3 蓝莓果实发育过程中花色苷组分HPLC色谱图Fig.3 HPLC chromatogram of anthocyanins during the ripening process of Blueberry 注:1-Dp-gal;2-Dp-glc;3-Cy-gal;4-Dp-ara;5-Cy-glc;6-Pet-gal;7-Cy-ara;8-Pet-glc; 9-Peo-gal;10-Pet-ara;11-Peo-glc;12-Mv-gal;13-Peo-ara;14-Mv-glc;15-Mv-ara。
张扬[21]等和Liu[22]等分别从蓝莓果中鉴定了11、13种花色苷,分别为飞燕草素类、矢车菊素类、矮牵牛花类、芍药素类、锦葵素类,这与我们结果类似;但Nicoue[19]等从蓝莓果中分离鉴定了20种花色苷,除了上述提到的三种糖苷所连的5类花色苷,还鉴定出了飞燕草素己糖、飞燕草素乙二酰己糖、矢车菊素丙酰半乳糖苷、矢车菊素丙二酰半乳糖苷、矮牵牛花丙酰半乳糖苷、矮牵牛花丙酰己糖、矮牵牛花乙酰葡萄糖苷、芍药素丁二酰阿拉伯糖苷、芍药素乙二酰半乳糖苷、锦葵素乙酰己糖,这说明了蓝莓果中所含的花色苷种类有差异。
表3 蓝莓果实发育过程中花色苷组分及其含量变化
Table 3 Changes of anthocyanin components and their contents during the ripening process of Blueberry
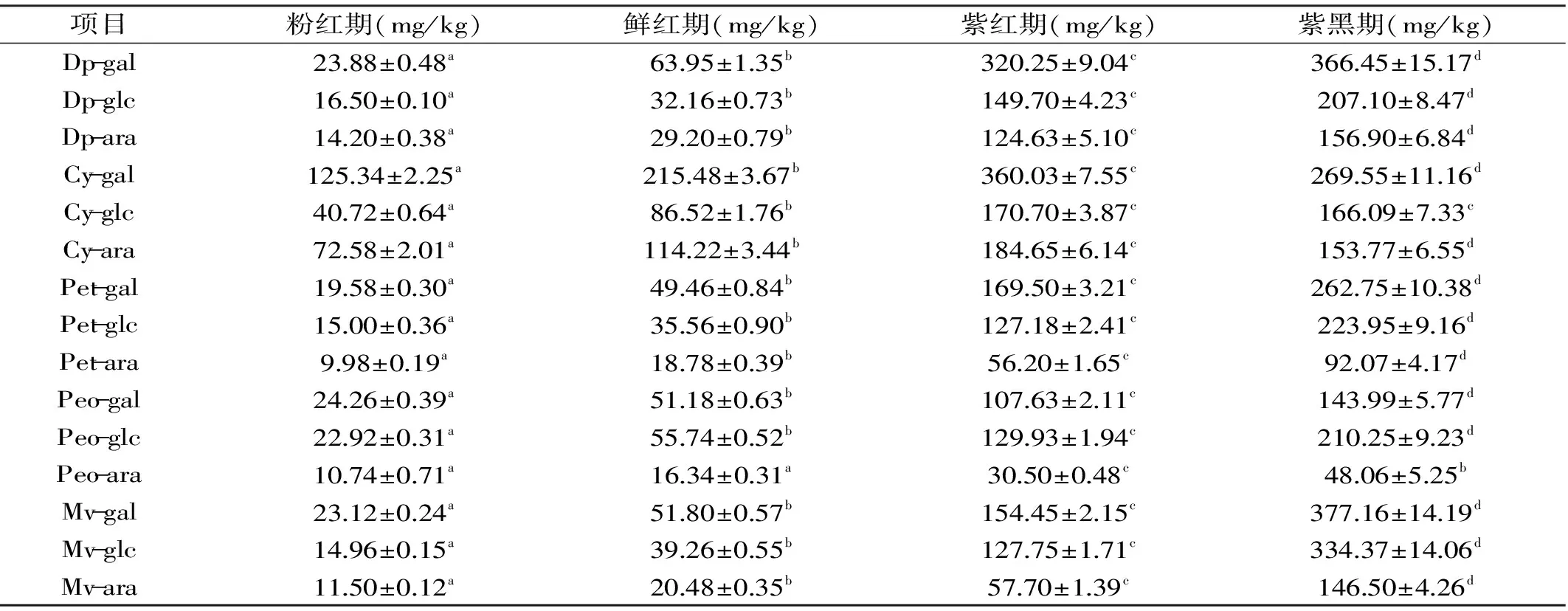
项目粉红期(mg/kg)鲜红期(mg/kg)紫红期(mg/kg)紫黑期(mg/kg)Dp-gal2388±048a6395±135b32025±904c36645±1517dDp-glc1650±010a3216±073b14970±423c20710±847dDp-ara1420±038a2920±079b12463±510c15690±684dCy-gal12534±225a21548±367b36003±755c26955±1116dCy-glc4072±064a8652±176b17070±387c16609±733cCy-ara7258±201a11422±344b18465±614c15377±655dPet-gal1958±030a4946±084b16950±321c26275±1038dPet-glc1500±036a3556±090b12718±241c22395±916dPet-ara998±019a1878±039b5620±165c9207±417dPeo-gal2426±039a5118±063b10763±211c14399±577dPeo-glc2292±031a5574±052b12993±194c21025±923dPeo-ara1074±071a1634±031a3050±048c4806±525bMv-gal2312±024a5180±057b15445±215c37716±1419dMv-glc1496±015a3926±055b12775±171c33437±1406dMv-ara1150±012a2048±035b5770±139c14650±426d
注:同一行的字母不同表示差异显著(p<0.05)。 Dp-飞燕草素;Cy-矢车菊素;Pt-矮牵牛花;Pn-芍药素;Mv-锦葵素;gal-半乳糖苷;glc-葡萄糖苷;ara-阿拉伯糖苷。
2.3 不同成熟度蓝莓中花色苷组分的定量分析
表3可以看出,飞燕草素类、矮牵牛花素类、芍药素类和锦葵素类,粉红期到紫黑期含量一直呈增长趋势,分别从54.58 mg/kg增长到730.45 mg/kg;44.56 mg/kg增长到578.77 mg/kg;57.92 mg/kg增长到402.30 mg/kg;49.58 mg/kg增长到858.03 mg/kg;而矢车菊素类,从粉红期至紫红期含量呈增长趋势,紫红期至紫黑期含量又呈下降的趋势。飞燕草素类主要是在鲜红期至紫红期显著增长;矢车菊素类可能是蓝莓果中比较先合成的花色苷,在粉红期其含量占总花色苷的53.59%,远远高于其它花色苷,并持续增长至紫红期,到紫黑期明显下降。矮牵牛花素类和锦葵素类主要是在鲜红期至紫黑期合成积累,其含量在紫红期到紫黑期显著增多,在紫黑期,锦葵素类花色苷含量最高,占27.16%。此外蓝莓果中这几种花色苷元(除芍药素类)与半乳糖残基相连的含量最高,与阿拉伯糖残基相连的含量最低;而与芍药素相连的葡萄糖残基含量最高。蓝莓果中单个花色苷含量的动态变化规律与总花色苷含量的变化规律大体一致;Müller[23]等的研究表明成熟的蓝莓果中锦葵素阿拉伯糖苷和矮牵牛花半乳糖苷的含量更高,这说明不同品种不同地区的蓝莓果中花色苷组分也存在差异。
3 结论
研究结果表明,蓝莓果在紫黑期总花色苷含量最高,达2827 mg/kg,为最佳收获期。蓝莓果发育过程中,花色苷从粉红期开始大量合成,随着成熟度的增加花色苷的合成速率加快到紫黑期含量达到最大。在蓝莓的生长过程中共检测出15种花色苷,分别为矢车菊色素、飞燕草色素、矮牵牛花色素、芍药色素、锦葵色素这5种花色苷元所连接的3种糖基。从粉红期至紫黑期,蓝莓果中花色苷组分飞燕草素类、矮牵牛花素类、芍药素类、锦葵素类所连接的3种糖残基形成的糖苷含量均是持续增长的状态;而矢车菊素所连接的3种糖残基形成的糖苷含量在成熟后期,既紫红期至紫黑期,明显减少。因此对这一时期蓝莓果中花色苷类物质的合成及与其他化合物直接的相互转化还有待进一步研究。
[1]Hashim J. Blueberry production gaining in California[J]. Western Farm Press,2004(8).
[2]陈卫. 蓝莓及其营养保健功能[J]. 中外食品,2003(7):34-35.
[3]李安文. 蓝莓花色苷稳定性及分离纯化技术研究[D]. 长沙:湖南农业大学,2011:1-2.
[4]李颖畅. 蓝莓花色苷提取纯化及生理功能研究[D]. 沈阳:沈阳农业大学,2008.
[5]马立志,李金星,刘志刚,等. 蓝莓果汁及不同纯度蓝莓花色苷对原发性高血压大鼠血压的影响[J]. 食品科学,2014,35(19):266-271.
[6]陈琦,李少伟,贾宇臣,等. 蓝莓花青素通过下调p53基因DNA甲基化抑制口腔癌KB细胞增殖及诱导细胞凋亡[J]. 遗传,2014,36(6):566-573.
[7]Hwang J W,Kim E K,Lee S J,et al. Antioxidant activity and protective effect of anthocyanin oligomers on H2O2-triggered G2/M arrest in retinal cells[J]. Journal of Agricultural & Food Chemistry,2012,60(17):4282-4288.
[8]史海芝,刘惠民. 国内外蓝莓研究现状[J]. 江苏林业科技,2009,36(4):48-51.
[9]刘萌,范新光,王美兰,等. 不同包装方法对蓝莓采后生理及贮藏效果的影响[J]. 食品科学,2013,34(14):346-350.
[10]Liang Y,Chen J,Zuo Y,et al. Blueberry anthocyanins at doses of 0.5 and 1% lowered plasma cholesterol by increasing fecal excretion of acidic and neutral sterols in hamsters fed a cholesterol-enriched diet[J]. European Journal of Nutrition,2013,52(3):869-875.
[11]Ribnicky D M,Roopchand D E,Oren A,et al. Effects of a high fat meal matrix and protein complexation on the bioaccessibility of blueberry anthocyanins using the TNO gastrointestinal model(TIM-1)[J]. Food Chemistry,2014,142(1):349-357.
[12]Kazan A,Sevimli-Gur C,Yesil-Celiktas O,et al. Investigating anthocyanin contents andinvitrotumor suppression properties of blueberry extracts prepared by various processes[J]. European Food Research & Technology,2016,242(5),693-701.
[13]Giusti M M,Wrolstad R E. Characterization and Measurement of Anthocyanins by UV-Visible Spectroscopy[M]//Current Protocols in Food Analytical Chemistry. 2001:63-69.
[14]殷丽琴,韦献雅,钟成,等. 不同品种彩色马铃薯总花色苷含量与总抗氧化活性[J]. 食品科学,2014,35(5):96-100.
[15]刘旭,杨丽,张芳芳,等. 酿酒葡萄成熟期间果实质地特性和花色苷含量变化[J]. 食品科学,2015,36(2):105-109.
[16]肖更生,王振江,唐翠明,等. 桑椹成熟过程中主要色素类物质的动态变化[J]. 蚕业科学,2011,37(4):600-605.
[17]Jin G K,Hong L K,Su J K,et al. Fruit quality,anthocyanin and total phenolic contents,and antioxidant activities of 45 blueberry cultivars grown in Suwon,Korea[J]. Journal of Zhejiang Universityence B,2013,14(9):793-799.
[18]Howard L R,Clark J R,Brownmiller C. Antioxidant capacity and phenolic content in blueberries as affected by genotype and growing season[J]. Journal of the Science of Food & Agriculture,2003,83(12):1238-1247.
[19]Nicoue E E,Savard S,Belkacemi K. Anthocyanins in wild blueberries of Quebec:extraction and identification[J]. Journal of Agricultural and Food Chemistry,2007,55(14):5626-5635.
[20]Barnes J S,Nguyen H P,Shen S,et al. General method for extraction of blueberry anthocyanins and identification using high performance liquid chromatography-electrospray ionization-ion trap-time of flight-mass spectrometry[J]. Journal of Chromatography A,2009,1216(23):4728-4735.
[21]张杨,谢笔钧,孙智达. 蓝莓酒渣、果、酒中花色苷成分鉴定及酒渣与果中花色苷抗氧化活性比较[J]. 食品科学,2016,37(2):165-171.
[22]Liu Y,Song X,Han Y,et al. Identification of Anthocyanin Components of Wild Chinese Blueberries and Amelioration of Light-Induced Retinal Damage in Pigmented Rabbit Using Whole Berries[J]. Journal of Agricultural & Food Chemistry,2011,59(1):356-63.
[23]Müller D,Schantz M,Richling E. High Performance Liquid Chromatography Analysis of Anthocyanins in Bilberries[J]. Journal of Food Science,2012,volume 77(4):C340-C345(6).
Changes in anthocyanin components of
blueberry during ripening process
ZENG Dan1,2,ZOU Bo1,XU Yu-juan1,WU Ji-jun1,YI Lan-li1,LI Chun-mei2,XIAO Geng-sheng1,*
(1.Sericultural & Agri-Food Research Institute Guangdong Academy of Agricultural Sciences/Key Laboratory of Functional Foods,Ministry of Agriculture/Guangdong Key Laboratory of Agricultural Products Processing,Guangzhou 510610,China; 2.College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China)
The changes in total anthocyanins and anthocyanin components of blueberry during the ripening process were studied to provide experimental basis and reference for blueberry harvest. Total anthocyanins content in different maturity blueberry were measured by pH differential method,the structure of individual anthocyanins were determined by HPLC-MS/MS and quantitatively analysed by high performance liquid chromatography(HPLC). The results showed that anthocyanin synthesis was accelerated with the increase of blueberry maturity,and anthocyanin content was gradually accumulated and reached a peak value of 2827 mg/kg at purple black stage. There were 15 kinds of anthocyanins during the ripening process of blueberry,delphinidin,cyaniding,petunidin,malvidin and peonidin pigment and their linked galactose,glucose and arabinose,respectively. During the ripening process of blueberry,delphinidin,petunidin,peonidin and malvidin class were increased,but cyanidin class were decreased in mature later stage.
blueberry;anthocyanin;structure;maturity
2016-06-01
曾丹(1991-),女,硕士研究生,研究方向为植物多酚化学,E-mail:zdmail.hzau.edu.cn@webmail.hzau.edu.cn。
*通讯作者:肖更生(1965-),男,硕士,研究员,研究方向:农产品深加工,E-mail:244520460@qq.com。
广东省科技计划项目(2013B020203001,2014A020209060);广州市科技计划项目(201510010063)。
TS201.1
A
1002-0306(2016)23-0086-05
10.13386/j.issn1002-0306.2016.23.008
