杂交构树体细胞胚诱导研究
2016-02-09张朝晖张宗申
张朝晖,张宗申,陈 阳,李 毅
(大连工业大学 生物工程学院/辽宁省发酵工程重点实验室,辽宁 大连 116034)
杂交构树体细胞胚诱导研究
张朝晖,张宗申*,陈 阳,李 毅
(大连工业大学 生物工程学院/辽宁省发酵工程重点实验室,辽宁 大连 116034)
以杂交构树叶片为材料,建立通过愈伤组织制备体细胞胚的技术途径。结果表明,光照强度750 lx、构树幼叶面积4~5 cm2有利于诱导愈伤组织。最佳诱导培养基为MS+0.2 mg/L 6-BA+1.0 mg/L 2,4-D,pH值6.0,其愈伤组织诱导率达94.6%。构树愈伤组织最佳继代培养基为MS+0.2 mg/L 6-BA+0.1 mg/L KT,pH值6.2,愈伤组织增殖速度快。选择表面颗粒多、质地松软、浅黄色或白色的愈伤组织进行体细胞胚诱导,最佳诱导培养基为MS+2.0 mg/L 6-BA+1.0 mg/L NAA,pH值6.4,体细胞胚的发生频率达到96.0%。
杂交构树; 愈伤组织; 体细胞胚
构树[Broussonetiapapyrifera(L.)L’ Herit]属桑科(Moraceae)植物,是园林绿化的优良树种[1],同时可作为造纸、加工青储饲料和提取降糖药物等原材料[2-4]。构树种苗的市场需求量很大,但目前构树种苗繁育的主要方式依旧是传统扦插方式,不但耗时费力、繁育周期长、占用土地面积广,而且存在季节性限制问题。因此仅仅依靠扦插等传统育苗方式很难满足市场对构树种苗的需求[5]。同时近几年人们尝试采用组培技术进行构树种苗的快繁育种,虽然提高了种苗的繁殖效率,但仍然存在着人工成本过高等问题。
以体细胞胚为材料制备人工种子的细胞工程技术成为解决构树种苗繁育问题的有力工具之一。体细胞胚是由孢子体或配子体的细胞通过无性繁殖产生的一种类似于合子胚的结构,与合子胚一样具有原胚、心形胚、鱼雷胚及具子叶的成熟胚的发育程序[6]。植物组织、单细胞、原生质体和花粉等培养过程中都有体细胞胚发生[7-10],发生途径包括从组织或细胞直接发生和经过愈伤组织阶段再分化为体细胞胚2种途径[11]。体细胞胚可以在生物反应器中通过悬浮方式进行培养,培养密度可以达到11 000个/L甚至更高,而且整个培养过程可以实现自动化控制,既提高了效率又降低了培养的人工成本[12]。通过体细胞胚诱导方式进行育种的可行性,已经在东北矮紫衫的育种过程中得到充分证明[13-14]。因此,将该技术体系应用于构树种苗生产,可以解决传统繁育中存在的系列问题。本研究以杂交构树为试验材料,通过愈伤组织诱导培养和体细胞胚分化培养,建立可行、易操作、高效率的构树体细胞胚诱导技术体系,为获得大量植株再生苗或制备人工种子提供技术保障。
1 材料和方法
1.1 材料
试验材料为杂交构树组培苗,由大连工业大学药用植物细胞工程实验室提供;6-BA、2,4-D、NAA和KT等植物生长调节剂购自江苏省激素研究所股份有限公司。
1.2 方法
1.2.1 植物生长调节剂对愈伤组织诱导的影响 选择MS作为基本培养基,附加不同质量浓度的6-BA、2,4-D(表1),添加蔗糖30 g/L、琼脂5 g/L,每种组合10瓶,每瓶接种5枚构树叶片。培养条件:温度(24±1) ℃,光照强度1 500 lx,光照周期12 h/d。培养20 d,观察记录愈伤组织诱导情况,统计出现愈伤组织的数量,并计算诱导率。

表1 构树愈伤组织诱导正交试验因素和水平
1.2.2 外植体大小及光照条件对愈伤组织诱导的影响 将外植体叶片大小设定为1 cm2、2~3 cm2、4~5 cm23个水平,光照条件设为强光培养(A组,白炽灯直射光照强度2 500 lx)、弱光培养(B组,白炽灯非直射光照强度750 lx)和黑暗培养(C组)3个水平,光照周期设定为12 h/d,共进行9组试验,每组重复10瓶,培养温度(24±1)℃。培养20 d,观察记录愈伤组织诱导情况并计算诱导率。
1.2.3 构树愈伤组织继代培养基的筛选 以MS为基本培养基,附加不同质量浓度的6-BA和KT(表2),其中添加蔗糖30 g/L、琼脂5 g/L,pH值调至6.2;温度(24±1)℃;黑暗培养;继代周期为20 d。每组试验配制20瓶培养基,每瓶接种5~8块愈伤组织,单块愈伤组织体积为0.5 cm×0.5 cm×0.5 cm。经过1个继代周期培养后,观察并统计愈伤组织生长状态。
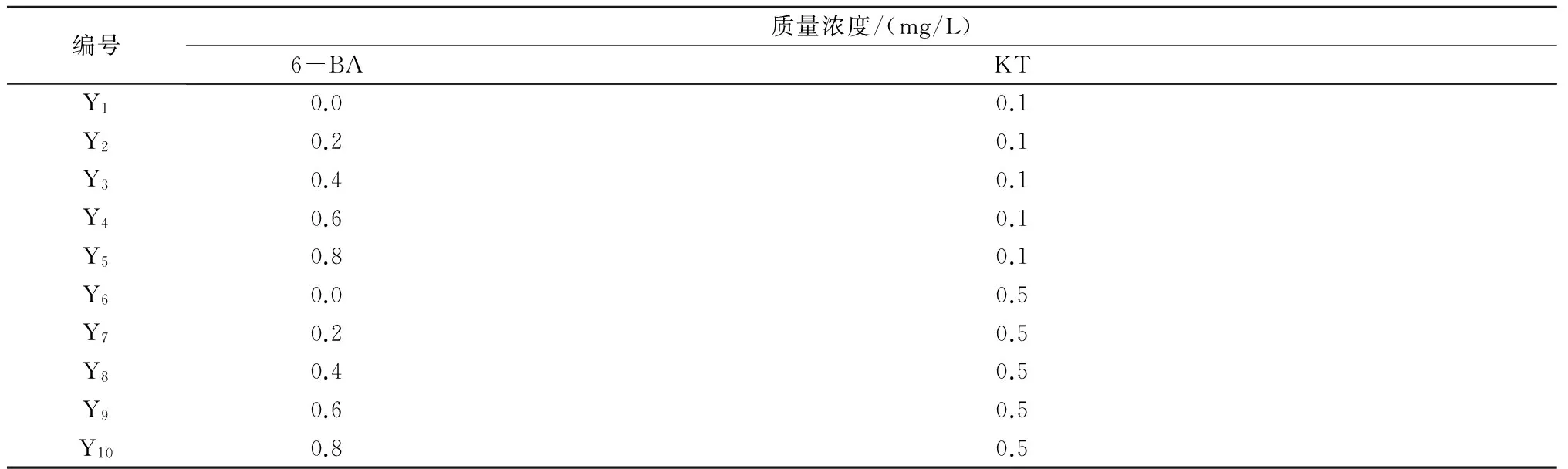
表2 构树愈伤组织继代培养植物生长调节剂处理
1.2.4 构树体细胞胚的诱导 选取经过继代培养2~3次、质地疏松易碎、生长状态良好的块状构树愈伤组织,培养条件:以MS为基本培养基,附加不同质量浓度NAA、6-BA(表3),其中添加蔗糖30 g/L、琼脂5 g/L,pH值调至6.2;温度(24±1)℃。每种组合10瓶,每瓶接种5块愈伤组织。
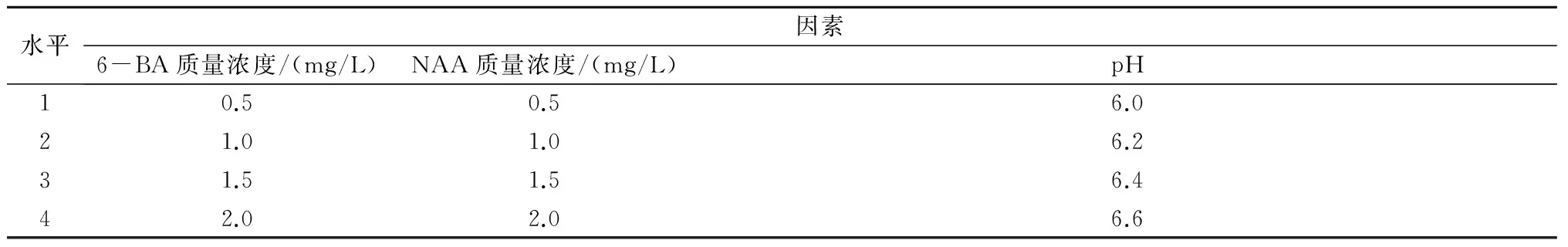
表3 构树体细胞胚诱导正交试验因素和水平
1.2.5 构树体细胞胚诱导效果的评定指标 经诱导培养35 d后,选取3个指标用于评估体细胞胚的诱导效果:体细胞胚发生频率、体细胞胚平均数量、体细胞胚发生效率。体细胞胚发生频率=有体细胞胚发生的外植体样本数/接种外植体样本数×100%,体细胞胚平均数量=发生体细胞胚的总数/有体细胞胚发生的外植体样本数,体细胞胚发生效率=体细胞胚发生频率×体细胞胚平均数量。
2 结果与分析
2.1 植物生长调节剂对构树愈伤组织诱导的影响
构树叶片在16种不同组合的培养基中均能成功诱导出愈伤组织。在诱导过程中,培养5 d后即可观察到外植体与培养基接触部位开始膨胀,出现淡黄色颗粒;培养10 d后,外植体表面聚集大量淡黄色或白色颗粒,即为胚性愈伤组织;培养17 d后,愈伤组织开始出现褐化现象,表明开始进入生长末期。从表4可以看出,各因素对构树愈伤组织诱导率的影响大小为:6-BA>pH值>2,4-D。从诱导率的极差分析结果可知,构树愈伤组织诱导的最佳精品培养基为:MS+0.2 mg/L 6-BA+1.0 mg/L 2,4-D,pH值6.0。通过验证试验,最佳培养基的愈伤诱导率可达94.6%,而16组处理的平均愈伤组织诱导率仅为65.5%。
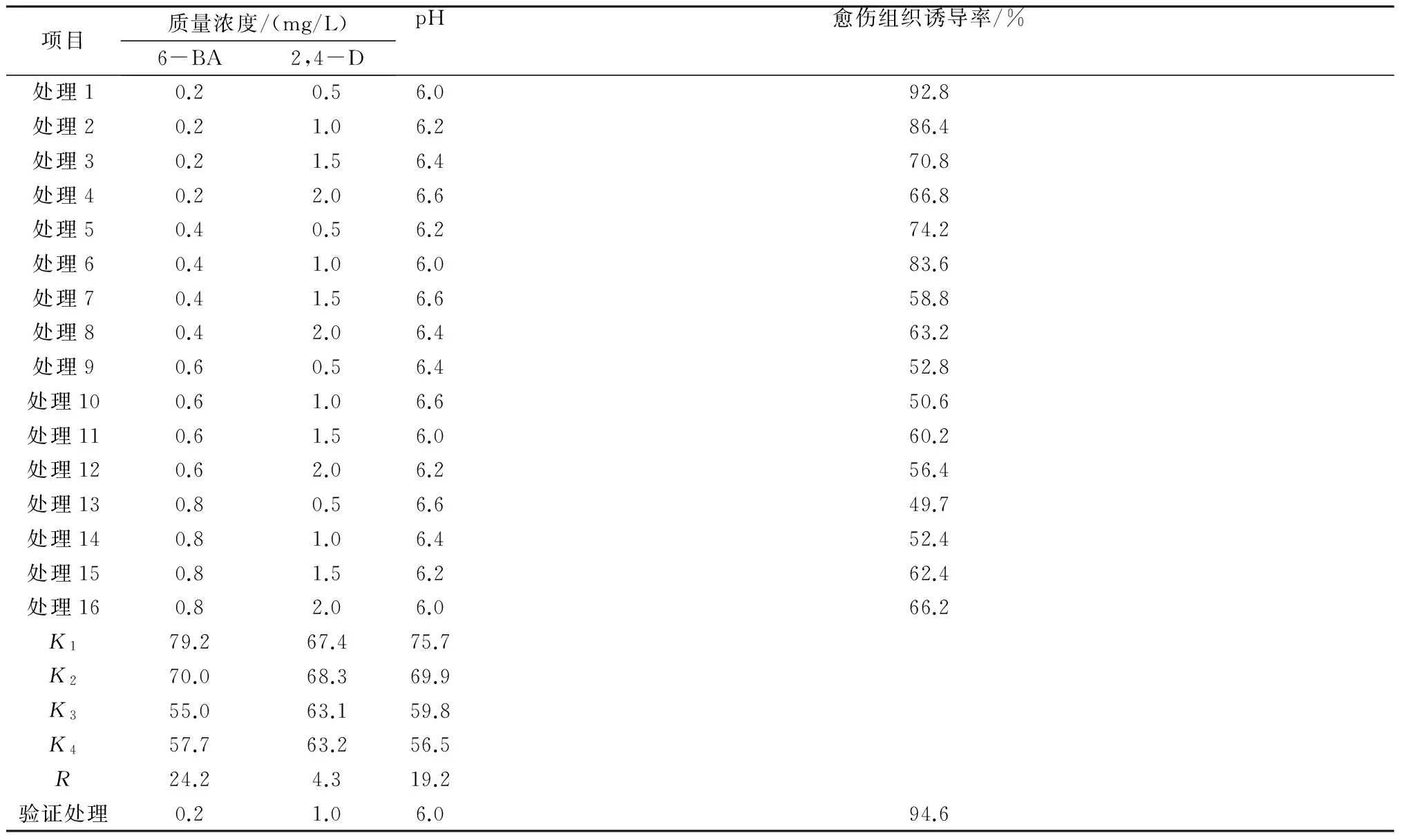
表4 愈伤组织诱导的正交优化结果
2.2 外植体大小与光照对构树愈伤组织诱导的影响
在上述优化植物生长调节剂组合与pH值的培养基基础上,进一步研究外植体大小与光照条件对愈伤组织诱导的影响,诱导结果如图1所示。黑暗条件下愈伤组织诱导率明显偏低,强光和弱光下的诱导率相差不大,其中B组750 lx光照条件下诱导率更高。外植体大小对诱导愈伤组织影响很大,1 cm2大小的叶片在诱导培养基上诱导率较低;2~3 cm2的叶片可成功诱导愈伤组织,但所得愈伤组织量较少且易碎不成形,易死亡;4~5 cm2的外植体叶片诱导率最高,并且诱导所得愈伤组织颗粒饱满,生长状态极佳。因此,选择4~5 cm2的外植体叶片在750 lx光照条件下进行愈伤组织的诱导。
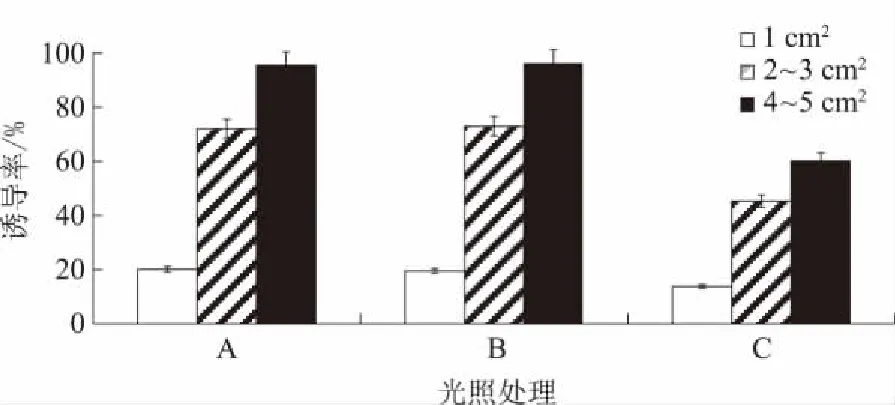
图1 外植体大小与光照条件对愈伤组织诱导率的影响
2.3 构树愈伤组织继代培养的优化结果
从表5可以看出,6-BA在愈伤组织继代的过程中起着主导作用,质量浓度过高会延缓愈伤组织的生长;缺乏6-BA的处理,愈伤组织则表现为生长缓慢、质地密实且色泽深褐。Y2处理中愈伤组织生长状态最佳,适量的6-BA在少量KT的辅助作用下,能达到良好的继代培养效果。因此选择MS+0.2 mg/L 6-BA+0.1 mg/L KT作为愈伤组织继代培养的最优培养基。

表5 愈伤组织继代培养的植物生长调节剂优化结果
注:+表示生长状态一般,++表示生长状态良好,+++表示生长状态最佳,—表示生长状态不佳。
2.4 构树体细胞胚诱导的优化结果
表6显示,R6-BA>RNAA>RpH,说明这3个因素对于体细胞胚诱导影响的大小顺序为:6-BA>NAA>pH。比较各因素的均值K,最大的值分别是:因素6-BA的K4,因素NAA的K2,因素pH的K3,通过极差分析可知理论最优组合为处理14,即2.0 mg/L 6-BA+1.0 mg/L NAA,pH值6.4,其诱导效果在胚胎发生频率、胚平均数以及胚胎发生效率3项评定指标方面均处于最高水平,体细胞胚发生频率达到96.0%,而16个处理组的平均胚胎发生频率仅为39.9%。因此构树体细胞胚诱导的最佳培养基组合为:MS+2.0 mg/L 6-BA+1.0 mg/L NAA,pH值6.4。
如图2所示,先将截取的构树叶片做伤口切割处理,经过17 d的诱导培养,形成颗粒状愈伤组织,并继续培养4~5 d。经过2~3个周期继代培养,待其生长状态稳定后将愈伤组织置于诱导体细胞胚的培养基(MS+2.0 mg/L 6-BA+1.0 mg/L NAA,pH值6.4,蔗糖30 g/L,琼脂5 g/L)中,经过35 d,出现绿色球状胚。进一步进行光照培养,于13 d开始出现嫩芽,后续培养表明可长成个体植株,验证了利用该技术途径进行构树种苗培育的可行性。
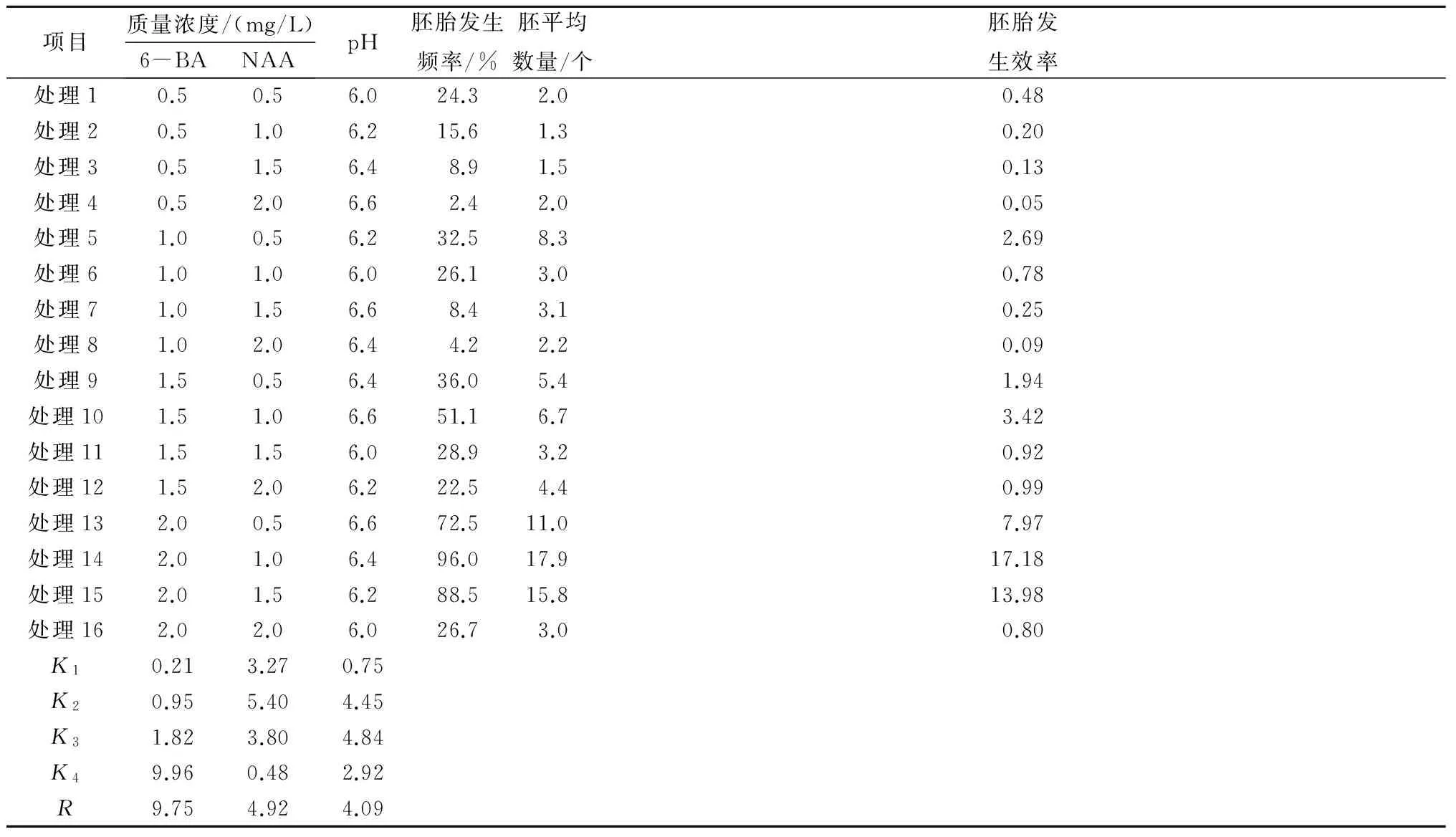
表6 体细胞胚诱导的正交优化结果
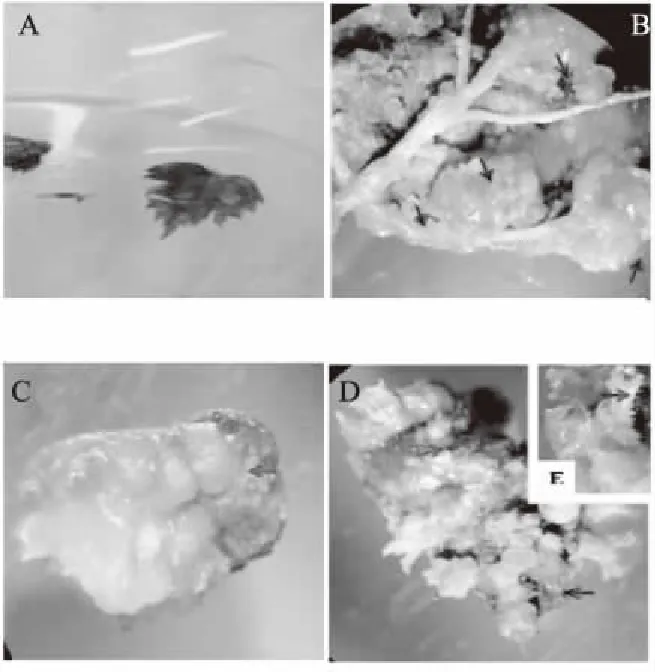
A.外植体叶片; B.培养17 d,箭头示颗粒状愈伤组织;C.培养25 d,箭头示颗粒状体细胞胚; D—E.培养35 d,箭头示体细胞胚逐渐发育成芽
3 结论与讨论
在植物细胞组织培养过程中,植物生长调节剂对细胞生长分化具有重要的调节作用,特别是生长素和细胞分裂素之间的配比更是直接影响植物细胞分化的方向[15]。在构树愈伤组织的诱导过程中,发现了与前人[16]一致或相似的结果,即6-BA和2,4-D协同作用更有利于构树愈伤组织的诱导发生。本试验结果表明,6-BA对于体细胞胚的诱导影响最大,NAA及pH值次之,当6-BA质量浓度一定时,体细胞胚的诱导率随着NAA质量浓度变化呈现抛物线变化趋势,这与戴力等[17]在美国SL-9甘薯茎尖脱毒组织培养中对最适植物生长调节剂浓度配比的研究结果极为相似。植物生长调节剂之间的组合对体细胞胚的诱导率有着直接影响。通常植物愈伤组织在诱导过程中的光照条件均为暗诱导[18],然而本试验中,杂交构树外植体于遮光条件下的诱导效果并没有光照条件下的诱导效果好,暗条件下诱导率最低,获得的愈伤组织质地较硬,颗粒少且不丰满,若继续培养,愈伤组织则会发生褐化、干枯甚至死亡,很少有体细胞胚的发生。由此推断,杂交构树于光照条件下的诱导效果更佳,可能是由于杂交构树系强阳性树种[19-20],在诱导外植体形成愈伤组织的过程中,配合杂交构树的植物特性,使得外植体摄取适当的光照,能够增强外植体中植物细胞的活性,从而得以提高愈伤组织诱导的成功率。然而,通过光照诱导得到的愈伤组织的继代培养方式以弱光条件下培养为宜。于光照条件下进行继代培养的愈伤组织会出现纤维化、衰老、死亡的情况,这与其强阳性树种的特性完全相悖。由此可以推断,通过诱导得到的愈伤组织细胞,已经不具有杂交构树的强阳性特性,其对于光信号的调控机制已经发生了改变,更倾向于弱光条件的培养环境。
[1] 万文,刘忠华,魏会琴.杂交构树茎段组培快繁体系的建立[J].福建林业科技,2010,37(1):72-76,109.
[2] 王进茂,杨敏生,杨文利,等.我国木本植物体细胞胚胎发生研究进展[J].河北林果研究,2004,19(3):295-301.
[3] 张书标,庄伟建.不同品种、外植体和光照条件对花生体细胞胚诱导的影响[J].广西农业生物科学,2001,20(4):243-245.
[4] 赵卫国,张林,刘利,等.桑树种质资源保存的新方法——离体保存[J].中国蚕业,2012,33(2):14-18.
[5] 叶志毅,刘红.桑树体细胞胚的诱导及其人工种子制作初探[J].浙江大学学报(农业与生命科学版),2001,27(4):469-470.
[6] 顾青,朱睦元.光照对喜树愈伤组织生理及喜树碱合成的影响[J].浙江林学院学报,2006,23(3):280-284.
[7] 刘菲,彭克勤,彭志红,等.喜树细胞悬浮培养体系的建立[J].湖南农业大学学报(自然科学版),2010,36(5):528-530.
[8] 李明,王树香,冯大领.植物体细胞胚发生及发育研究进展[J].中国农学通报,2011,27(3):237-241.
[9] 张宇.影响植物体细胞胚诱导的因素[J].现代化农业,2015,27(2):23-24.
[10] 何业华,罗吉,吴会桃,等.菠萝叶基愈伤组织诱导体细胞胚[J].果树学报,2007,24(1):59-63.
[11] Maria L V,Pablo K,Hebe Y R,etal.In vitro plant regeneration ofArachiscorrentina(Leguminosae) through somatic embryogenesis and organogenesis[J].Plant Cell,Tissue and Organ Culture,2006,86(1):111-115.
[12] 杨金玲,桂耀林,郭仲琛.白杄体细胞胚悬浮培养的动力学研究[J].生物工程学报,2000,16(2):219-220.
[13] 孙筱筠,张宗申.东北矮紫杉体细胞胚的诱导[J].大连工业大学学报,2010,29(4):264-267.
[14] 张宗申,王子茜.培养基成分和培养条件对黄芪愈伤组织中黄芪皂苷积累的影响[J].大连工业大学学报,2009,28(3):174-177.
[15] 陈永胜,邵志敏,李国瑞,等.蓖麻花药愈伤组织诱导及防褐化研究[J].江苏农业科学,2014,42(3):39-40.
[16] 郭晓丽,白丽荣,时丽冉.不同植物生长调节剂配比对旱稻愈伤组织诱导率的影响[J]. 河南农业科学,2011,40(8):81-83.
[17] 戴力,聂明建,刘少茹.美国SL-9甘薯茎尖脱毒组织培养的最适植物生长调节剂浓度配比初探[J].湖南农业科学,2014(16):1-4,8.
[18] 吴玉东,冯敏英,陆慧,等.非洲山毛豆幼茎愈伤组织培养及其鱼藤酮含量检测[J].天然产物研究与开发,2011,23(5):889-893.
[19] 张庆费.环境修复先锋树种构树[J].园林,2010,11(9):67.
[20] 孙永玉,李昆,罗长维,等.不同处理措施对构树种子萌发的影响[J].种子,2007,26(2):22-25.
Induction ofBroussonetiapapyriferaSomatic Embryo
ZHANG Chaohui,ZHANG Zongshen*,CHEN Yang,LI Yi
(Key Laboratory of Fermentation Engineering of Liaoning Province/School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China)
This study is mainly to establish an efficient protocol for obtaining somatic embryo ofBroussonetiapapyriferafrom leaves-derived callus.The results showed that young leaves of 4—5 cm2and 750 lx were suitable for callus induction,and the formula of MS+0.2 mg/L 6-BA+1.0 mg/L 2,4-D,pH 6.0 was demonstrated to be the best for callus induction with the induction rate of 94.6%.The preferred subculture media forB.papyriferacallus multiplication was MS+0.2 mg/L 6-BA+0.1 mg/L KT,pH 6.2,on which the callus grew fast.The light yellow or white callus with granules and fragile texture was chosen for induction of somatic embryo,and the formula of MS+2.0 mg/L 6-BA+1.0 mg/L NAA,pH 6.4 was proven to be the best with the somatic embryogenesis rate of 96.0%.
Broussonetiapapyrifera; callus; somatic embryo
2016-07-19
河南省科技创新杰出人才项目(134200510002)
张朝晖(1991-),男,辽宁鞍山人,在读硕士研究生,研究方向:药用植物细胞工程。E-mail:474757591@qq.com
*通讯作者:张宗申(1968-),男,河南周口人,教授,博士,主要从事药用植物细胞工程研究。E-mail:zhangzs@dlpu.edu.cn
时间:2016-11-25 14:24:33
S792.99
A
1004-3268(2016)12-0127-05
网络出版地址:http://www.cnki.net/kcms/detail/41.1092.S.20161125.1424.014.html
