放疗计划剂量学数据的自动提取分析
2016-02-09张碧云于大海
宋 威,赵 迪,鹿 红,张碧云,马 珺,于大海
江苏省中医院放疗科,南京市,210029
放疗计划剂量学数据的自动提取分析
【作者】宋 威,赵 迪,鹿 红,张碧云,马 珺,于大海
江苏省中医院放疗科,南京市,210029
目的为了提高批量患者放疗计划剂量学数据提取和分析的效率及准确性。方法利用Matlab提供的DICOM RT接口函数编写程序解读计划输出文件,按照SPSS软件兼容的数据格式输出数据至Excel文件,使用SPSS软件导入数据文件进行分析,并对14例胃癌患者,比较手动和使用软件自动提取分析的速度和准确性。结果软件提取方法输出的Excel文件数据格式符合SPSS软件要求,PTV的90%~98%剂量区间体积误差为-3.48E-5±3.01E-5,PTV的99%~106%剂量区间体积误差-1.11E-3±7.68E-4,危及器官剂量体积误差为-7.85E-5±9.91E-5。与手工提取分析相比,总耗时由5.3 h减少至0.19 h,错误率由0.002减少至0。结论该文编写的软件实现了DICOM RT 文件剂量学数据的批量自动提取,格式化输出,快速分析,提高了基于大量患者放疗剂量学数据分析的临床研究的效率。
剂量体积直方图;DICOM RT;Matlab;SPSS
伴随计算机技术、放射物理学的快速发展,二十一世纪已进入精确放疗的时代,CRT、IMRT已成为目前的常规放疗手段,IGRT、VMAT、螺旋断层放疗(Tomotherapy)等新技术不断出现,在进一步提高靶区剂量的同时,使得正常组织的剂量大幅度降低得到更好的保护[1-4]。由于精确放疗技术的剂量准确性要求,治疗前需要根据医师制定的治疗目标,评价放射治疗计划能否达到预期的剂量分布,以判断是否需要修改计划。目前计划评价的工具主要包括二维平面剂量分布图和DVH图(Dose Volume Histogram)[5]。DVH图反映了剂量分布的统计学信息,可以提供靶区和正常组织的剂量体积参数,并且进一步用于计算CI、HI等评价参数,确定计划的优劣[6]。在治疗或科研中为了比较不同患者使用不同放疗技术产生的剂量分布都需要充分参考DVH提供的剂量学信息。
目前主流的三维放射治疗计划系统包括Eclipse,Pinnacle都提供了可视化的DVH图分析工具,可以人工交互式的提取DVH数据或者以DICOM RT(Digital Imaging and Communications in Medicine Radiotherapy)文件形式输出,相对于人工提取数据方式的费时费力,通过计算机解读数据文件的方式更加高效,国外研究报道了一些开发的解读软件HART ,Radonc等实现了DVH数据的解读[7-8],但是对于多个患者数据文件批量解读以及数据输出格式兼容数据分析软件方面还有待改进,因此本文将介绍一种改进这些问题的方法。
1 方法
DICOM是美国电气制造商协会(National Electrical Manufactures Association,NEMA) 和 美国放射学会(American College of Radiology,ACR)联合制定的医学数字影像数据存储与通讯协议,涉及数据的传输,存储,显示,坐标系约定和信息表达等方面,为不同医疗设备和医疗机构间的信息共享传输提供了一个兼容的接口[9]。DICOM RT是对DICOM在放疗领域的补充[10],包括放疗计划(RT Plan),放疗图像(RT Image),放疗组织集(RT Structure set),放疗剂量(RT Dose),放疗记录(RT Treatment Record)几个对象,其中RT Structure set主要包含Structure set , ROI Contour等模块,RT Dose主要包含RT Dose,RT DVH,Structure Set,ROI Contour等模块。这些模块保存了靶区勾画中的组织集信息和放疗计划的剂量学数据。
DICOM文件以二进制形式保存,解读DICOM RT文件通常在VC++平台上实现,需要涉及到DICOM标准中实体关系模型(Entity-Relationship model)的分析,文件元信息解读,数据元素提取,数据结构定义,模块信息和相关操作的封装[11],独立开发解读程序是个复杂而费时费力的过程。Matlab作为一个强大的工程数学计算软件,在数值分析、矩阵计算、数据可视化、系统建模仿真等方面有着广泛的应用,其包含了丰富的数学函数和程序接口[12-13],也提供了对解读医学DICOM文件的支持,dicominfo函数可以获取DICOM文件的元信息,dicomread函数可以读入DICOM图像数据,dicomwrite可以输出图像数据等[14],使用这些函数可以方便快速的实现DICOM文件信息的读取、查看,具备良好的交互性。SPSS是医学领域广泛使用和熟知的统计数据分析软件,操作简便功能强大,能够读取EXCEL格式的数据文件,因此本文考虑使用Matlab平台批量解读DICOM文件,以SPSS软件兼容的数据排列方式输出至Excel文件,导入SPSS软件完成统计数据检验。
选取14例胃癌患者,使用Eclipse 8.6计划系统为每位患者制定两种治疗计划,分别命名为P1和P2,所有患者使用相同的组织集模板,确保命名的一致性,以DICOM RT格式导出计划文件。参数选择包含structure set,Total plan dose;选择绝对剂量单位Gy;剂量间隔为(dose bin width)0.01 Gy;DVH图类型选择微分(differential)或者积分(cumulative),体积单位为cm3。输出后文件名自动生成为RD.ID_ P1.dcm,RD.ID_P2.dcm,RS.ID.dcm。RD、RS、ID分别表示DICOM RT Dose文件,DICOM RT Structure set文件和患者的ID号(7位数)。
算法流程如下:
dir(“患者DICOM RT文件夹路径”),获取DICOM RT文件名列表;
For(每个文件名列表中的文件名)
{逐段分析文件名,判断该文件是RD或RS,P1或P2,以及获取患者的ID号; 将该文件的索引号存放到患者RD_P1,RD_P2,或RS文件索引号数组中,ID号存入号患者ID数组中。}
D2={};%初始化,用来将不同患者的数据保存至不同行
For(每个患者)
{ D1={};%初始化,用来将同一患者两种计划的数据保存至一行
V1={};%初始化,用来将同一患者两种计划的数据变量名保存至一行
For(每种计划) %P1,P2
{读取RT Dose, RT Structure set文件的元信息。
从RT Structure set Item提取ROInumber, ROIname;
建立ROInumber 和ROIname的映射组;
D0 ={};%初始化,用来将同一患者一种计划的数据保存至一行
V0 ={};%初始化,用来将同一患者一种计划的数据变量名保存至一行
For(每个组织的DVH曲线数据)
{判断是否需要输出当前组织的剂量数据,否则跳过当前循环。
判断DVH图类型是微分或积分型;
计算积分DVH图剂量体积参数数组;
判断当前组织是靶区还是OAR;%两者提取的数据不同:
按需要将该组织的ROIname,最大剂量,最小剂量,平均剂量,体积,Dv,Vd参数,保存至D0数组中,变量名保存至V0;}
D1=[D1, D0];%每种计划数据拼接并入一行V1=[V1, V0];%每种计划数据变量名拼接并入一行}
D2=[D2; D1];%每个患者数据另起一行保存}
D2=[V1; D2];%添加变量名行
输出D2至Excel文件。
需要指出的是①从计划系统输出的DICOM RT文件命名规则必须保持一致,例如按前述的输出格式,每个文件名字符串数组的前两位为RD或RS,4至10位为ID号,对于RD文件12至14位为计划分组号。②RT Structure set文件中的StructureSetROISequence模块中组织item排序与RT Dose文件中的DVHSequence模块中组织item排序并不完全一致[15],如表1所示,原因在于组织集中的某一组织(Trachea)未勾画因而其无剂量数据或者该组织的DVH数据未选择输出,忽视这一点会导致输出剂量数据与组织对应关系的错乱,而在两个文件中对于某个组织的ROInumb er是唯一确定的,为了确定DVHSequence中某个item的DVH曲线对应的组织名,必须首先确定其ROInumber,再从StructureSetROISequence中找到与此ROInumber对应的ROIname即组织名。
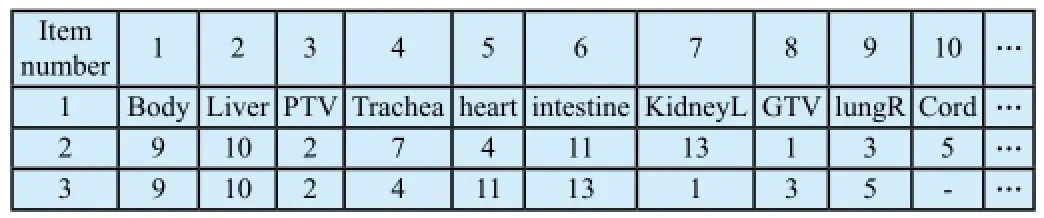
表1 组织项排序比较Tab.1 Comparison of item sequence
Eclipse计划系统输出的DICOM RT dose 文件中的DVH数据形式如表2,0.01表示选择的剂量间隔为0.01 Gy;对于输出的积分DVH,下一个数据表示大于等于该剂量区间的绝对体积(cm3);对于输出的微分DVH,为落在该剂量区间内的绝对体积(cm3)。在计算积分形式的剂量体积参数时,对于前者需要循环累加剂量间隔值,对于后者还需要反向累加微分体积。
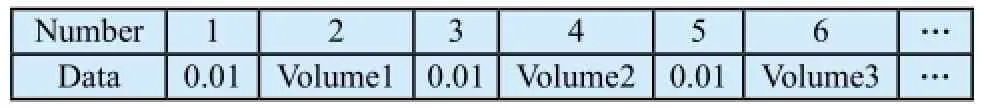
表2 放疗计划系统输出的DICOM RT dose文件中DVH数据存储形式Tab.2 Storage format of DVH data in exported DICOM RT dose file from TPS
2 结果
在CPU主频为3.0 GHz,内存为4 GB的PC上对14位患者剂量文件批量读取后,提取剂量体积数据输出至Excel文件中,每一行对应一位患者的全部数据,共14行数据,对于任意一行,从左至右按顺序依次是患者计划1中PTV的数据1至最后一个数据,计划1中 OAR1的数据1至最后一个数据,然后是OAR2直至最后一个OAR的所有数据,接下来是计划2中的相应全部数据,排列顺序与计划1相同。
软件提取剂量体积数据准确性验证,以人工拾取的剂量数据为准确值,分别考察最大剂量,最小剂量,平均剂量,组织绝对体积;PTV的90%~98%处方剂量区间的体积平均误差,PTV的99%~106%处方剂量区间的体积平均误差,危及器官(Organ at Risk, OAR)的体积平均误差,如表3所示。在处理时间方面,对于人工提取分析方法其包括在DVH上逐点拾取剂量数据的时间,将数据录入Excel表格的时间,数据导入SPSS软件分析的时间;对于软件提取分析方法其包括从计划系统导出DICOM RT文件的时间,软件读取文件自动提取数据的时间,数据导SPSS软件分析的时间。考察对14例患者1 120个剂量数据点批量提取分析的时间和输入错误率,结果如表4所示。

表3 剂量体积数据准确性验证Tab.3 Accuracy validation of dose-volume data

表4 人工和软件提取分析的结果比较Tab.4 Result comparison of extraction and analysis between manual operation and software
3 结论
最大剂量,最小剂量,平均剂量,组织绝对体积参数记录在DICOM RT文件中,因此软件提取结果误差为0。对于靶区和正常组织的剂量体积参数Vd(表示大于等于剂量d的组织体积),在用鼠标拾取数据点时,通常不能精确选定在期望的剂量坐标处,因此为了保证准确性,要求拾取剂量值与期望剂量值的偏差必须小于0.001 Gy。本文结果显示PTV的90%~98%剂量区间的体积平均误差要小于PTV的99%~106%剂量区间,危及器官(Organ at Risk, OAR)的平均剂量体积误差最小,并与前者数量级相当,原因可能在于PTV的DVH曲线在99%~106%处方剂量区间的DVH曲线变化率大、降落快,而在PTV的90%~98%剂量区间和OAR的DVH曲线变化率相对较平缓,此外计划系统上DVH曲线插值算法与本文软件提取使用的插值算法也可能有所不同,而且如前述人工提取的剂量值与期望剂量值本身也有微小的偏差,这些因素的叠加最终导致了误差的不同。此外软件提取方法在速度上要明显优于人工提取方法,特别当面对大量数据时,人工提取录入的错误率也要高于软件提取输出方法,而且这一过程非常枯燥,需要耗费操作人员相当大的精力,相比之下软件程序经过调试后理论上不会产生任何提取错误。
全面准确的报道剂量学数据是当前循证医学的迫切要求[16],目前主流的放射治疗计划制定方法和评估手段仍然是基于DVH图的方式,大多数治疗计划系统虽然可以提供以DICOM RT或其他格式输出的计划剂量数据文件,但还需进一步的人工交互才能获取有用数据,国外已有文献报道了使用软件编程提取DVH数据的方法,但没有考虑到批量读取患者数据和其后数据分析软件的数据格式兼容性问题[7],或者使用R语言实现解读,但要求使用者对R语言有一定的了解程度,因此不具有很好的扩展性[8]。本文针对这些问题进行了改进,利用通用的Matlab平台,实现了自动提取批量患者的剂量学数据,并直接按照SPSS软件兼容的数据格式输出数据至Excel表,大大减少了录入数据标题和调整数据位置需要的时间,也减少了在这一过程中人工录入错误发生的可能性,进一步提高了剂量数据提取分析的自动化程度。本文是基于Varian Eclipse系统输出的DICOM RT文件进行的研究,代码经过针对性的改进后可以推广到遵循其他协议的(例如AAPM、RTOG)和其他文件输出命名方式的计划系统。总的来说本文提出剂量数据提取分析方法准确、快速、具备很好的推广性和临床应用价值,为基于大量患者剂量学数据分析的临床研究提供了一种高效的工具。
[1] Santos JDL, Popple R, Agazaryan N, et al. Image guided radiation therapy (IGRT) Technologies for Radiation therapy localization and delivery[J]. Int J Radiat Oncol Biol Phy, 2013, 87(1): 33-45.
[2] Wolff D, Stieler FG. Volumetric modulated arc therapy (VMAT) vs. serial tomotherapy, step-and-shoot IMRT and 3D-conformal RT for treatment of prostate cancer [J]. Radiother Oncol, 2009, 93(2): 226-233.
[3] Mackie TR, Holmes T, Swerdloff S, et al. Tomotherapy: A new concept for the delivery of dynamic conformal radiotherapy[J]. Med Phys, 1993, 20(6):1709-1719.
[4] Fenwick JD, Tome WA, Soisson ET, et al. Tomotherapy and Other Innovative IMRT Delivery Systems[J]. Seminar Radiat Oncoly, 2006, 16(4):199-208.
[5] Jang S, Pyakuryal A, Myint K, et al. SU-GG-T-379: Dose volume histogram (DVH) analysis software for radiation therapy research[J]. Med Phys, 2008, 35(6): 2812.
[6] Ebert MA, Haworth A, Kearvell R, et al. Comparison of DVH data from multiple radiotherapy treatment planning systems[J]. Phys Med Biol, 2010, 55(11):337-346.
[7] Pyakuryal A, Myint WK, Gopalakrishnan M, et al. A computational tool for the efficient analysis of dose-volume histograms for radiation therapy treatment plans [J]. J Appl Clin Med Phys, 2010, 11(1): 137-157.
[8] Thompson RF. RadOnc: An R package for analysis of dose-volume histogram and three-dimensional structural data [J]. J Radiat Oncol Inform, 2014, 6(1): 98-110.
[9] Pianykh OS. Digital imaging and communications in medicine[M]. Berlin: Springer Berlin Heidelberg, 2010.
[10] Law MYY, Liu B. DICOM-RT and its utilization in radiation therapy[J]. Radiographics, 2009, 29(3):218-228.
[11] 王爽. DICOM结构化报告和放射治疗计划研究[D]. 成都: 电子科技大学, 2010.
[12] Spezi E, Deasy J. An open source DICOM RT/MATLAB based computational platform for radiotherapy research[J]. Radiother Oncol, 2003, 68(1): 106-115.
[13] Guo R, Wang W, Qi HR. Hyperspectral image unmixing using autoencoder cascade[A]// Hyperspectral Image and Signal Processing: Evolution in Remote Sensing (WHISPERS), 2015 7th Workshop [C]. IEEE, 2015. 1-4.
[14] Guo R, Qi HR. Facial feature parsing and landmark detection via low-rank matrix decomposition[C]//. IEEE ICZP, 2015:1-8.
[15] Zhao B. Beyond The dvh-spatial and biological radiotherapy treatment planning[D]. Detroit: Wayne State University, 2010.
[16] Souza WD, Zhang B, Feigenberg S, et al. SU-E-P-09: Compliance with evidence-based treatment planning dvh guidelines in an academic multi-site radiation oncology practice setting[J]. Med Phys, 2015, 42(6).3228.
Automatic Extraction and Analysis of Dosimetry Data in Radiotherapy Plans
【Writers】SONG Wei, ZHAO Di, LU Hong, ZHANG Biyun, MA Jun, YU Dahai
Radiotherapy Center, Jiangsu Province Hospital of TCM, Nanjing, 210029
Objective To improve the efficiency and accuracy of extraction and analysis of dosimetry data in radiotherapy plans for a batch of patients.MethodsWith the interface function provided in Matlab platform, a program was written to extract the dosimetry data exported from treatment planning system in DICOM RT format and exported the dosevolume data to an Excel file with the SPSS compatible format. This method was compared with manual operation for 14 gastric carcinoma patients to validate the efficiency and accuracy.ResultsThe output Excel data were compatible with SPSS in format, the dosimetry data error for PTV dose interval of 90%~98%, PTV dose interval of 99%~106% and all OARs were -3.48E-5±3.01E-5, -1.11E-3±7.68E-4, -7.85E-5±9.91E-5 respectively. Compared with manual operation, the time required was reduced from 5.3 h to 0.19 h and input error was reduced from 0.002 to 0.ConclusionThe automatic extraction of dosimetry data in DICOM RT format for batch patients, the SPSS compatible data exportation, quick analysis were achieved in this paper. The efficiency of clinical researches based on dosimetry data analysis of large number of patients will be improved with this method.
DVH, DICOM RT, Matlab, SPSS
TP311. 1
A
10.3969/j.issn.1671-7104.2016.04.019
1671-7104(2016)04-0301-04
2016-03-07
国家自然科学基金资助项目(81301971)
宋威,E-mail: swjacke@hotmail.com
于大海,主任医师,E-mail: yudahaipumc@gmail.com
