2014—2016年广东省PRRSV GP5基因遗传变异分析
2016-02-08蒋智勇蔡汝健李春玲
蒋智勇,蔡汝健,李 艳,李春玲
(广东省农科院动物卫生研究所/广东省畜禽疫病防治研究重点实验室,广东 广州 510640)
2014—2016年广东省PRRSV GP5基因遗传变异分析
蒋智勇,蔡汝健,李 艳,李春玲
(广东省农科院动物卫生研究所/广东省畜禽疫病防治研究重点实验室,广东 广州 510640)
为监测猪繁殖与呼吸综合征病毒(PRRSV)的遗传变异情况,采集了2014—2016年间广东地区46个猪场317份疑患PRRS的临床样品进行检测,并对阳性样品的GP5基因进行了RT-PCR扩增、克隆和测序,选出21株PRRSV GP5基因进行序列比对和遗传进化分析。结果表明:所分离的PRRSV均属于美洲株,21株PRRSV GP5基因的核苷酸和氨基酸同源性分别为 82.4%~98.7%和 78.6%~98.5%,其中2株与美国NADC30分离株同属亚群Ⅲ,10株与近几年广东省内分离的PRRSV毒株QYYZ 和GM2同属于亚群Ⅳ。PRRSV GP5基因的遗传进化分析结果表明,亚群Ⅲ和亚群Ⅳ是近几年在广东省内流行的新兴亚群,研究结果将为PRRSV疫苗的选择以及防控方案的制定提供参考。
猪繁殖与呼吸综合征病毒(PRRSV);GP5基因;遗传变异
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种以母猪流产、早产、产死胎和木乃伊胎等,仔猪和育肥猪发生呼吸道疾病为特征的传染病,给
蒋智勇,蔡汝健,李艳,等.2014—2016年广东省PRRSV GP5基因遗传变异分析[J].广东农业科学,2016,43(12):90-95.养猪业带来了严重威胁和重大经济损失。根据抗原性差异,可以将PRRSV分为两个血清型,即以VR2332毒株为代表的美洲型和以Lelystad virus(LV)为代表的欧洲型,目前我国流行的病毒株主要为美洲型PRRSV。我国于1996年首次报道该病毒的存在[1],此后全国各地均有该病报道。2006年夏秋季我国南方多个省份猪群暴发的“无名高热”,后来证实该病是由NSP2缺失30个氨基酸为特征的高致病性PRRSV(HP-PRRSV)所引起的[2]。
PRRSV基因组为单股正链RNA病毒,全长约为15 kb,包含有9个开放阅读框(open reading frame,ORF),ORFla和ORFl b编码病毒的RNA聚合酶,ORF2a~ORF7分别编码病毒结构蛋白。PRRSV的基因易发生变异,在其结构蛋白中变异最大是ORF5基因编码的糖蛋白GP5,同时也是PRRSV最主要的保护性抗原蛋白,具有较好的免疫原性,能诱导产生中和抗体,常作为标记性蛋白用于PRRSV的流行病学监测[3-4]。本研究对我国广东地区2014—2016年上半年采集的临床病料样品进行了PRRSV的RT-PCR检测,并对其主要保护性抗原GP5基因的变异情况进行了分析,为制定PRRSV的防控方案提供科学依据。
1 材料与方法
1.1 试验材料
病料采集于广东省内46个猪场(广州、江门、佛山、清远、韶关、惠州、梅州等地区)2014-2016年上半年间疑似PRRS发病猪场病猪(317只)的肺脏、脾脏、淋巴结等脏器或全血。
病毒DNA/RNA提取试剂盒、One Step PrimeScript™ RT-PCR Kit,E.coli DH5α 感受态细胞和pMD18-T 载体购自大连宝生物工程有限公司(TaKaRa)。
1.2 引物设计
参照PRRSV CH-la株(GenBank登录号 AF132118)、JXAl株(GenBank登录号 EF112445)、GM2(GenBank 登录号JN662424)和CHsx1401(登录号 KP861625)等核苷酸序列设计1对扩增GP5基因的特异性引物,GP5-F:5′-GTCAACTTTACCAGCTACGT C-3′,GP5-R:5′-CTTGCGGCCTAGCAAGCACA -3′,扩增长度为1 071 bp,引物由上海英骏生物工程技术有限公司(Invitrogen)合成。
1.3 PRRSV GP5基因的RT-PCR扩增
将采集的病料经研磨、离心取上清提取病毒RNA,提取方法按照病毒RNA/DNA快速纯化试剂盒说明书进行操作,提取的RNA用40μL ddH2O洗脱。GP5基因的RT-PCR扩增按照PrimeScript™ One Step RT-PCR Kit Ver.2试剂盒说明书进行。反应体系为50 μL:2×One Step Buffer 25 μL,PrimeScript 1 Step Enzyme Mix 2μL,上下游引物各1.0 μL,RNase Free dH2O 17.5 μL,模板RNA 4 μL。反应程序为:50℃30 min,95℃ 2 min;95℃ 30 s、55℃ 30 s、72℃1.5 min,共35个循环,72℃ 5min。反应结束后将RT-PCR产物用1.0%的琼脂糖凝胶进行电泳检测,回收阳性产物并克隆至pMD 18-T载体中,阳性重组菌液送上海英骏生物技术有限公司(Invitrogen)测序。
1.4 PRRSV GP5基因的遗传进化分析
应用生物学分析软件DNAStar、ClustalX 2.1PRRSV分离株及GenBank中登录的16株参考毒株(表1)GP5基因序列以及推导的氨基酸序列进行整理和比对,应用软件MEGA 6.0中邻接法(Neighbor-joining; bootstrap values of 1 000 replicates)绘制GP5基因系统进化树。
2 结果与分析
2.1 病料样品的PRRSV GP5基因RT-PCR扩增及序列测定
本研究对2014—2016年上半年间采集广东省内不同地区46个猪场317只疑似 PRRS病死猪的病料样品,提取病毒RNA进行RTPCR扩增,结果检出PRRSV阳性样品182份,阳性率为57.4%,46个猪场均为阳性猪场。GP5基因的RT-PCR扩增产物克隆后全部送上海英骏生物工程技术有限公司测序,每个样本重复测序3次。46个猪场中有26个猪场扩增的PRRSV GP5基因与HP-PRRSV疫苗株GP5基因同源性大于99%,选取其中1株GD-HY6为代表参与后续分析。其余20个猪场分离到20株PRRSV,其GP5基因除1株(GD-HY)缺失了3个碱基外全长均为603 bp,编码200个氨基酸,将获得的21株PRRSV序列提交至GenBank,具体登录号见表1。
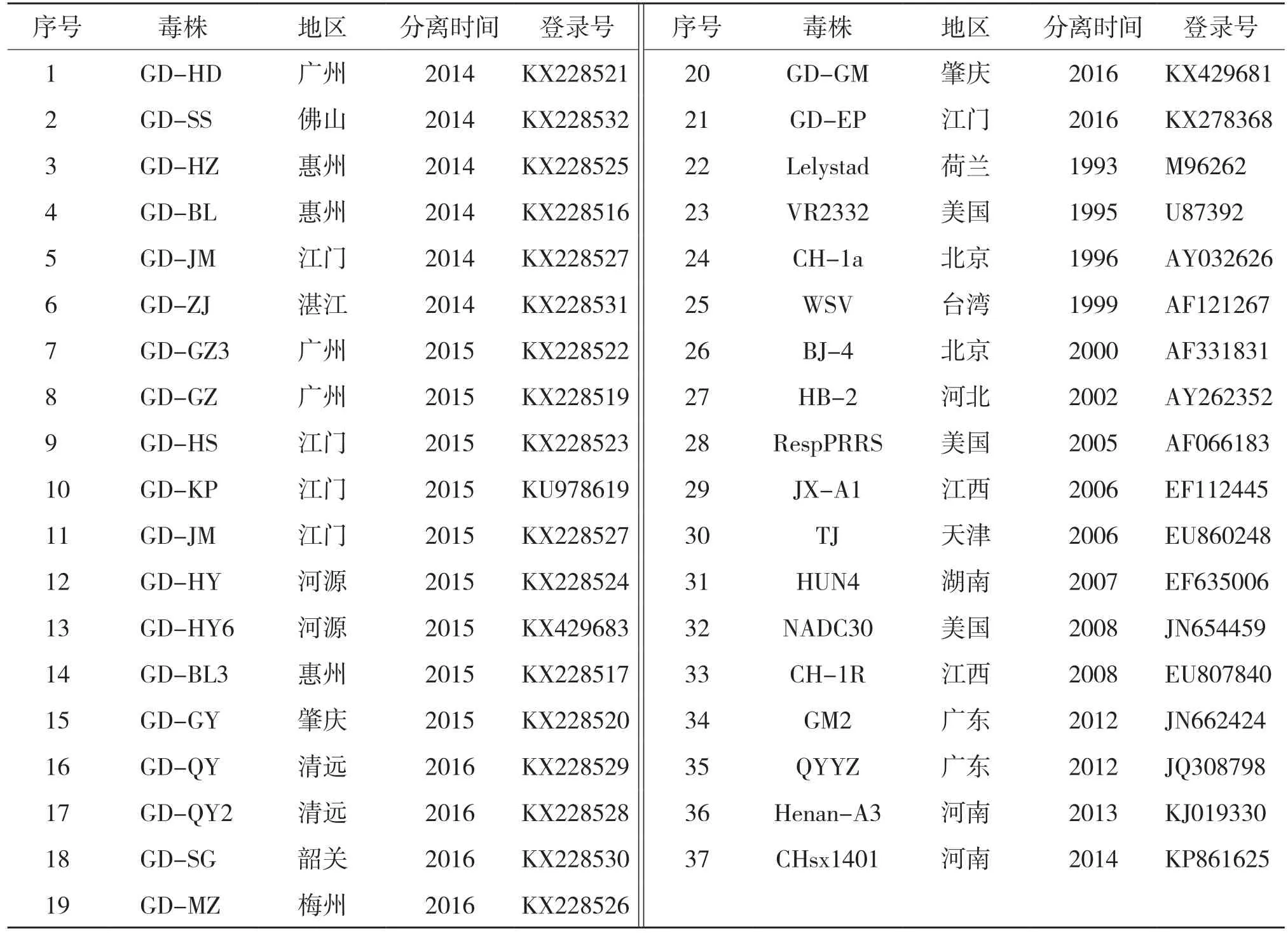
表1 广东省内分离的PRRSV毒株和参考毒株信息
2.2 GP5基因序列遗传进化分析
将21株GP5基因序列与国内外已登录GenBank 的16株PRRSV参考毒株构建遗传进化树(图1),结果显示,本研究测序鉴定的病毒株均属于PRRSV美洲型,这些毒株可大致分为3个亚群,分别为以HP-PRRSV JXA1 株为代表的亚群Ⅰ、以美国NADC-30为代表的亚群Ⅲ,以及以近年广东省内分离的以PRRSV重组毒株QYYZ(GenBank登录号 JQ308798)和GM2(GenBank登录号 JN662424)为代表的亚群Ⅳ。分离的21株PRRSV GP5基因与欧洲型LV株的GP5基因核苷酸和推导氨基酸序列同源性分别为61.8%~64.3%和52.2%~57.7%。本研究采集病料的46个猪场中有34个猪场(73.9%)的PRRSV流行株属于亚群Ⅰ,10个猪场(21.7%)PRRSV流行株属于亚群Ⅳ,2个猪场(4.3%)PRRSV流行株属于亚群Ⅲ,没有猪场的PRRSV流行株属于以美国经典PRRSV株VR2332为代表的亚群Ⅱ。
研究获得的21株GP5基因之间核苷酸序列同源性为82.4%~98.7%,其中GD-BL3、GDMZ、GD-JM、GD-HY6、GD-HD、GD-GY、GDZJ、GD-SS、GD-GZ3与HP-PRRSV中的JX A1株、Hu4株、TJ株高度同源属于亚群Ⅰ,序列相似度为98.2%~99.2%,与同源亚群Ⅰ的国内经典株CH1-a序列相似度为94.2%~95.5%;GD-GM、GD-EP与美国分离株NADC-30株属于亚群Ⅲ,序列相似度分别为94.0%~95.2%;GD-QY2、GD-QY、GD-SG、GD-BL、GD-HY、GD-GZ、GD-HS、GD-KP、GD-HZ、GD-HH与QYYZ和GM2属于亚群Ⅳ,序列相似度为91.2%~95.0%。

图1 PRRSV GP5基因遗传进化树
2.3 GP5基因推导的氨基酸序列分析
GP5基因测序结果显示,除了GD-HY株在第33位发生了1个氨基酸缺失,其余毒株的GP5基因全长均为603 bp,编码200个氨基酸,21株PRRSV GP5基因推导的氨基酸序列同源性为78.6%~98.5%。GP5氨基酸同源性比对分析结果显示,其氨基酸突变位点集中位于aa3~aa39区域和羧基端aa184~aa200,该区域位于GP5蛋白的信号肽(aal~aa31)、诱骗表位(aa27~aa30)、中和位点(aa33~aa47)[5]和非中和位点(aa184~aa200)附近(图2)。亚群Ⅲ内的2株分离株在GP5蛋白中和位点(aa33~aa47)区域与JXA1相比有3个氨基酸突变,亚群Ⅳ内的10株分离株在此区域与JX A1相比有4~5个氨基酸突变,均发生了较大变化。

图2 GP5氨基酸序列比对分析结果
3 讨论
1996年首次证实PRRSV在我国存在。2006年夏秋季在我国南方部分地区开始暴发的HPPRRSV,近些年来在我国大部分地区流行。2010年以来,由于弱毒活疫苗的广泛使用,在选择压的作用下弱毒活疫苗发生返强突变,或不同毒株间重组,国内多个研究小组报道分离了变异较大的PRRSV分离株[6-10]。本研究采集的病料均来自广东省内不同地区临床表现为典型PRRS症状的猪场,采集病料的46个猪场均检测出PRRSV阳性,登录基因库的21株PRRSV分别来自21个不同的猪场,其余26个猪场的扩增PRRSV GP5基因序列与HP-PRRSV JXA1株同源性均在99%以上,推测可能为疫苗毒所致[11]。
根据文献报道近年来在我国流行的PRRSV美洲型毒株可分为3~4个亚群,Xie 等[12]对广东省2007—2011年间PRRSV流行株的GP5基因序列分析表明,PRRSV可分为3个亚群;而Zhang 等[13]对我国东南地区2014—2015年间PRRSV流行株GP5基因和NSP2基因的分析结果显示,PRRSV可分为4个亚群,增加了以NADC-30株为代表的亚群Ⅲ。本研究结果显示有9株属于以HP-PRRSV JXA1 株和经典株CH-1a为代表的亚群Ⅰ,2株属于以NADC-30株为代表的亚群Ⅲ和10株属于以QYYZ和GM2株为代表的亚群Ⅳ,没有分离到以VR2332株及其疫苗株RespPRRS为代表的亚群Ⅱ。由此可见在广东省内PRRSV流行毒株增加了一个以NADC-30株为代表的亚群Ⅲ,同时以QYYZ和GM2株为代表的亚群Ⅳ在广东省内流行有扩大的趋势。
目前,PRRSV流行毒株存在多样性及变异,而PRRSV野毒株和疫苗毒株在猪场共存并且难以区分是野毒感染还是疫苗毒感染,同时也增加了病毒间重组导致新毒株产生的几率,使得该病在临床上更加复杂,也进一步加大了防控难度。为了有效防控PRRS,需要进一步规范弱毒疫苗的使用,对PRRSV流行株进行适时监测,同时对其致病性及遗传变异等方面进行深入研究,以期为临床诊断、新型疫苗的研发提供必要的参考依据。
[1] 郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国预防兽医学报,1996,18(2):1-4.
[2] Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:Unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,2(6):e526.
[3] Roqucs E,Girard A,St-Louis M C,et al.Immunogcnis and protective properties of GP5 and M structural proteins of porcine reproductive and respiratory syndrome virus expressed from replicating but nondisscminating adenovcctors[J].Vet Res,2013,44(1):17.
[4] Cao Z X,Jiao P R,Huang Y M,et al.Ucnetic diversity analysis of porcine reproductive and respiratory syndrome virus isolated in South China from 2007 to 2009 based on ORF5 gene[J].Acta Veterinaria Hungarica,2012,60(1):157-164.
[5] Ostrowski M,Galeota J A,Jar A M,et al.Identification of neutralizing and nonneutralizing epitopes in the porcine reproductive and respiratory syndrome virus GP5 ectodomain[J].J Virol,2002,76:4241-4250.
[6] 韦莹,洪绍锋,覃艳然,等.一株Nsp2蛋白自然缺失123个氨基酸的PRRSV分离和鉴定[J].动物医学进展,2015,36(10):34-38
[7] 陈家程,白云,常丹,等.一株不能被高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV)疫苗抗血清中和的HP-PRRSV的分离鉴定[J].中国预防兽医学报,2014,36(3):174-177.
[8] Re-emerging of porcine respiratory and reproductive syndrome virus(lineage 3)and increased pathogenicity after genomic recombination with vaccine variant[J].Vet Microbiol,2015,175(2):332-340.
[9] Lu W,Wei Z,Zhang G,et al.Complete genome sequence of a novel strains between vaccine and wild-type PRRSV strain:evidence for recombination porcine reproductive and respiratory syndrome virus(PRRSV)variant[J].Journal of Virology,2012,86(17):9543.
[10] Zhou L,Wang Z,Ding Y,et al.NADC30-like Strain of Porcine Reproductive and Respiratory Syndrome Virus,China[J].Emerg Infect Dis, 2015,21(12):2256-2257.
[11] 杨汉春.2013年猪病流行情况与2014年流行趋势及防控对策[J].猪业科学,2014,32(2):42-43.
[12] Xie J,Zhu W,Chen Y,et al.Molecular epidemi ology of PRRSV in South China from 2007 to 2011 based on the genetic analysis of ORF5[J].Microb Pathog,2013,63(10):30-36.
[13] Zhang Q,Xu X,You S,et al.Emerging of two new subgenotypes of porcine reproductive and respiratory syndrome viruses in Southeast China[J].Microb Pathog,2016,66(5):27-33.
(责任编辑 崔建勋)
Genetic variation analysis of GP5 gene of PRRSV isolates in Guangdong province during 2014-2016
JIANG Zhi-yong,CAI Ru-jian,LI Yan,LI Chun-ling
(Institute of Veterinary Medicine,Guangdong Academy of Agricultural Sciences,Guangzhou 510640,China)
To investigate the variation in GP5 gene of porcine reproductive and respiratory syndrome virus(PRRSV),a total of 317 clinical samples were collected from 46 pig farms suspected of PRRSV infection druing 2014-2016.The GP5 genes of PRRSV-positive samples were sequenced and analyzed.Phylogenetic analysis showed that all the isolates belonged to the North America genotype,and these PRRSV GP5 genes had 82.4%-98.7% nucleotide and 78.6%-98.5% deduced amino acid identity to each other.Among them,two isolates formed subgenotype III,which were closely related to the NADC30 strain in the US.10 isolates formed subgenotype IV,were closely related to the recently isolated novel field strains,QYYZ and GM2.This study would provide the basis for selection and improvement of vaccines and comprehensive prevention and control of PRRSV.
porcine reproductive and respiratory syndrome virus(PRRSV);GP5 gene;genetic variation
S852.65+1;Q754
A
1004-874X(2016)12-0090-06
10.16768/j.issn.1004-874X.2016.12.016
2016-08-01
广东省科技厅农村科技领域项目(2015A020209083);广东省科技厅科技创新创业人才服务领域项目(2014 A070713024)
蒋智勇(1974-),男,在读博士生,助理研究员,E-mail:jiangzy01@sina.com
李春玲(1965-),女,博士,研究员,E-mail:lclclare@163.com
