超声波辅助提取东北红豆杉叶中多糖
2016-02-07石大骏张万忠
石大骏, 张万忠
(沈阳化工大学 制药与生物工程学院, 辽宁 沈阳 110142)
超声波辅助提取东北红豆杉叶中多糖
石大骏, 张万忠
(沈阳化工大学 制药与生物工程学院, 辽宁 沈阳 110142)
以东北红豆杉叶为原料,利用超声波辅助提取,通过单因素和正交实验,考察料液比、提取时间、提取温度、提取次数和超声波功率对红豆杉多糖得率的影响.结果表明:在料液比为1∶20、提取时间40 min、提取温度50 ℃、超声波功率150 W、提取3次时,红豆杉叶多糖得率达7.49 %.该提取方法高效快速,且降低了能耗,具有明显的优势,为提高东北红豆杉叶中多糖成分的提取提供了研究基础.
东北红豆杉; 多糖; 超声波辅助提取; 得率
东北红豆杉(Taxus cuspidate)是一种天然的珍贵药用资源,其中的紫杉烷类化合物,特别是紫杉醇,具有显著的抗肿瘤作用,在治疗癌症方面被认为是当今最具潜力的抗癌药物之一[1-2].此外,最新研究表明,除紫杉醇外,红豆杉中含有的活性多糖还具有免疫促进作用[3],在抗病毒、抗肿瘤[4]、抗心血管疾病、抗衰老、提高免疫、保护肝脏、清除自由基,以及保护心肌损伤等方面有着独特的生物活性[5-7].然而,相对于紫杉醇,目前对于红豆杉多糖的研究尚处于初级阶段[8],因而日益引起人们的关注[9].红豆杉多糖常用提取方法主要有:热水回流提取、超声波辅助提取和微波辅助提取等[10-11],而超声波辅助提取技术具有操作简便、提取时间短、提取率高等优点,已广泛用于生物活性成分的提取方面[12].本文采用超声波辅助提取技术提取东北红豆杉叶中多糖,通过单因素和正交实验优化,确立其适宜的提取工艺,为进一步综合利用红豆杉资源提供必要的技术支持和研究基础[13].
1 试剂与仪器
1.1 材料与试剂
红豆杉枝叶,采自辽宁省朝阳林场,采摘后放置一段时间烘干至恒质量,粉碎,过40目筛,干燥处保存备用;
D(+)-无水葡萄糖(φ(HPLC)≥98 %),上海源叶生物科技有限公司;乙醇(AR,体积分数95 %),国药集团化学试剂有限公司;重蒸苯酚,西陇化工股份有限公司;浓硫酸(AR,体积分数98 %),沈阳市新化试剂厂;石油醚(AR),天津市富宇精细化工有限公司.
1.2 仪 器
FA1104电子天平,沈阳杰龙仪器有限公司;UV1100紫外-可见分光光度计,上海美谱达仪器有限公司;KQ5200DE 超声波清洗机,河南兄弟仪器有限公司;其余均为实验室常用玻璃仪器.
2 实验方法
2.1 试剂的配制
质量分数6 %苯酚溶液的配制:精确称取6.0 g苯酚,加入一定量的蒸馏水使苯酚质量分数为6 %,混匀,置于棕色瓶中保存备用.
对照品溶液的制备:准确称取5.4 mg干燥至恒质量的D(+)-无水葡萄糖,于100 mL容量瓶中蒸馏水溶解定容,混合均匀,即得到质量浓度(下同)为54 mg/L的无水葡萄糖标准溶液.
2.2 葡萄糖标准曲线绘制
分别精密移取无水葡萄糖标准液0.1,0.2,0.4,0.8,1.0 mL于具塞试管中,加蒸馏水补至1.0 mL,加入质量分数6 %的苯酚溶液1.0 mL,摇匀;再迅速加入浓硫酸5.0 mL,摇匀,静置10 min,放入30 ℃恒温水浴锅水浴加热20 min,测定490 nm处的吸光度值,每组测3次,取平均值.空白对照组取1.0 mL蒸馏水,不加提取液,按上述同样操作.以无水葡萄糖质量浓度(mg/L)为横坐标,490 nm处吸光度值(A)为纵坐标作葡萄糖标准曲线,进行线性回归,得到回归方程为A=0.011 8ρ-0.004 3(R2=0.999 6),说明无水葡萄糖在5.4~54 mg/L范围内,具有良好的线性关系.
2.3 红豆杉叶中多糖提取及提取液中多糖含量测定
精确称取4 g红豆杉叶粉末,加入40 mL石油醚,震荡12 h,抽滤,粉末自然风干.以蒸馏水作提取剂,选取不同的料液比、提取时间、提取次数、功率、温度进行超声波提取,提取后过滤,合并上清液(总体积为V/mL).准确量取滤液0.5 mL(剩余提取液通过浓缩,乙醇沉淀,冷冻干燥后得到粗多糖),加蒸馏水定容至10 mL容量瓶定容,再从中量取0.5 mL于具塞试管中,加入0.5 mL蒸馏水补至1.0 mL,混匀;对照组不加提取液,加入1.0 mL蒸馏水,再按照葡萄糖标准液测定方法,测定490 nm处的吸光度值,每组测3次,求取平均值.根据线性回归方程由吸光度计算出提取液中多糖含量,并按公式(1)进行多糖得率的计算.
红豆杉多糖得率(质量分数/%)=
f·V·ρ0×100/(4.0×106)
(1)
其中:ρ0=ρ×40;ρ0为提取液中葡萄糖质量浓度,mg/L;ρ为稀释后的质量浓度,mg/L;f为换算因子0.9;V为提取液总体积,mL.
2.4 单因素实验
2.4.1 料液比对多糖得率的影响
按2.3所述方法,选取超声波功率120 W,温度50 ℃,提取3次,每次40 min,考察不同料液比(质量体积比/g∶mL,下同)1∶5、1∶10、1∶15、1∶20、1∶25、1∶30对多糖提取得率的影响.
2.4.2 提取时间对多糖得率的影响
按2.3所述方法,选取料液比1∶25,提取温度50 ℃,超声波功率120 W,提取3次,考察不同提取时间20、30、40、50、60 min对多糖提取得率的影响.
2.4.3 提取温度对多糖得率的影响
按2.3所述方法,选取料液比1∶25,提取时间40 min,超声波功率120 W,提取3次,考察不同提取温度20、30、40、50、60 ℃对多糖提取得率的影响.
2.4.4 提取次数对多糖得率的影响
按2.3所述方法,选取料液比1∶25,提取温度50 ℃,提取时间40 min,超声波功率120 W,考察不同提取次数1、2、3、4、5次对多糖提取得率的影响.
2.4.5 超声波功率对多糖得率的影响
按2.3所述方法,选取料液比1∶25,提取温度50 ℃,提取3次,40 min/次,考察不同超声波功率60、90、120、150、180 W对多糖提取得率的影响.
2.5 正交实验
综合单因素的结果,且由于提取次数是非连续变量,定为3次[14].对其余4个因素,以多糖得率为指标,选用L9(34)正交表进行实验优化设计,其因素、水平见表1.

表1 正交实验因素与水平表
3 结果与分析
3.1 单因素实验结果3.1.1 料液比对红豆杉叶中多糖提取得率的影响
由图1可以看出:当料液比由1∶5增加到1∶25,多糖得率呈上升趋势;当料液比为1∶25时,多糖得率达到最大值,此后随着料液比进一步增大多糖得率开始降低.这可能是由于溶剂量的增加,多糖从细胞中扩散达到一定量[15],已基本溶出,继续增加溶剂的量,溶剂中溶质的量也不会增加[16],多糖质量分数反而降低[15].因此选取料液比1∶25为宜.
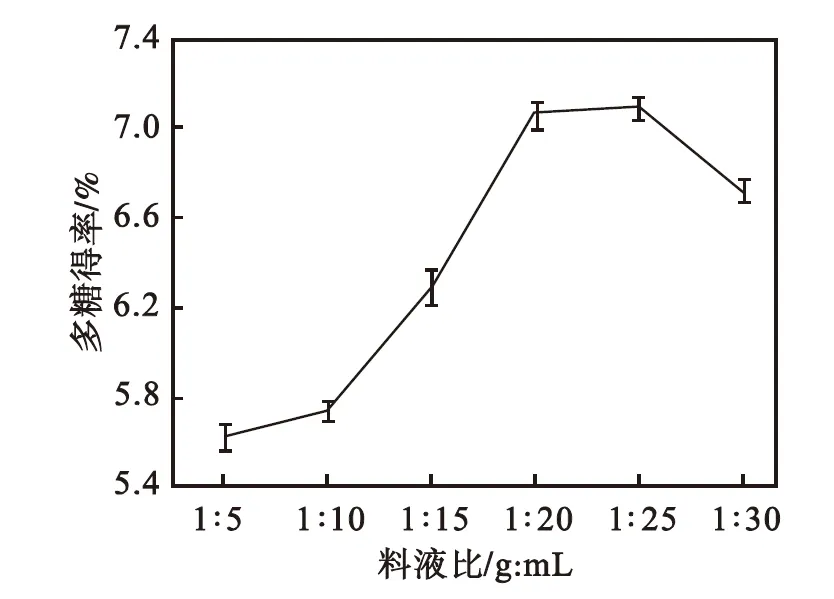
图1 料液比对多糖得率的影响
Fig.1 Effect of solid-liquid ratio on polysaccharides yield
3.1.2 提取时间对红豆杉叶中多糖提取得率的影响
提取时间对多糖得率的影响如图2所示.由图2可以看出:随着提取时间的增加,多糖得率先增加后降低,在50 min时达到最大值.在20~30 min内,多糖得率显著升高;进一步延长至50 min,多糖得率增长较小;超过50 min,多糖得率开始降低.这可能是由于长时间加热导致部分易分解多糖水解,多糖得率降低,因此选择适宜的超声波辅助提取时间为50 min.
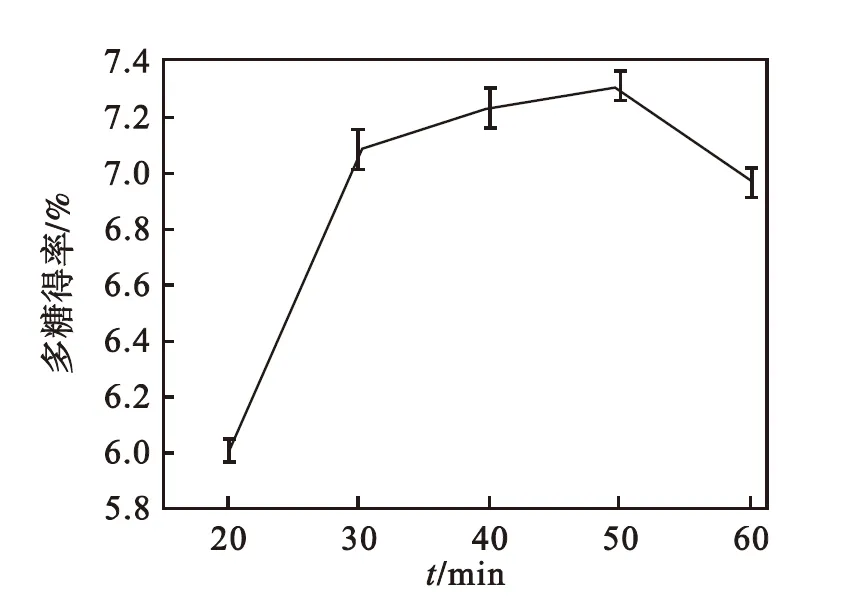
图2 提取时间对多糖得率的影响
Fig.2 Effect of extraction time on polysaccharides yield
3.1.3 提取温度对红豆杉叶中多糖提取得率的影响
由图3可看出:当温度不断升高,红豆杉叶中多糖的提取得率也不断上升.20~30 ℃多糖得率增加缓慢;在30~50 ℃随着提取温度升高,多糖得率显著增大;温度继续升高,得率增加又趋于平缓.考虑到过高的温度不仅增加能耗,还造成提取溶剂大量蒸发,影响提取效果,且可能导致部分多糖结构遭到破坏使多糖得率降低,因此,提取温度选择50 ℃为宜.
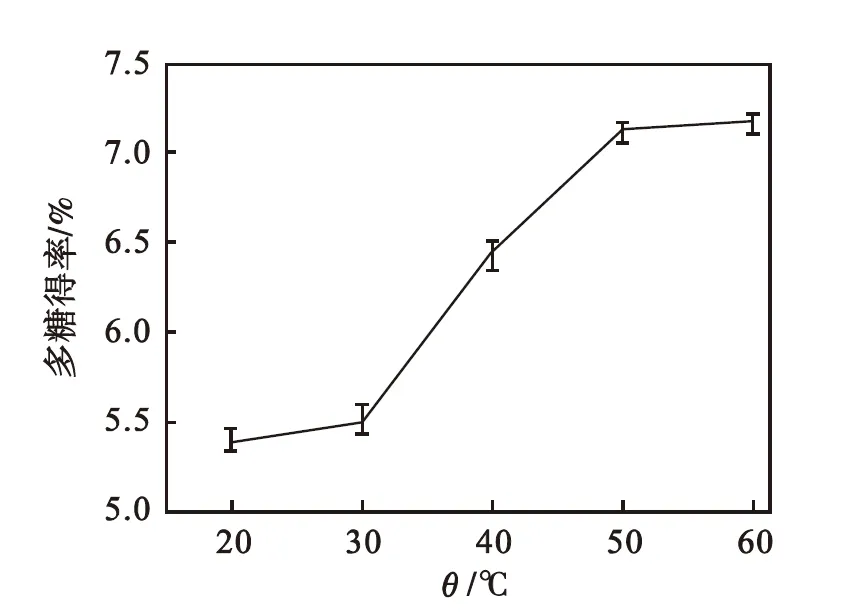
图3 提取温度对多糖得率的影响
Fig.3 Effect of extraction temperature on polysaccharides yield
3.1.4 提取次数对红豆杉叶中多糖提取得率的影响
由图4可以看出:随着提取次数的增加,多糖得率不断提高.从1次增加到3次,多糖得率显著增加,进一步增加提取次数,得率增加趋于平缓.综合考虑溶剂成本、能耗和实验效率,实验提取3次为宜.
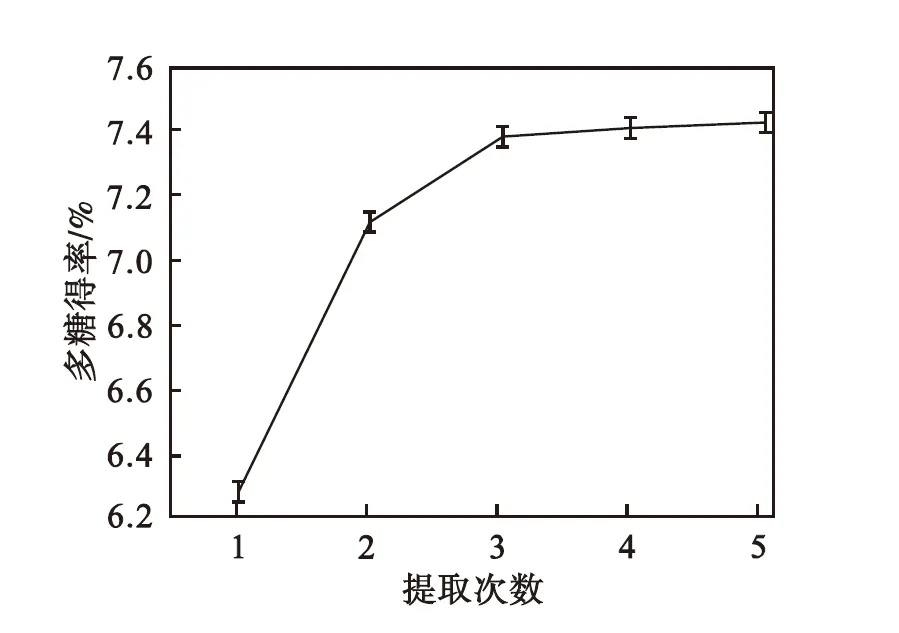
图4 提取次数对多糖得率的影响
Fig.4 Effect of extraction times on polysaccharides yield
3.1.5 超声功率对红豆杉叶中多糖提取得率的影响
由图5可看出:随着超声功率的增大,多糖得率先增加后降低.从60~150 W,随着超声功率的增大,多糖得率随之增大;当超声波功率达到150 W时,红豆杉多糖提取得率达到最大值,进一步增加超声波功率,多糖得率开始下降.这可能是由于功率过高,超声波空化、震荡作用增强[17],导致一些多糖结构被破坏,且一些非目标成分大量扩散到提取剂中,多糖溶解量相对减少[18],多糖得率相应降低.因此,选择超声波功率150 W为宜.
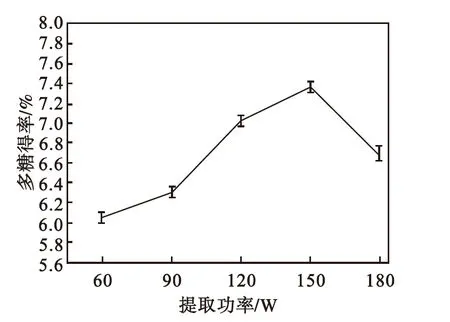
图5 超声功率对多糖得率的影响
Fig.5 Effect of ultrasonic wave power
on polysaccharides yield
3.2 正交实验结果
按表1进行正交实验,每个编号同时做3组平行实验,多糖得率以3组平均值计,结果如表2所示.从表2中极差R可以看出:各因素对多糖得率的影响顺序为料液比>提取温度>超声功率>提取时间;最佳提取条件为A1B1C2D2,即料液比1∶20,提取时间40 min,提取温度50 ℃,超声波功率150 W.方差分析(见表3)结果表明,料液比对东北红豆杉叶中多糖提取得率有显著影响.
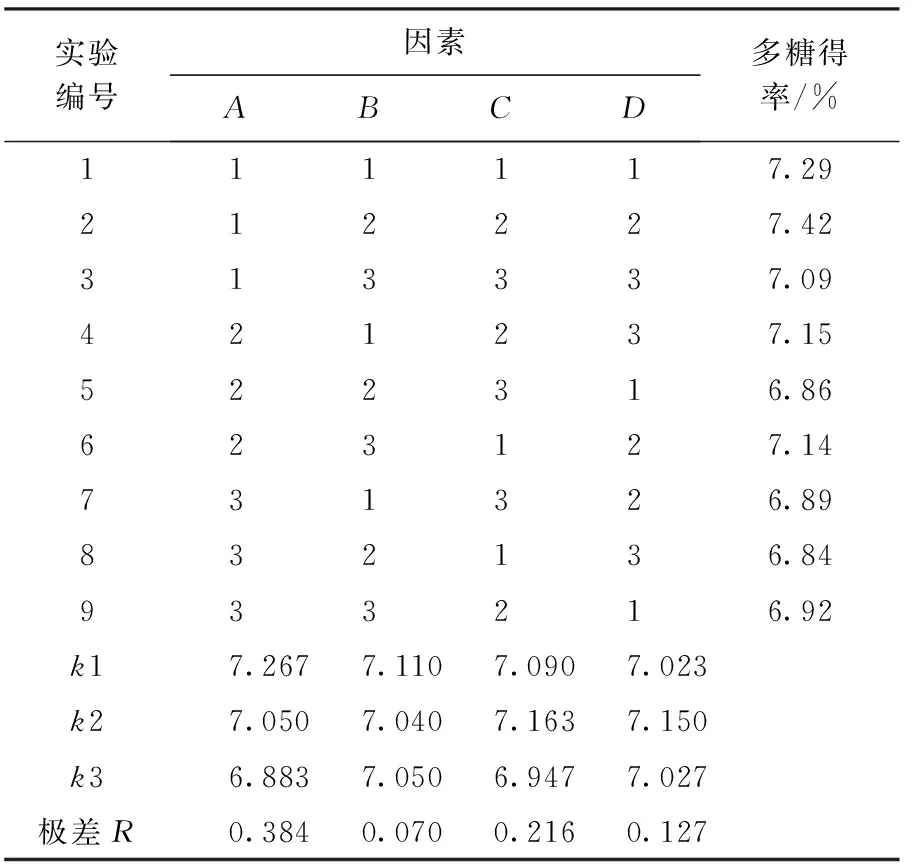
表2 正交实验结果L9(34)
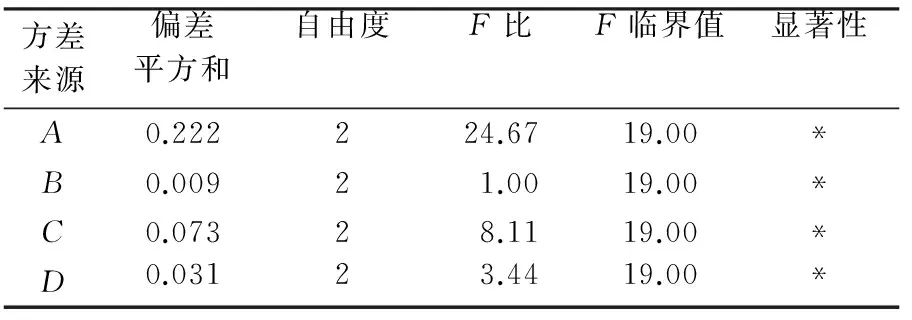
表3 方差分析表
注:F0.05(2,2)=19;*表示差异具有显著性;P<0.05.
3.3 验证实验
由于正交实验结果中未出现正交最优组合,因此需进一步验证正交最优工艺的可靠性[14].准确称取4.0 g红豆杉粉末3份,分别按照单因素和正交实验最优工艺进行验证实验,结果见表4.
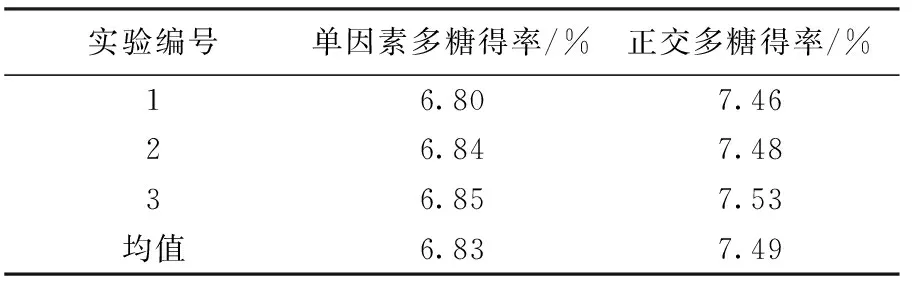
表4 验证试验结果
表4结果表明,正交最优工艺条件下多糖平均得率为7.49 %,高于单因素最优工艺得率6.83 %,同时也高于正交实验表中结果,因此选择的最优工艺条件可行.
4 不同提取方法对比实验
为比较不同提取方法对红豆杉叶中多糖提取效果的影响,以多糖得率为指标,将超声波辅助提取与热水回流提取和微波辅助进行比较实验.其中微波辅助提取条件为:料液比1∶20,微波功率300 W,间隔3 min后再辐射1 min,如此直至微波辐射时间达5 min,提取2次;热水回流提取条件为:料液比1∶25,90 ℃,提取150 min,提取2次.对比结果见表5.

表5 不同提取方法对比实验
由表5可知:不同提取方法提取红豆杉叶中多糖,其提取得率有较大差异:热水回流提取和超声波辅助提取多糖得率明显高于微波提取,分别高1.54 %和1.16 %,且微波提取温度难以控制[19],而相较于热水回流提取,超声波提取法略低于热水回流提取0.38 %,相差甚微.相对于热水回流提取,超声波辅助提取在很多方面有其优势:缩短了提取时间,提高生产效率;同时提取温度50 ℃较为温和,避免多糖结构遭到高温破坏,且降低了能耗,大大降低了生产成本.综合考虑,认为在多糖得率相差较小的情况下,超声波辅助提取是一种较理想的提取方式[20].
5 结 论
超声波辅助提取具有提取时间缩短,能耗低,提取效率高;萃取温度低,不会破坏具有热不稳定、易水解或氧化特性的有效成分;常压操作,工艺简易安全,设备投资低[12],操作简便等优点.该研究采用苯酚-硫酸法测定提取液中多糖含量,通过超声波辅助提取东北红豆杉叶中多糖的单因素和正交实验确定了最优工艺条件:料液比为1∶20,在50 ℃、150 W条件下辅助提取3次,每次提取40 min,该条件下多糖得率可达7.49 %.
研究比较了热水回流提取、微波辅助提取和超声波提取3种不同提取方法.结果表明:热水回流提取多糖得率最高(7.87 %),超声波辅助提取次之(7.49 %),微波提取最低(6.33 %).但相较于微波提取温度难以控制,热水回流提取效率低、能耗高等缺点,超声波辅助提取依旧具有其独特的优势:超声波空化作用使植物细胞壁破裂,振动作用加速了红豆杉中有效成分的扩散、溶出;提取过程常压操作,无需高温,有效地避免多糖的分解及结构破坏[8].该实验以红豆杉枝叶为原料,不仅实现了对东北红豆杉叶多糖的高效、快速提取,为进一步综合利用红豆杉资源提供一定的研究基础,而且避免了对红豆杉这一珍贵药用资源的破坏.但对于冻干所得粗多糖中多糖含量的测定,还需要进一步的研究.
[1] OBERLIES N H,KROLL D J.Camptothecin and Taxol:Historic Achievements in Natural Products Research[J].Journal of Natural Products,2004,67(2):129-135.
[2] YAO H J,JU R J,WANG X X,et al.The Antitumor Efficacy of Functional Paclitaxel Nanomicelles in Treating Resistant Breast Cancers by Oral Delivery[J].Biomaterials,2011,32(12):3285-3302.
[3] 韩飞飞.红豆杉多糖纯化、结构分析和抗肿瘤活性研究[D].浙江:浙江大学,2006:65-72.
[4] YIN Y,YU R M,YANG W,et al.Structural Characterization and Anti-tumor Activity of a Novel Heteropolysaccharide Isolated from Taxus Yunnanensis[J].Carbohydrate Polymers,2010,82(3):543-548.
[5] 原菲,宋丽艳,于荣敏.红豆杉多糖的分离鉴定和体外抗肿瘤活性测试[J].中国生化药物杂志,2011,32(1):41-43.
[6] 刘春兰,杨宇,李转秀,等.红豆杉培养物水溶性多糖的提取及清除自由基活性的研究[J].中央民族大学学报(自然科学版),2009,18(2):10-15.
[7] 朱天民,朱慧民,李辉.红豆杉多糖对犬心肌缺血-再灌注损伤左室舒张功能及心肌梗死质量的影响[J].中国微循环,2009,13(5):370-373.
[8] 张贵明,王继文,王文泽,等.朝鲜产东北红豆杉树皮中多糖提取工艺的比较研究[J].中国现代中药,2008,10(6):32-34.
[9] LIU C L,YANG Y,LI Z X,et al.Study on Extraction and Scavenging Free Radical Activity of Water Soluble Polysaccharide in Cultivate Taxus[J].Journal of the Central University for Nationalities(Natural Sciences Edition),2009(2):10-15.
[10]谢清若,郑立文,凌新龙,等.响应面法优化提取南方红豆杉枝多糖工艺条件[J].时珍国医国药,2011,22(5):1073-1075.
[11] RANGSRIWONG P,RANGKADILOK N,SATAYAVIVAD J,et al.Subcritical Water Extraction of Polyphenolic Compounds fromTerminaliaChebulaRetz.Fruits[J].Separation and Purification Technology,2009,66(1):51-56.
[12] 卞杰松,邓斌,王存嫦,等.超声波提取马鞭草中黄酮类化合物的工艺研究[J].时珍国医国药,2009,20(6):1420-1421.
[13] 卫强,张国升,刘金旗,等.微波提取红豆杉枝叶中多糖的工艺研究[J].广州化工,2014,42(5):47-50.
[14] 刘桂平,焦飞飞.超声波辅助提取杜仲叶总黄酮[J].食品与发酵工业,2013,13(11):258-261.
[15] 魏然,陈义伦,邹辉,等.超声波提取条件对圆铃大枣多糖提取率的影响[J].食品与发酵工业,2013,39(11):253-257.
[16] 荆瑞勇,王丽艳,张跃文.从脐橙皮中提取可溶性多糖工艺条件研究[J].食品科学,2009,30(8):90-92.
[17] 丁瑞瑞,令狐娅,郭春连,等.竹荪多糖提取工艺及其对肿瘤抑制作用的研究[J].广州化工2014,42(15):61-63.
[18] 黄静,郝文芳.万年蒿总黄酮超声波提取工艺的优化[J].食品与发酵工业,2012,38(1):218-223.
[19] 秦爱丽,沈君琪,陈凌,等.微波辅助浸提马齿苋活性成分的工艺[J].食品研究与开发,2014,35(12):20-23.
[20] 许慧,黄丽英.植物多糖生物活性的研究进展[J].福建医科大学学报,2010,44(1):79-82.
Ultrasonic Assisted Extraction of Taxus Polysaccharides from Taxus Cuspidate Leaves
SHI Da-jun, ZHANG Wan-zhong
(Shenyang University of Chemical Technology, Shenyang 110142, China)
The process of ultrasonic assisted extraction of polysaccharides from Taxus cuspidate leaves was studied.Through single factor and orthogonal experiment,the influences of solid-liquid ratio,extraction time,temperature,extraction times and ultrasonic power on the polysaccharides yield were investigated.The results showed that under the conditions of solid-liquid ratio 1∶20,extraction time 40 min,extraction temperature 50 ℃,ultrasonic power 150 W,three times extraction,polysaccharides yield could reach 7.49 %.This process,which was advantageous evidently,can shorten the extraction time and lower the energy cost.It provided the theoretical foundation of production process of Taxus cuspidate polysaccharides.
taxus cuspidate; polysaccharides; ultrasonic assisted extraction; yield
2014-10-26
石大骏(1990-)男,安徽安庆人,硕士研究生在读,主要从事生物化工方面的研究.
张万忠(1968-)男,安徽宿州人,教授,博士,主要从事化学工程及资源综合利用方面的研究.
2095-2198(2016)04-0316-06
10.3969/j.issn.2095-2198.2016.04.007
R914.4
A
