质量滴定法测定较高浓度金属离子溶液
2016-02-07田凤山
田凤山, 何 美
(沈阳化工大学 应用化学学院, 辽宁 沈阳 110142)
质量滴定法测定较高浓度金属离子溶液
田凤山, 何 美
(沈阳化工大学 应用化学学院, 辽宁 沈阳 110142)
通过减小滴定终点变量,适当增加乙二胺四乙酸二钠(EDTA·2Na)溶液滴定总质量以及混合缓冲液和指示剂于EDTA溶液的手段,运用质量滴定法测定较高浓度稀土离子和钙离子溶液的浓度.得到了重现性较高的实验数据,质量滴定结果的相对标准偏差(RSD)小于0.05 %.
质量滴定; 配位滴定; 高浓度稀土离子溶液; 高浓度钙离子溶液
万分之一电子分析天平可读性为0.000 1 g,但一般使用其进行精确称量要求质量尽可能的大.原因很明确,以称取0.020 0 g固体为例,这样称量结果的相对质量误差可以达到0.5 %(1/200).不同于电子分析天平,移液枪是实验室常用的拥有简单机械装置的工具,其有效数字依据量程而定,1 000 μL移液枪有4位有效数字,它的移液量是从5 μL开始的累积,基本单位是5 μL,其误差是千分之几.体积滴定法的最小单位一般是0.05 mL左右,若以50 mL滴定管滴定待测离子浓度,理想条件下相对体积误差0.1 %(0.05/50)以上.高浓度溶液体积法滴定可以直接称量几份基准试剂固体(不能直接滴定的处理成可滴定形式)进行滴定.
配位滴定分析的关键是滴定终点的判断,滴定终点是指示剂几乎完全游离时的点,最后一滴EDTA越过此点,指示剂会完全呈现游离态的颜色.这一滴的多少和滴定使用EDTA溶液的总质量直接影响实验的误差.滴定终点时金属离子的浓度降到一个相对指示剂的变色起不到作用的浓度,可认为EDTA的作用是为了使金属离子达到此状态,在所有条件都一致的条件下,EDTA使基准和待测离子都到达这种状态,那么他们都到达了滴定终点,EDTA溶液成为了连接已知和未知的媒介.
质量滴定法[1-4]或称量滴定法拥有体积滴定法不可比拟的优势,如消除了不同体积容器的误差、有效数字位数多等.众所周知,定量分析要得到较为准确和重复性较好的实验结果,应严格控制变量和适当减少操作步骤.根据以上叙述,为得到误差较小、重复性较好的实验数据,对于配位滴定,应精简实验步骤,尽量减小终点变量和增加滴定EDTA溶液的总质量.质量滴定法在溶液热力学数据测量[5-6]、含量纯度分析[4,7-8]等方面已经有了很好的应用.本文提出一种将混合指示剂和缓冲溶液EDTA看作媒介,通过已知转化放大得到未知的方法,为进一步改进和推广质量滴定法提供新的思路和方法.
1 实验及方法
1.1 试剂及仪器
主要实验试剂(括号内表示规格):ZnO(PT)、CaCO3(PT),天津化学试剂研究所;盐酸(AR)、KOH(AR)、EDTA·2Na(AR)、Y2O3(4N)、Nd2O3(3.5N)、La2O3(4N)、二甲酚橙(AR)、钙羧酸和六次甲基四胺(AR),国药集团化学试剂有限公司;实验用水均为二次蒸馏水.
分析天平,赛多利斯ALC-210.4;pH计,奥豪斯STARTER2100.
1.2 EDTA滴定高浓度氯化稀土溶液
(1) 根据滴定未知溶液的大致浓度和所用EDTA的总质量确定滴定需要的EDTA浓度.称取41 g EDTA·2Na盐置于1 L容量瓶,添加75 mL pH=5.5的六次甲基四胺-盐酸缓冲液和2.5 mL质量分数为0.2 %的二甲酚橙于容量瓶定容摇匀.
(2) 配制Zn2+标准液.称取恒质量后的基准氧化锌试剂 5~6份于100 mL三角瓶中,稍过量盐酸溶解后加热挥发多余的酸,冷却后待滴定.
(3) 标定EDTA溶液,终点颜色必须一致.使用刻度均匀的25 mL移液管,1 000 μL和100 μL移液枪作为滴定工具.在滴定颜色开始渐变时先使用1 000 μL移液枪,顺时针转动此移液枪,其会均匀滴下0.035 mL左右的液体;待快要变色使用100 μL移液枪,将其顺时针转动10圈滴下0.01 mL液体,直到滴定终点,逐级递减是为了提高效率.实验公式:
nZn=mE-T·mE
其中:nZn为锌离子的物质的量;mE-T为EDTA浓度(此处为了方便计算,EDTA浓度是指EDTA物质的量与溶液总质量之比而非质量摩尔浓度),mol/kg;mE为滴定所需EDTA溶液的质量,g.
(4) 稀土氯化物利用Spedding[9-10]等的实验方法制备,同样的滴定过程适用于滴定稀土离子.实验公式:
mRe-T·mRe=mE-T·mE
其中Re代表稀土氯化物.计算稀土氯化物的质量摩尔浓度和体积摩尔浓度可利用公式:
mRe=mRe-T/[1-(Mr·mRe-T/1 000)];
cRe=ρ·mRe-T.
其中:Mr为待测物相对分子质量;ρ为待测液密度.
1.3 高浓度钙离子的滴定
高浓度钙离子滴定条件与稀土离子滴定条件不同,为统一实验条件,EDTA标定使用碳酸钙基准试剂,添加5 mL新制质量分数为0.5 %的钙羧酸作为指示剂于1 L容量瓶.使用KOH调节EDTA溶液pH在12~12.5之间.其他过程与混合EDTA滴定氧化锌基准试剂一致.
2 结果与讨论
2.1 稀土氯化物滴定
通过上述实验叙述,可把2次滴定过程简化为:以基准试剂的质量测定EDTA的浓度,然后用该EDTA溶液滴定稀土离子的浓度.滴定简要过程及结果如表1和表2所示.表1和表2中SD指标准偏差,溶液浓度最下端的粗体表示平均值.基于EDTA作为由已知测定未知媒介的设想,把缓冲液和指示剂全部添加到EDTA溶液中,一方面指示剂浓度固定不变,另一方面已缓冲的EDTA溶液便于控制变量和精简步骤,使每次滴定的条件完全一致.利用表1、表2方法测定LaCl3和YCl3样品得到的浓度、误差和相对误差如表3所示.表4显示未混合情况下传统方法使用移液枪进行质量滴定的结果,可以看出混合后滴定结果得到不同程度的改善.
实验结果表明:条件一致情况下每次滴定达到终点结果有1~2滴的差别,在细化终点变量后指示剂的颜色出现分化,有较长拖延,滴定终点需统一标准,应以EDTA稍过量2~3滴的颜色作为参考.需要注意钕与EDTA配合呈现紫红色,直接使用高浓度EDTA滴定钕离子,终点颜色并非亮黄色.滴定终点确定后,总质量50 g左右的误差主要取决于滴定最后1~2滴EDTA溶液.总质量为100 g的EDTA滴定误差主要取决于3~4滴左右的EDTA溶液,理论上滴定总质量越大滴定终点的占比就越低,但在终点变量较小的情况下滴定总质量过多,每一滴对终点的颜色变化作用减弱,这使操作者的终点辨识难度增加,过高的滴定总质量在人力操作时对相对偏差的改善并不明显.表1是直接称量若干份基准试剂进行滴定,进一步相互印证了EDTA浓度滴定的准确性.滴定一次的相对偏差在0.02 %~0.05 %之间,结合称量误差与滴定偏差,4次滴定平均值的相对偏差(RSD)小于0.05 %,说明条件的一致有利于滴定的重现性.显然实验次数越多,偏差被分摊的次数越多,相对偏差越小.3 mol/kg 的稀土氯化物滴定标准偏差SD在0.001左右,而传统滴定方法较难实现.
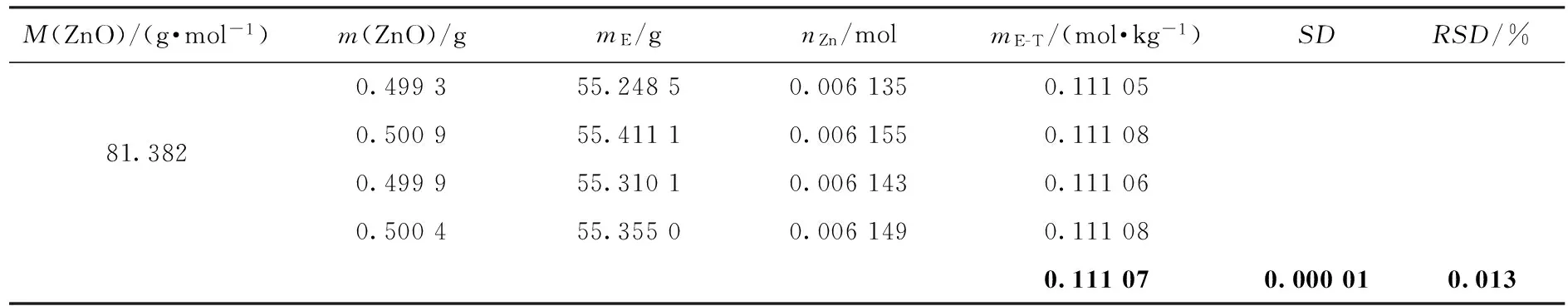
表1 质量滴定法测定EDTA混合溶液浓度的结果

表2 利用表1结果测定高浓度NdCl3溶液的滴定结果
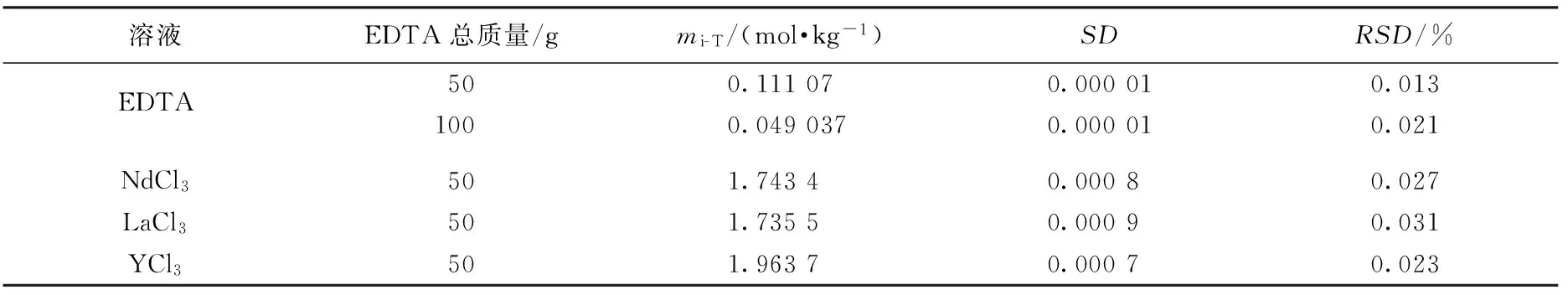
表3 质量滴定法测定较高浓度氯化稀土溶液的滴定结果和EDTA不同滴定总质量时的相对偏差比较
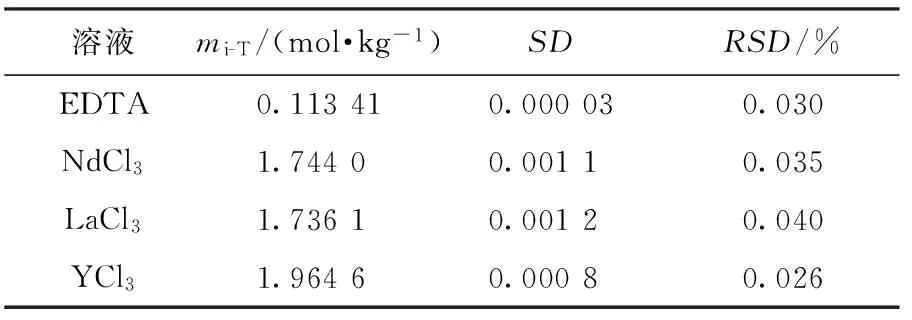
表4 缓冲溶液、指示剂与滴定总质量50 g EDTA溶液未混合的滴定结果
2.2 氯化钙滴定
表5是上述方法应用于滴定较高浓度钙离子的结果.滴定钙离子较滴定稀土离子有明显不同,不同点在于实验条件和基准试剂.实验条件的不同可通过已知、未知的严格控制变量消除,但稀土离子滴定是不同离子间的浓度转换,这种不同会产生系统误差,钙的滴定完全消除了这种不同.
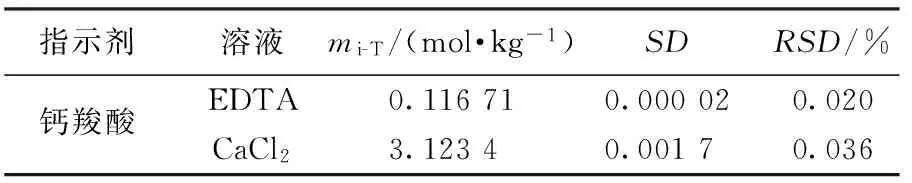
表5 质量滴定法滴定高浓度钙离子溶液的滴定结果 (EDTA总质量为50 g)
配制 EDTA溶液的pH值不宜过高,否则滴定时会出现长时间浑浊,影响滴定终点.滴定终点颜色不易把握,条件一致情况下每次滴定达到终点结果有2~3滴的差别,钙红指示剂配制成液体使用稳定性欠佳,滴定时需要现配.钙红指示剂添加到EDTA中,数小时后变质,逐滴滴定时钙红指示剂更易变质,滴定过程要迅速.SD小于0.002,滴定终点的判断较二甲酚橙指示剂稍差,熟练滴定方法,选用条件缓和的指示剂滴定可以得到更理想的结果.
3 误差分析及结论
滴定误差分为系统误差和偶然误差.首先系统误差包括基准试剂的纯度及无水处理带来的误差和滴定终点的判断误差.由于终点变量较小,每次滴定都要与滴定稍过量的颜色进行比较,如果每次都达不到终点或者严重过量,滴定结果就会出现无法察觉的误差.其次是偶然误差,称量和滴定的最后一两滴的偏差属于偶然误差,因为多一滴或少一滴可以通过多次实验消除影响.
通过实验可知质量滴定为更精确的浓度检测提供了有效手段,通过混合EDTA与缓冲溶液、指示剂等减少这些变量带来的不确定因素,精简实验步骤,起到了提高重现性的目的.尽量减小终点变量和适量增加EDTA总质量是减少实验偏差的有效途径.这种方法是把实验结果限定在与已知关联的、一个较小的范围内,实验结果与真实值的差距只有与多维度的分析方法比较才能得到,如重量法、离子色谱法等.
[1] 傅克廷,沈学优.滴定分析中应该介绍重量滴定法[J].大学化学,1988,3(6):11-14.
[2] 燕庄元.重量滴定法在高含量物质分析中应用[J].理化检验:化学分册,1995,31(3):163-164.
[3] 李红霞,董欧阳,姚燕,等.质量滴定分析方法及其应用[J].盐湖研究,2011,19(3):31-36.
[4] 李晓燕,刘凡,陈禹银.高纯苯甲酸的重量滴定分析[J].理化检验:化学分册,1999,35(3):124-125.
[5] RARD J A,MILLER D G.Isopiestic Determination of the Osmotic and Activity Coefficients of Aqueous Mixtures of Sodium Chloride and Magnesium Chloride at 25 ℃[J].Journal of Chemical and Engineering Data,1987,32(1):85-92.
[6] HE M,LONG H Z.Isopiestic Studies on Rare Earth Chloride Quaternary System(H2O+LaCl3+PrCl3+NdCl3) and Ternary Subsystems[J].Journal of Chemical and Engineering Data,2013,58(9):2654-2658.
[7] 武涵,俞秀丽,吴晓娅,等.溶液中钙镁含量准确测定的方法研究[J].盐湖研究,2013,21(4):29-33.
[8] 孙柏,李海军,赵静,等.氯化物中锂离子存在时EDTA 质量滴定锶离子含量[J].盐湖研究,2014,22(3):29-37.
[9] SPEDDING F H,WEBER H O,SAEGER V W,et al.Isopiestic Determination of the Activity Coefficients of Some Aqueous Rare Earth Electrolyte Solutions at 25 ℃.1.The Rare Earth Chlorides[J].Journal of Chemical and Engineering Data,1976,21(3):341-360.
[10]RARD J A,SPEDDING F H.Isopiestic Determination of the Activity Coefficients of Some Aqueous Rare-earth Electrolyte Solutions at 25 ℃.6.Eu(NO3)3,Y(NO3)3,and YCl3[J].Journal of Chemical and Engineering Data,1982,27(4):454-461.
Determination of Relatively High Concentration of Metal Ions in solution by Mass Titration
TIAN Feng-shan, HE Mei
(Shenyang University of Chemical Technology, Shenyang 110142, China)
Mass titration method was used to determine relatively high concentrations of rare earth ions and calcium ion in solution by means of reducing the variable of titration endpoint and increasing the titration amount of EDTA properly with buffer solution and indicator mixed together.High repeatability of experimental data was obtained and relative standard deviation(RSD) of titration results was less than 0.05 %.
mass titration; coordination titration; high concentration of rare earth ion solution; high concentration of calcium ion solution
2015-08-31
国家自然科学基金青年基金项目(21201123)
田凤山(1990-),男,安徽亳州人,硕士研究生在读,主要从事稀土溶液热力学研究.
何美(1973-),女,辽宁铁岭人,副教授,博士,主要从事溶液化学研究.
2095-2198(2016)04-0292-04
10.3969/j.issn.2095-2198.2016.04.002
O655
A
