三重复合诱变选育林可霉素高产菌株
2016-02-07毕国东牛春黄文福张萍
毕国东,牛春,黄文福,张萍
(宁夏泰瑞制药股份有限公司技术研发中心,银川 750100)
三重复合诱变选育林可霉素高产菌株
毕国东,牛春*,黄文福,张萍
(宁夏泰瑞制药股份有限公司技术研发中心,银川 750100)
以提高林可霉素的生产水平为目的,将林可霉素产生菌LK15-012先用0.6%甲基磺酸乙酯(EMS)处理3 h,然后常压室温等离子体(ARTP-200W)照射90 s、最后紫外线(UV)照射50 s。结果表明:致死率为98.5%,正突变率为71.8%。最终获得2株高产突变株LK16-032和LK16-049,摇瓶效价比出发菌株LK15-012提高了42.50%和35.25%。将两株突变株分别通过100 L小试、10 t中试和60 t大生产进行发酵验证,发酵效价明显高于生产菌株。采用EMS-ARTP-UV三重复合诱变明显提高了林可霉素的生产水平。
林可霉素;EMS-ARTP-UV三重复合诱变;高产突变株
林可霉素(Lincomycin,简称LK)是首先被发现的两个林可酰胺类抗生素中的一种,人们在1962年从内布拉斯加州林肯市附近土壤中分离得到一种链霉菌——林肯霉菌林肯变种所产生的抗生素,并因此得名,林可霉素无交叉耐药性且本身毒性较低,是临床上常用的抗生素之一[1-2]。林可霉素通过抑制菌体中蛋白质的合成起作用,能够抗大多数革兰氏阳性菌和少量厌氧的革兰氏阴性菌。其本身的毒性较低,且不像其他的抗生素那样有交叉耐药性,因此临床上被广泛用来治疗由革兰氏阳性菌引发的疾病。林可霉素和其下游的半合成产品被统称为林可酰胺类抗生素。林可霉素的抑菌机制是作用于敏感菌中核糖体,抑制肽基转移酶的活性,从而阻止肽链的延长,抑制了细菌细胞中蛋白质的合成。但在较高浓度的时候,也会对一些菌起到杀死的作用。林可霉素的产量低,不能满足工业化生产的需求[3],因此,提高林可霉素的效价对于大生产来说是必要的基础。随着科学技术的发展,基因工程、杂交育种、原生质体融合等技术的运用也为工业微生物发酵提供了坚实基础[4-5],本文采用EMS-ARTP-UV三重复合诱变法对林可霉素产生菌LK15-012进行诱变,通过初筛、复筛,HPLC法测定林可霉素的含量,最终获得了2株高产突变株。
1 材料与方法
1.1 材料
1.1.1 菌种 出发菌株LK15-012,由宁夏泰瑞制药股份有限公司技术中心进行分离纯化获得。
1.1.2 培养基 分离/斜面培养基(%,W/V):可溶性淀粉2,黄豆饼粉(生)0.6、KNO32,NaCl 0.06,K2HPO40.06,MgSO4· 7H2O 0.06,FeSO4·7 H2O 0.002,pH:7.0~7.5。种瓶培养基(%,W/V):可溶性淀粉2,黄豆饼粉(生)2,葡萄糖1,(NH4)2SO40.2,CaCO30.5,pH:7.0。发酵培养基(%,W/V):黄豆饼粉(生)3,葡萄糖10,玉米浆0.3、(NH4)2SO40.8,NaCl 0.6,K2HPO40.02,NaNO30.8,CaCO30.8,pH:7.0。
1.1.3 试剂 甲基酸酸乙酯(分析纯),硝酸钠(分析纯),硫酸镁(分析纯),葡萄糖(分析纯),氯化钠(分析纯),硝酸钾(分析纯),磷酸二氢钾(分析纯),磷酸氢二钾(分析纯),十水合四硼酸钠(分析纯),甲醇(色谱纯)。
1.1.4 设备 ARTP诱变系统ARTP-Ⅱ-026,北京思清源生物科技有限公司;BSC-1500ⅡA2-X生物安全柜,济南鑫贝西生物技术有限公司;CR21GⅢ高速冷冻离心机,日立HITACHI;DHZ-2001B全温度振荡培养箱,太仓市华美生化仪器厂;LC-20AT型高效液相色谱仪,日本岛津公司;C18色谱柱4.6 mm×250 mm,5 μm;XDW25/96型旋转摇瓶机,乐山长征制药机械有限公司;净化工作台,无锡市荣丰净化空调设备厂;XDW25/160摇瓶机,乐山长征制药机械有限责任公司;PHS-3C酸度计,上海精密科学仪器有限公司;BSA3202S-CW型电子天平,赛多利斯科学仪器(北京)有限公司;DHZ-2001B恒温恒湿培养箱,上海博讯实业有限公司医疗设备厂;BC-118F、DW-86L286冰箱,青岛海尔电器有限公司;SP-400型冰箱,沈阳市伟民医疗器械有限公司;紫外诱变箱和78-1型磁力搅拌器,江苏省金坛市荣华仪器制造有限公司;低速离心机,上海安亭科学仪器厂; 10 μL、50 μL、100 μL、1 mL和5 mL移液枪,Eppendorf公司;SPX-250B型生化培养箱,上海申光仪器仪表有限公司。
1.2 方法
1.2.1 林可霉素单孢子悬浮液的制备 取林可霉素产生菌菌种斜面(LK15-012),加入0.85%的生理盐水15 mL, 洗脱斜面,将洗脱液移入组织研磨器中,充分研磨,将研磨后的孢子悬浮液过滤至已灭过菌的带盖小瓶中待用。
1.2.2 甲基磺酸乙酯(EMS)处理 取5 mL孢子悬浮液置于三角瓶中,加入20 μL 0.5%的EMS,在摇床上振荡,分别取不同时间的处理液,稀释,按10-1、10-2、10-3、10-4、10-5和10-6梯度进行稀释涂双碟,于温度29~31℃、相对湿度15%~25%的环境下倒置培养8 d,得到EMS诱变后的单菌落,计算致死率和正变率。
1.2.3 常压室温等离子体(ARTP)诱变 吸取孢子悬浮液20 μL,加到无菌芯片上(每五个芯片为一组),将ARTP功率调至200 W,将加有孢子悬浮液的芯片置于ARTP诱变系统中,设定不同照射时间,将照射后的芯片放入试管中,加生理盐水振荡,稀释,按10-1、10-2、10-3、10-4、10-5和10-6梯度进行稀释涂双碟[6],于温度29~31℃、相对湿度15%~25%的环境下倒置培养8 d,得到ARTP诱变后的单菌落,计算致死率和正变率。
1.2.4 紫外线(UV)诱变 吸取5 mL孢子悬浮液,放入Φ60含搅拌子的双碟中,置于磁力搅拌器上,开动搅拌,在避光条件下用15 W紫外灯距离30 cm照射不同时间[7],将照射后的孢子悬浮液稀释,按10-1、10-2、10-3、10-4、10-5和10-6梯度进行稀释涂双碟,于温度29~31℃、相对湿度15%~25%的环境下培养8 d,得到UV诱变后的单菌落,计算致死率和正变率。
1.2.5 EMS-ARTP-UV三重复合诱变处理 按1.2.1项方法制备单孢子悬浮液,吸取孢子悬浮液10 mL至三角瓶中,加3 mL 0.5%的EMS溶液处理3 h。吸取EMS处理过的孢子悬浮液20 μL加到无菌芯片上。将芯片置于ARTP-200W照射90 s,将照射后的芯片放入无菌试管中,加无菌生理盐水洗脱照射的芯片,充分振摇后,吸取孢子悬浮液5 mL放入含Φ60搅拌子的双碟中,置于磁力搅拌器上,开动搅拌,在避光条件下,用15 W紫外灯距离30 cm照射20、30、40、50、60、70、80 s。照射完毕后将诱变后的菌悬液按10-1、10-2、10-3、10-4、10-5和10-6梯度进行稀释涂双碟,于温度29~31℃、相对湿度15%~25%的环境下倒置培养8 d,计算致死率和正变率。
1.2.6 出发菌株的选择 用生产斜面进行分离纯化,经筛选选择LK15-012为出发菌株,含量为4182 U/mL。
1.2.7 单菌落筛选
1.2.7.1 挑选单菌落 在无菌条件下挑取培养成熟的单菌落接种至试管斜面上,共挑取110支斜面,于温度29~31℃、相对湿度15%~25%培养。
1.2.7.2 初筛 将培养好的试管斜面接入一级发酵瓶,一支斜面接一个发酵瓶,于温度29~31℃、相对湿度15%~25%的条件下进行摇瓶培养,培养结束后放瓶测定含量。
1.2.7.3 复筛 根据初筛结果挑取8个含量高的一级摇甁进行复筛,复筛采用二级发酵,一支斜面接一个种子瓶,于温度29~31℃、相对湿度15%~25%的条件下进行摇瓶培养,培养结束后接发酵瓶,一瓶种子瓶接三瓶发酵瓶,于温度29~31℃、相对湿度15%~25%的条件下进行摇瓶培养,培养结束后放瓶测定含量。
1.2.8 稳定性考察 对筛选出的2个单菌落同时进行传代,连续传五代,待斜面培养成熟后进行含量测定。
1.2.9 保藏方法 将诱变筛选出的2个单菌落进行分离纯化,用沙土管和低温管保藏法保藏,以备发酵生产使用。
1.2.10 HPLC测定 取摇瓶发酵液10 mL,转入10 mL离心管中,于10000 r/min,离心10 min,取上清液0.5 mL转入另一支10 mL离心管中,加入4.5 mL硼砂-甲醇溶液,摇匀后于3000 r/min离心10 min,取上清液用孔径0.22 μm水相针式滤膜过滤,取过滤液10 μL进液相色谱柱,峰面积为林可霉素含量(U/mL)。
2 结果与分析
2.1 对LK15-012出发菌株诱变处理结果
2.1.1 甲基磺酸乙酯(EMS)处理 如表1所示。

表1 EMS诱变的致死率和正突变率
从结果看,当EMS处理时间达到6 h时,菌体致死率为100%。考虑后续的ARTP诱变和UV诱变,需要选择EMS处理时间不宜过长,保留一定的菌体存活量,可顺利进行下一步实验操作。为此选择EMS处理3 h为宜。
2.1.2 常压室温等离子体(ARTP)诱变处理 结果见表2和图1。可以看出,ARTP照射时间越长,致死率和正变率越高,考虑后期UV照射,最后选择ARTP照射90 s为处理时间。2.1.3 紫外线(UV)诱变处理 如图2和表3所示。

图1 ARTP诱变致死曲线

图2 UV诱变致死曲线

处理时间/s致死率/%正变率/%6068.430.17078.637.58085.448.69091.856.810096.552.411099.560.2120100-
由结果可知,紫外线照射时间越长,致死率和正变率也越高,综合前期对孢子悬浮液进行EMS和ARTP的处理,最后对其进行的处理时间不宜过长,所以选择照射时间为50 s为宜。
2.1.4 EMS、ARTP和UV三种方式组合的处理 结果如表4所示。

表3 UV诱变的致死率和正突变率

表4 不同方式组合处理的致死率和正突变率
从以上数据可知,EMS、ARTP和UV的三重复合处理后,其致死率达到98.5%,正变率71.8%,高于其他任何组合方式以及各种方式单独处理,所以选择三重复合诱变有其独特的优势。
2.1.5 对高产突变株进行稳定性验证 如表5、表6和表7所示。
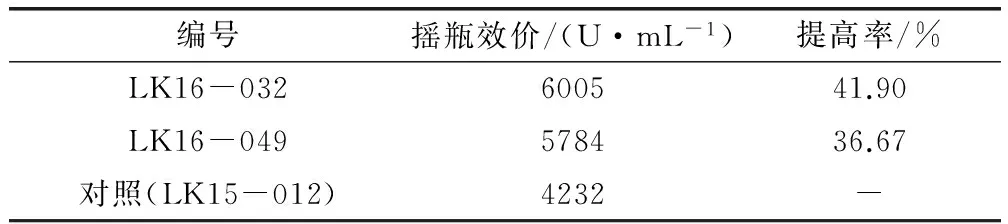
表5 初筛结果

表6 复筛结果

表7 稳定性验证
从复筛结果可知,两株高产突变株相对于初筛效价比较稳定,从传代结果可以得出菌株LK16-049的稳定性比LK16-032高。总体诱变效果对比,在传代5次后,相对于其他诱变方法,菌株的传代稳定性比较高。
2.1.6 将高产突变株LK16-032和LK16-049通过100 L小试罐、10 t中试罐和60 t发酵罐验证 如图3、图4和图5所示。将高产突变菌株分别通过100 L小试、10 t中试和60 t大生产进行发酵验证(图3~图5),高产突变株LK15-032比生产菌株分别提高17.3%、15.4%和5.7%;LK15-049比生产菌株分别提高了15.7%、14.2%和4.9%。两支高产突变株在各级发酵罐上的产率和稳定性较好。
3 讨论和小结
目前国内在菌种选育方面,李红德[8]经紫外线(UV)处理林可霉素,其平均效价比自然分离株相对能力只提高了2%,单一的诱变方式效果不明显。而曹书祥等[9]采用硫酸二乙酯(DES)和紫外线(UV)对林可霉素进行了二重复合诱变,筛选的菌株产量比出发菌株高29.6%。朱立元等[10]用紫外线(UV)、氯化锂(LiCl)和甲基磺酸乙酯(EMS)三重复合诱变处理林可霉素,其摇瓶的产量比出发菌株高25%。多种诱变方式的组合可以明显提高菌种诱变的概率。

图3 100 L小试罐

图4 10 t中试罐

图5 60 t发酵罐
本文主要采用EMS-ARTP-UV三重复合诱变,尤其是应用了现在最新的诱变系统-常压室温
等离子体(ARTP),常压低温等离子体中的高浓度活性粒子能够作用于微生物的遗传物质,使其在短时间内产生致畸突变,相比传统的离子束注入、放射线诱变和化学诱变的效率更高。通过实验证明应用EMS-ARTP-UV诱变效果显著,最终获得了2株稳定性较好的LK16-032和LK16-049高产突变株,摇瓶效价比对照高42.5%和35.25%。而且在后期的小试罐、中试罐和发酵大生产上放罐效价明显高于生产菌株,两支高产突变株在各级发酵罐上的产率和稳定性较好,明显提高了林可霉素的生产水平。
[1] Chang F N,Weisblum B Gottlieb, D. J W,etal.Lincomycin, In: Antibiotics. Mechanism of action[M]. Berlin:Springer Berlin Heidelberg,1979:396-419.
[2] Wright J L C,Vining L .C:The lincomycin-celesticetin-anthramycin group, Biochemistry and Genetic Regulation of Commercially Important Antibiotics[J]. Journal of Bacteriology,1983,181(23):7346-7355.
[3] 王倩. 林可霉素菌种选育及条件优化[D]. 上海:华东理工大学, 2008.
[4] 乔现婷. 林可霉素高产菌株的选育及代谢过程的调控[D].上海:华东理工大学, 2012.
[5] 周德庆. 微生物教程[M]. 北京: 高等教育出版社, 2002: 213- 215.
[6] 沈小静, 张萍, 石彦鹏.常压室温等离子体结合紫外诱变筛选红霉素高产菌株[J]. 中国兽药杂志, 2015, 49(1): 19- 23.
[7] 高宏伟, 张萍, 石彦鹏, 等.紫外-氯化锂复合诱变选育泰妙菌素高产菌株[J]. 中国兽药杂志, 2011, 45(3): 18- 19.
[8] 李红德, 王冰, 路建同, 等. 推理选育林可霉素高产菌株[J]. 解放军药学学报, 2005, 21(5): 386-388.
[9] 曹树祥, 曾文瑜, 黎苇. 林可霉素高产菌的筛选[J]. 中国抗生素杂志, 2008, 33(8): 505-508.
[10]朱立元, 刘瑞华. 林可霉素高产菌种的选育[J]. 安徽医药, 2001, 5(2): 89-90.
(编辑:侯向辉)
Triple Breeding of Lincomycin Producing Strain
BI Guo-dong,NIU Chun*, HUANG Wen-fu,ZHANG Ping
(TerryPharmaceuticalCoLtd,NingxiaInstituteofBacteria,Yinchuan750100,China)
In order to improve the level of production of lincomycin, clindamycin producing bacteria LK15-012 treated with 0.6% ethyl methyl sulfonic acid (EMS)3 h, the second with atmospheric pressure plasma (ARTP-200w) at room temperature irradiation of 90 s, finally by ultraviolet (UV) radiation 50 s. The results showed that the mortality rate was 98.5%, the positive mutation rate is 71.8%. Won 2 strains of high yield mutant strains LK16-032and LK16-049, shake flask titer than the starting strain LK15-012 increased by 42.50% and 35.25%.Will be high yield mutant strain respectively through the test in 100 L, 10 t pilot and 60 t fermentation carried out to verify the mass production, significantly higher than the production strains fermentation titer. The EMS-ARTP-UV triple compound mutagenesis lincomycin production levels are increased obviously.
lincomycin; EMS-ARTP-UV mutation mutated;high-producing strain
毕国东,助理工程师,从事抗生素发酵菌种选育研究。
2016-08-04
A
1002-1280 (2016) 11-0022-05
S859.796
