一株欧亚类禽H1N1猪流感病毒分子特征分析
2016-02-07赵化阳王金亮刘金华许冠龙侯东军文晶亮邢佳鹏郑杰张连祥
赵化阳,王金亮,刘金华,许冠龙,侯东军,文晶亮,邢佳鹏,郑杰,张连祥
(1.华都集团北京市兽医生物药品厂,北京102209;2.中国农业大学动物医学院,北京100193;3.中国动物疫病预防控制中心,北京100125)
一株欧亚类禽H1N1猪流感病毒分子特征分析
赵化阳1,王金亮2,刘金华2,许冠龙2,侯东军3,文晶亮1,邢佳鹏1,郑杰1,张连祥1
(1.华都集团北京市兽医生物药品厂,北京102209;2.中国农业大学动物医学院,北京100193;3.中国动物疫病预防控制中心,北京100125)
为调查国内猪流感病毒流行和遗传演化状况,将2013年从山东某屠宰场的采集样品接种SPF鸡胚,分离到1株病毒,通过RT-PCR鉴定和全基因测序,并运用生物软件对病毒基因组关键氨基酸位点和遗传演化关系进行分析。结果显示,分离株A/Swine/Shandong/5513/2013 (H1N1)为欧亚类禽H1N1猪流感病毒,基因片段未发生重排,与中国大陆近几年分离株类似。HA蛋白受体结合位点具有结合哺乳动物气管上皮细胞特性;HA蛋白抗原位点与欧亚类禽H1N1猪流感代表株A/swine/Hong Kong/1780/2008(H1N1)仅有一处不同,Q196H;裂解位点氨基酸为PSIQSR/GL,PB2蛋白毒力关键氨基酸位点为T271和E627,分离株为典型低致病力毒株。本毒株的分离鉴定为分析中国大陆猪流感流行状况和分子特征提供了数据。
H1N1猪流感病毒;欧亚类禽;分子特征
一般认为猪是流感病毒的基因“混合器”,其气管上皮细胞既有α-2,3-Sias受体,又具有α-2,6-Sias受体,既可感染禽流感病毒,又可以感染人类流感病毒,在A型流感病毒变异重排和传播中发挥重要作用[1]。目前,全球猪群流行着H1N1, H1N2和H3N2等亚型流感病毒[2]。其中,经典H1N1猪流感首次在1918年分离到[3],欧亚类禽H1N1猪流感病毒首次分离于1979年[4]。近些年,欧亚类禽H1N1猪流感病毒在中国大陆猪群逐步蔓延[5-6],在欧洲及中国造成多起人类感染病例,且有一例死亡病例[7],而且该类型病毒多数可以通过飞沫在哺乳动物(雪貂)模型中有效传播[8],对人类健康构成较大威胁,因此监测和研究欧亚类禽H1N1猪流感病毒具有重要的公共卫生学意义。本研究对2012-2013年流感季分离鉴定的一株欧亚类禽H1N1猪流感病毒进行遗传演化和分子特征进行分析,为猪流感的防控提供参考数据。
1 材料与方法
1.1 毒株的分离与鉴定 2013年1月,从山东某屠宰场共采集猪咽喉棉拭子样品600份,样品经青链霉素PBS缓冲液处理,冷藏运输至实验室。接种10日龄SPF鸡胚,3 d后收集尿囊液,用1%鸡红细胞检测血凝活性,血凝阴性的样本,盲传2代,再次检测血凝性。具有血凝性的样品,提取核酸,进行RT-PCR方法鉴定。
1.2 病毒基因序列测定 猪流感病毒引物设计和RT-PCR扩增方法参照已有文献[6,9]。引物由上海生工公司合成,PCR产物送北京六合华大基因科技股份有限公司测序。
1.3 病毒的遗传进化与分子特征分析 应用NCBI网站资源对分离株基因序列进行同源性比对;采用MEGA6.0 软件进行进化分析并绘制进化树,算法采用Neighbour-joining 法, Bootstrap 值选择 1000 重复;并使用 MEGA6.0 将核苷酸序列翻译成氨基酸序列,然后对氨基酸序列进行流感病毒分子特征分析[5]。
2 结果
2.1 SIV病毒的分离鉴定与命名 采集样品经病毒分离、RT-PCR鉴定及序列比对,确认分离1株H1N1亚型猪流感病毒,命名为A/Swine/Shandong/5513/2013 (H1N1)(简称SW/SD/5513/13)。
2.2 病毒的遗传进化分析 在NCBI网站下载猪流感病毒代表性毒株基因序列,通过与分离株进行基因比对,分析其遗传进化关系。结果表明,SW/SD/5513/13的HA基因属于欧洲类禽H1N1流感病毒分支,与近些年在大陆和香港猪流感病毒遗传关系较接近(图1)。NA及其他6个内部基因进化树比对结果显示,均未发生基因重排。

▲代表分离毒株-A/Swine/Shandong/5513/2013 (H1N1)图1 EA H1N1 SIV分离株HA基因进化树
2.2.1 病毒的同源性分析 分离的SW/SD/5513/13毒株测序结果经NCBI BLAST,发现8个基因片段均处于欧亚类禽进化分支,与近期欧洲及亚洲流行的SIV同源性均大于等于99%(表1)。
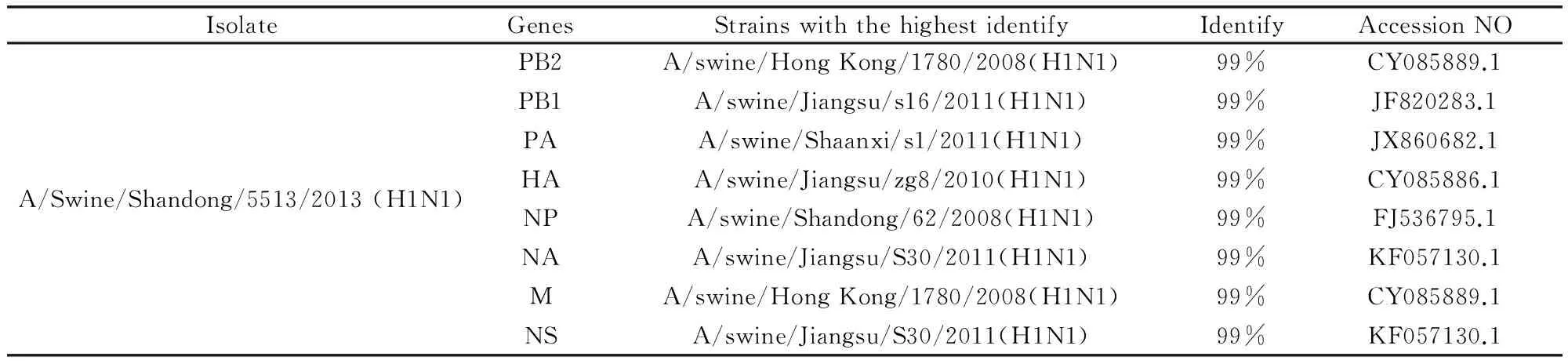
表1 病毒基因片段同源性分析
2.2.2 HA主要氨基酸位点及抗原位点分析
2.2.2.1 裂解位点 对氨基酸序列分析发现,分离株SW/SD/5513/13 HA裂解位点氨基酸序列为PSIQSR/GL,与近年来欧洲类禽H1N1病毒HA裂解位点氨基酸组成相同,碱性氨基酸数量相对较少,为低致病力毒株。
2.2.2.2 受体结合位点 分离株SW/SD/5513/13毒株在HA蛋白受体结合位点处第155、159、226和228分别为V、N、Q和G,190位氨基酸为D,225位氨基酸为E(表2),符合感染哺乳动物宿主的条件。

表2 猪流感病毒分离株HA受体结合位点分析
1: Isolate; 2: EA H1N1; 3: 2009/H1N1; 4: Classical swine H1N1 ; 5: Human H1N1;
2.2.2.3 糖基化位点 分离株SW/SD/5513/13与近年流行欧亚类禽H1N1 SIV的毒株具有相同数量的糖基化位点(第13、26、198、277、484、543位)。2.2.2.4 抗原位点 对H1亚型病毒HA1上5个抗原决定簇区域:Sa、Sb、Ca1、Ca2和Cb进行氨基酸位点分析,与各类型猪流感对照株比较发现,分离株SW/SD/5513/12与SW/HK/1780/2008抗原位点氨基酸组成最为相似,只在第196位氨基酸(196H)与SW/HK/1780/2008 毒株不同(196Q)(表3)。
2.2.3 致病力分析 分离株SW/SD/5513/2013 PB2蛋白未发生T271A和E627K 突变,且701位氨基酸为N,结果表明该毒株可在哺乳动物体内复制,但致病力较低。
3 讨论
基因重排是流感病毒变异的重要方式之一。由于猪群对禽流感和人流感病毒均易感,因此,猪体内可能会重排产生对人类具有高致病性的新型流感病毒。目前在世界范围内,猪流感病毒疫苗使用率极低,难于预防和控制其扩散,因此监测猪群流感发病状况,分析猪流感病毒分子遗传演化,确切地掌握猪流感的变化趋势,为人类流感病毒的发生提供预警。作为猪流感病毒的重要一个类型,欧亚类禽H1N1猪流感首先分离自欧洲大陆的意大利[4],2005年后在中国大陆逐渐大范围流行[6]。虽然其致病力相对较低,但可感染人类,可以通过空气飞沫传播,因此值得关注。
本研究对山东地区2013流感季节的分离株,进行遗传演化和分子特征分析。发现该毒株未发生基因重排,所有基因片段同源性最高的毒株均为欧洲类禽类型。HA基因进化树分析,该毒株与SW/Jiangsu/zg8/2010(H1N1)、SW/Shaanxi/s1/2011等2008年后中国大陆分离的类禽猪流感病毒同源性较高[5-6],表明了欧亚类禽猪流感在我国猪群感染具有持续性。与EA H1N1代表毒株A/swine/Hong Kong/1780/2008(H1N1)相比,分离株SW/SD/5513/2013 HA受体结合位点发生190D等突变,表明可有效感染哺乳动物和人类;分离株潜在的糖基化位点数量与参考株一致。除Sb抗原决定簇196位氨基酸位点不同,分离株病毒抗原性与类禽代表毒株SW/HK/1780/2008其余31个抗原位点氨基酸完全相同,但与2009H1N1、经典猪流感和人源猪流感毒株HA抗原位点存在大于10个氨基酸位点的不同。PB2关键氨基酸位点未发生突变,对哺乳动物致病力也相对较低,保持了欧亚类禽猪流感的低致病性特征。
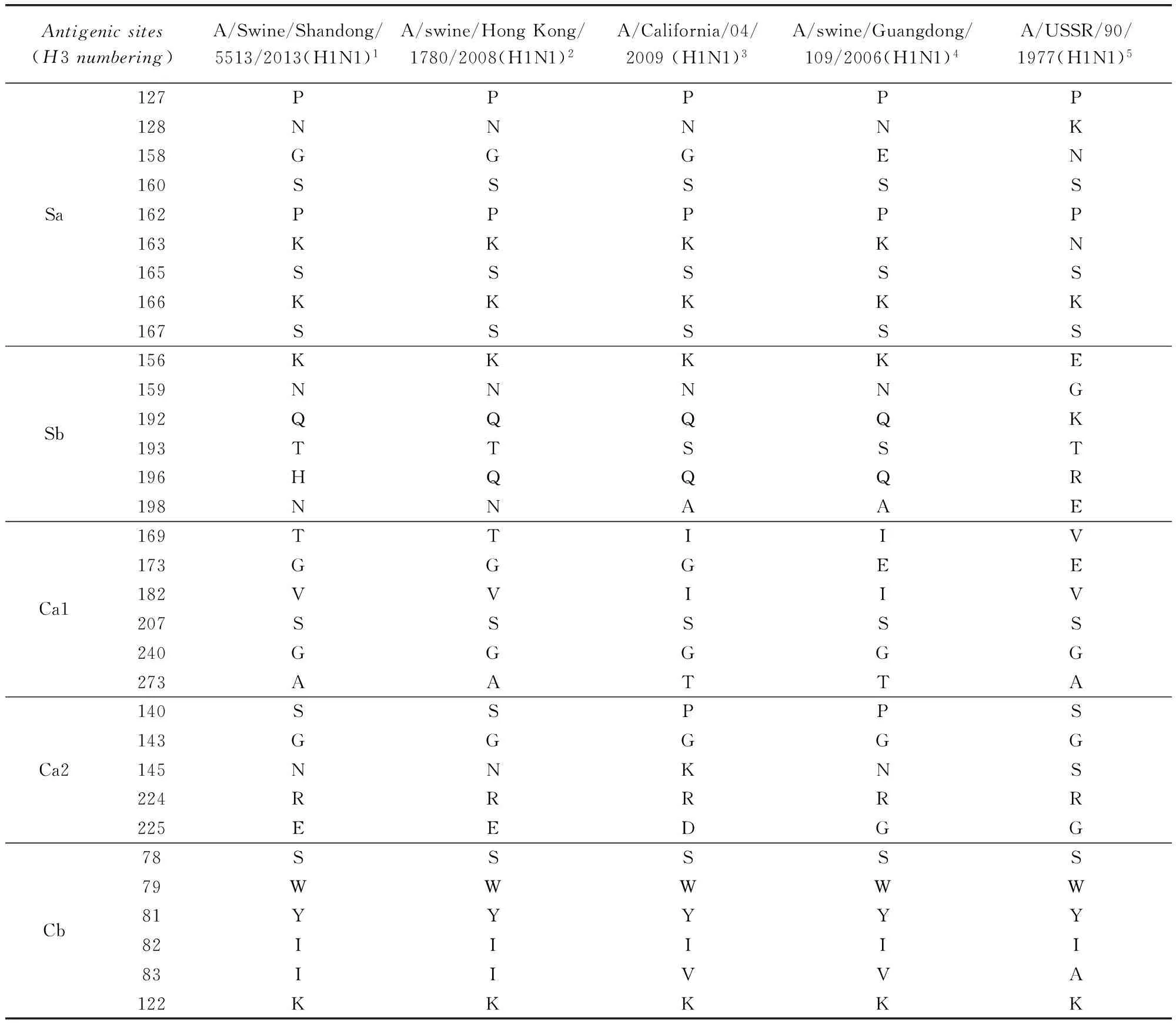
表3 猪流感分离毒株HA抗原位点分析
1: Isolate; 2: EA H1N1; 3: 2009/H1N1; 4: Classical swine H1N1 ; 5: Human H1N1
对分离毒株分子特征分析表明,该毒株与2008年来流行毒株基因特性基本类似,但存在个别氨基酸的突变,导致更有效的感染人类和哺乳动物呼吸道。应进一步监测我国猪群中SIV流行株的基因变异、基因型优势,以及病毒的致病力和传播特性,分析目前流行毒株潜在的人际间传播可能。
[1] Ito T, Couceiro J N, Kelm S,etal. Molecular basis for the generation in pigs of influenza A viruses with pandemic potential[J]. J Virol, 1998, 72(9):7367-7373.
[2] Brown I H. The epidemiology and evolution of influenza viruses in pigs[J]. Vet Microbiol, 2000, 74(1/2):29-46.
[3] Shope R E. Swine influenza: I. Experimental transmission and pathology[J]. J Exp Med, 1931, 54(3):349-359.
[4] Pensaert M, Ottis K, Vandeputte J,etal.Evidence for the natural transmission of influenza A virus from wild ducts to swine and its potential importance for man[J]. B World Health Organ, 1981, 59(1):75-78.
[5] 付新亮,方博,王丽芳,等. 一株 H1N1亚型猪流感病毒的分离鉴定及其遗传进化分析[J].中国预防兽医学报, 2015, 37(5): 348-352.
[6] Liu Jin-hua, Bi Yu-hai, Qin Kun,etal. Emergence of Europeanavian influenza virus-like H1N1 swine influenza A viruses in China [J]. J Clin Microbiol, 2009, 47(8): 2643-2646.
[7] Qi X, Cui L, Jiao Y,etal. Antigenic and genetic characterization of a European avian-like H1N1 swine influenza virus from a boy in China in 2011[J]. Arch Virol, 2013, 158(1):39-53.
[8] Yang H,Chen Y, Qiao C,etal. Prevalence, genetics, and transmissibility in ferrets of Eurasian avian-like H1N1 swine influenza viruses[J]. PNAS, 2016, 113(2):392-397.
[9] Hoffmann E, Stech J, Guan Y,etal. Universal primer set for the full-length amplification of all influenza A viruses [J]. ArchVirol, 2001, 146(12): 2275-2289.
[10]Moreno A, Di Trani L, Faccini S,etal. Novel H1N2 swine influenza reassortant strain in pigs derived from the pandemic H1N1/2009 virus [J]. Vet Microbiol, 2011, 149(3/4): 472-477.
(编辑:李文平)
Molecular Characteristic Analysis of an Isolate of Eurasian Avian-like H1N1 Swine Influenza Virus
ZHAO Hua-yang1, WANG Jin-liang2, LIU Jin-hua2, XU Guan-long2, HOU Dong-jun3,WEN Jing-liang1, XING Jia-peng1, ZHENG Jie1,ZHANG Lian-xiang1
(1.Hua-duGroupBeijingVeterinaryBiologicsFactory,Beijing102209,China;2.CollegeofVeterinaryMedicine,ChinaAgriculturalUniversity,Beijing100193,China;3.ChinaAnimalDiseasesControlCenter,Beijing100125,China)
To investigate SIV epidemic and mutant in China, we isolated one strain of SIV at one slaughter house in Shandong province in 2013, and it was identified as Eurasian avian-like H1N1 SIV (EA H1N1 SIV) by gene sequencing.Genes aligning analyzed by MEGA6.0 software shows that the isolate A/Swine/Shandong/5513/2013 (H1N1) is similar with EA H1N1 SIV epidemic in Northern China in recent years. Analysis of HA receptor sites amino acids illuminates that the isolate prefer to bind mammalian cells, not avian cells.Amino acids at the HA antigen site are same with A/swine/Hong Kong/1780/2008(H1N1), except the site 196 (Q196H).The isolate shows characteristic of low pathogenic according to the cleavage site amino acid(PSIQSR/GL)and T271 and E627 on PB2 coded protein. The information of this isolate is valuable for investigating SIV epidemiology in China.
H1N1 swine influenza virus;Eurasian avian-like; molecular characteristic
赵化阳,博士,助理研究员,从事兽用生物制品研发工作。E-mail:cxzhhy@163.com
2016-09-12
A
1002-1280 (2016) 11-0027-05
S852.65
