刺五加多糖对雏鸡脾脏中T、B淋巴细胞定位分布的影响
2016-02-07张英楠杨树宝单春兰胡庆花孙播东刘洪章
张英楠,杨树宝,单春兰,胡庆花,孙播东,刘洪章
(1. 吉林农业大学生命科学学院,长春 130118;2. 长春科技学院,长春 130600;3. 吉林农业大学动物科技学院,长春 130118)
刺五加多糖对雏鸡脾脏中T、B淋巴细胞定位分布的影响
张英楠1, 2,杨树宝3,单春兰3,胡庆花3,孙播东3,刘洪章1*
(1. 吉林农业大学生命科学学院,长春 130118;2. 长春科技学院,长春 130600;3. 吉林农业大学动物科技学院,长春 130118)
为了研究雏鸡注射不同浓度刺五加多糖(ASPS)后脾脏中T、B淋巴细胞定位分布的变化情况,将60 只1 日龄雏鸡随机分为3组:对照组、低剂量组和高剂量组,每组20只,10日龄起对低、高剂量组雏鸡分别皮下注射免疫50和200 mg/mL的ASPS 0.2 mL,对照组雏鸡以相同方式注射等体积的生理盐水,连续注射4 d。于末次免疫后第7天和第14 天,从每组中分别随机选取5只雏鸡,取其脾脏制作冰冻切片,采用免疫组织化学方法检测CD3+T淋巴细胞和Bu-1+B淋巴细胞的定位分布。结果显示,与对照组比较,低、高剂量组在注射后的7 d和14 d ASPS均能增加脾脏中CD3+T淋巴细胞和Bu-1+B淋巴细胞的数量,由CD3+T淋巴细胞构成的脾脏特征性结构-动脉周围淋巴鞘(PALS)的面积也显著增加,红髓中CD3+T淋巴细胞也明显增多,分布范围逐渐增加;同时,由Bu-1+B淋巴细胞构成的椭球周围淋巴鞘(EALS)的面积也明显增加,红髓和白髓中的浆细胞数量显著增多,并在注射后14 d时出现生发中心。与对照组比较,高剂量组和注射后14 d时上述变化趋势更为明显。结果表明,ASPS能够增加脾脏中T、B淋巴细胞的数量,并且能够影响其在PALS、EALS等脾脏特征性结构中的定位分布,从而从组织学角度进一步证明ASPS对鸡免疫功能具有显著的增强作用。
刺五加多糖;雏鸡;脾脏;T淋巴细胞;B淋巴细胞;定位分布
刺五加多糖(Acanthopanaxsenticosuspolysaccharide,ASPS)是从刺五加根茎中分离出的免疫活性多糖,体内外多项研究均表明其具有调节动物免疫机能、抗氧化、抗肿瘤和抗感染等功效[1-3]。目前对于刺五加多糖的研究多集中于人类医学领域,其在畜禽业上的应用研究较少。刺五加是吉林省长白山地区物美价廉的道地药材,因此结合刺五加的功效,将其应用于畜禽防治疾病和养殖具有重要意义。目前ASPS作为免疫增强剂对鸡免疫功能调节的研究,大多集中在ASPS对免疫器官指数、抗体效价、淋巴细胞转化率等方面[4],也有个别学者应用流式细胞术研究了ASPS对小鼠血液中淋巴细胞亚群数量变化的影响[5]。但是,目前关于ASPS对免疫器官中T、B淋巴细胞定位分布的影响还未见报道。脾脏是鸡体内最大的外周免疫器官,其内存在机体免疫系统中最主要的免疫活性细胞T、B淋巴细胞,除直接介导细胞免疫和体液免疫功能外,他们还能互相调节共同对机体起防御作用[6]。T、B淋巴细胞数量及其定位分布的变化将直接影响免疫功能的变化。
本研究拟通过观察ASPS对鸡脾脏中CD3+T淋巴细胞和Bu-1+B淋巴细胞定位分布的影响,从组织学和细胞学角度观察ASPS的免疫调节作用,为进一步探讨ASPS的免疫功能调节机制奠定基础。
1 材料和方法
1.1 主要试剂及仪器 原料刺五加叶购自长春市福百草大药房,由吉林农业大学中药材学院李伟副教授鉴定为刺五加叶。采用水提醇沉法提取ASPS,苯酚-硫酸法测得多糖纯度为81%。
冰冻切片用OCT组织包埋液,美国Sakura公司产品(批号:H90548328);小鼠抗鸡CD3、Bu-1单克隆抗体,美国Southern Biotechnology公司产品(批号:D989-3689B和D989-3273R);Ultra Sensitive SP超敏试剂盒kit 9901,福州迈新公司产品(批号:1505229701)。
Leica CM1850 冰冻切片机,德国Leica公司生产;Olympus CX41 显微镜,日本Olympus公司生产;Pixera pro150ES图像采集器,美国Pixera公司生产。
1.2 试验动物的分组及处理 60只1日龄海兰褐公雏,购自长春市农业科学研究院种鸡场。常规饲养管理。饲养至10 d时随机分成3组,对照组、低剂量试验组和高剂量试验组,每组20只。对照组鸡皮下注射生理盐水,0.2 mL/只,低剂量试验组和高剂量试验组分别皮下注射50 mg/mL和200 mg/mL的ASPS,0.2 mL/只,每日1次, 连注4 d,根据参考文献[7]确定了以上注射剂量。
每一组分别在最后一次注射ASPS后的第7天和第14天取材,每组分别随机选取10只雏鸡,快速取其脾脏。将脾脏制成冰冻切片,片厚5 μm,-80℃保存备用,以进行免疫组织化学染色,从而观察T、B淋巴细胞的定位分布情况。
1.3 免疫组织化学染色程序 每组每只鸡随机选取5张切片,每张切片滴加30 mL/L过氧化氢,室温下孵育10 min; PBS洗3次,每次3 min;除去PBS,每张切片分别滴加小鼠抗鸡CD3(1∶200)和Bu-1(1∶200)单克隆抗体工作液,37 ℃孵育1 h;PBS洗3次,每次3 min;每张切片滴加聚合物增强剂(试剂A),室温下孵育20 min;PBS洗3次,每次3 min;每张切片加酶标抗鼠/兔聚合物(试剂B),室温下孵育30 min;PBS洗3次,每次3 min;DAB显色;苏木精复染;自来水冲洗返蓝;梯度酒精脱水;二甲苯透明;中性树脂封片;照相。
1.4 图像分析及统计学处理 应用Image-pro plus6.0图像分析软件测定脾脏中单位视野内阳性细胞面积。每张切片测3个视野,取平均值。应用SPSSl8.0软件对各组阳性细胞进行单因素方差分析。
2 结果
2.1 CD3+T淋巴细胞定位分布的变化情况 ASPS给药后7 d时,与对照组比较,低剂量组CD3+细胞的数量显著增多(P﹤0.05),CD3+细胞聚集的个别单个动脉周围淋巴鞘面积明显增加,而且阳性细胞着色更深,白髓和红髓中散在的阳性细胞也明显增多(图1B)。而高剂量组CD3+细胞的数量增加更为显著(P﹤0.05)(图2A),动脉周围淋巴鞘的数目增多(图1C),与低剂量组只有个别动脉周围淋巴鞘面积增加不同(图1B),高剂量组大多数动脉周围淋巴鞘面积均明显增加,而且阳性细胞分布更加密集,另外在红髓大血管周围也出现较多CD3+细胞聚集(图1C)。
随着日龄增加,ASPS给药后14 d时,低剂量和高剂量组CD3+细胞的数量均显著增多(P﹤0.05),增加趋势明显高于给药后7 d(图2A)。与对照组比较,低剂量组除了动脉周围淋巴鞘面积增加外,变化最大的是红髓和白髓中的阳性细胞分布范围明显增加,而且这种增加趋势明显高于免疫后7日龄的低剂量组(图1E和图1B)。尤其是此时的高剂量组,单个周围淋巴鞘面积特别大,几乎占据了单个视野的1/4,而且除动脉周围淋巴鞘以外,白髓中其他部位也聚集大量CD3+细胞,这些阳性细胞形态较大,着色较深(图1F)。
2.2 Bu-1+B淋巴细胞定位分布的变化情况 ASPS给药后7 d时,与对照组比较,低剂量组脾脏中Bu-1+细胞的数量虽有所增加,但变化并不显著(P﹥0.05)(图2B),而且红髓中由Bu-1+B细胞构成的椭球周围淋巴鞘数目变化不大,但是单个椭球周围淋巴鞘内Bu-1+B淋巴细胞的分布更加集中,而且浓染,另外在除椭球外的红髓其它区域以及白髓中出现许多阳性细胞(图1H)。相比于低剂量组,高剂量组的这种变化趋势更加明显,脾脏中Bu-1+细胞的数量显著增加(P﹤0.05)(图2B),椭球动脉周围淋巴鞘的数目显著增多,而且许多椭球已经相互靠近,汇集成群。单个周围淋巴鞘的面积也明显增加,红髓和白髓中散在的阳性细胞明显增多,而且这些散在的阳性细胞形态较大、着色较深,即为浆细胞(图1I)。
随着日龄增加,ASPS给药后14 d时,低剂量和高剂量组Bu-1+B细胞的数量均显著增多(P﹤0.05)(图2B),与T淋巴细胞相似,增加趋势明显高于给药后7日龄。随着日龄增长,免疫后14日龄对照组与免疫后7日龄比较,无论是椭球周围淋巴鞘的数量还是单个面积都明显增加,可以看出,脾脏中B淋巴细胞的相关结构具有明显的增龄性变化(图1G和图1J)。与对照组比较,给药后14 d低剂量组,Bu-1+B细胞的数量显著增多(P﹤0.05)(图2B),区别于给药后7日龄低剂量组,给药后14日龄低剂量组的红髓和白髓中就出现许多阳性反应的浆细胞,尤其是较早地出现了生发中心(图1K)。与低剂量组相比较,此时的高剂量组,部分椭球已经汇集到一起,形成面积特别大的椭球周围淋巴鞘,占据了几乎所有的红髓部分,另外在大血管周围也聚集了大量的浆细胞(图1L)。
3 讨论与小结
T、B淋巴细胞是构成机体免疫系统的主要细胞群体,分别调节机体的细胞和体液免疫应答, 是适应性免疫系统的主要效应细胞。多糖能调节T、B细胞周期,刺激其分裂增殖,并促进相关细胞因子和抗体的分泌[8]。目前多糖对T、B淋巴细胞免疫功能的调节主要通过检测淋巴细胞增殖能力、抗体效价以及相关细胞因子等方法进行的,但是对T、B淋巴细胞在免疫器官及组织中的精确定位变化鲜有报道。由于结构是功能的基础,要深入揭示多糖对T、B淋巴细胞免疫功能的调节机制,研究淋巴细胞在组织中的定位、增殖和迁移等动态变化具有重要意义,因此本研究选择靶动物鸡和长白山的道地药材刺五加为研究对象,对注射ASPS后鸡脾脏中的T、B淋巴细胞定位分布的变化情况进行了研究。
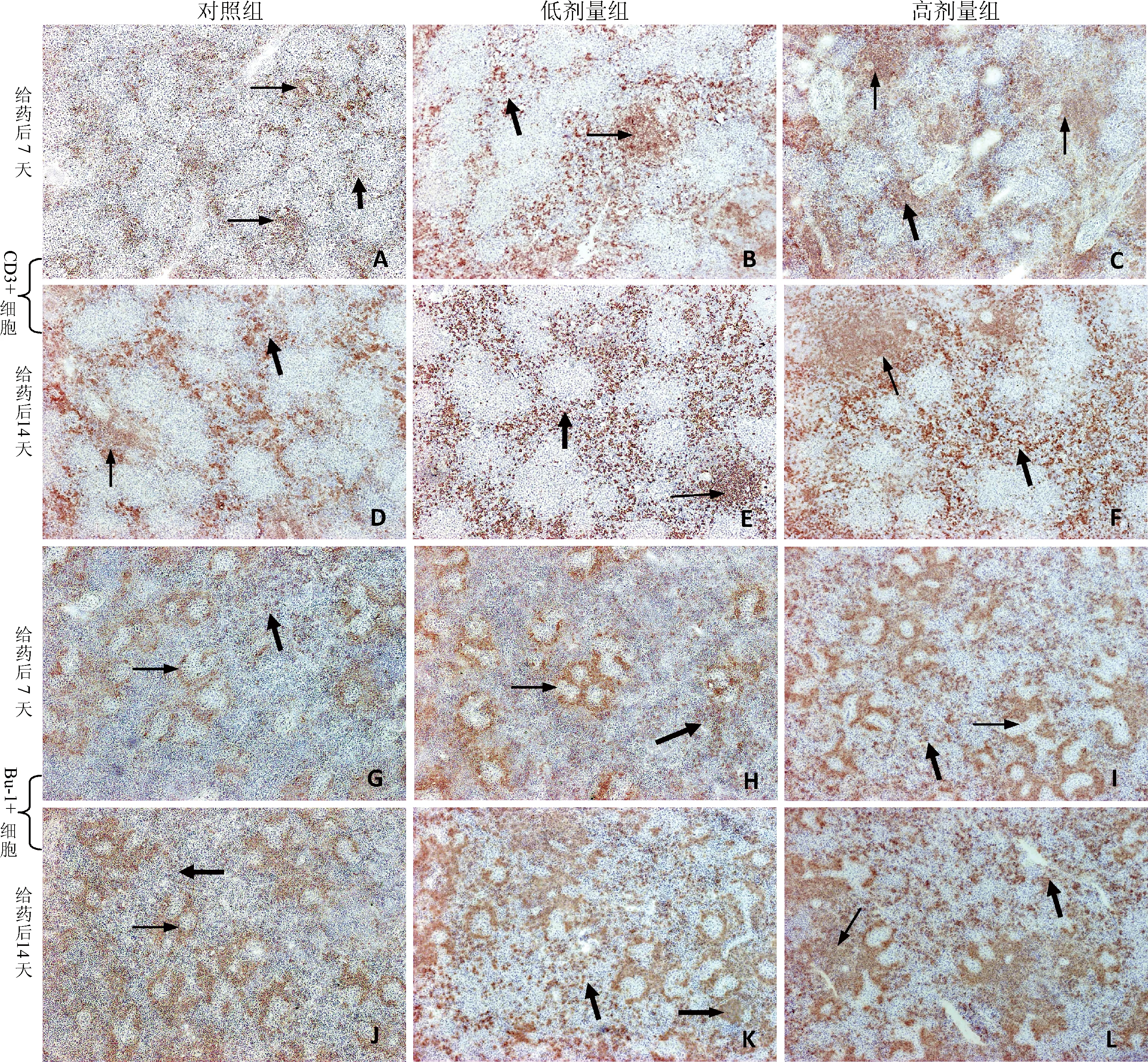
A、B和C分别为给药后7 d对照组、低剂量组和高剂量组CD3+细胞的分布情况;D、E和F分别为给药后14 d对照组、低剂量组和高剂量组CD3+细胞的分布情况;A-F图中细箭头所示为动脉周围淋巴鞘,粗箭头所示为红髓中阳性细胞,C图中的虚箭头所示为大血管周围的阳性细胞;G、H和I分别为给药后7 d对照组、低剂量组和高剂量组Bu-1+细胞的分布情况;J、K和L分别为给药后14 d对照组、低剂量组和高剂量组Bu-1+细胞的分布情况;G-L图中细箭头所示为椭球周围淋巴鞘;粗箭头所示为红髓和白髓中阳性细胞;K图中虚箭头所示为生发中心;L图中虚箭头所示为大血管中的阳性细胞图1 刺五加多糖对脾脏中T、B淋巴细胞定位分布的影响(250×)
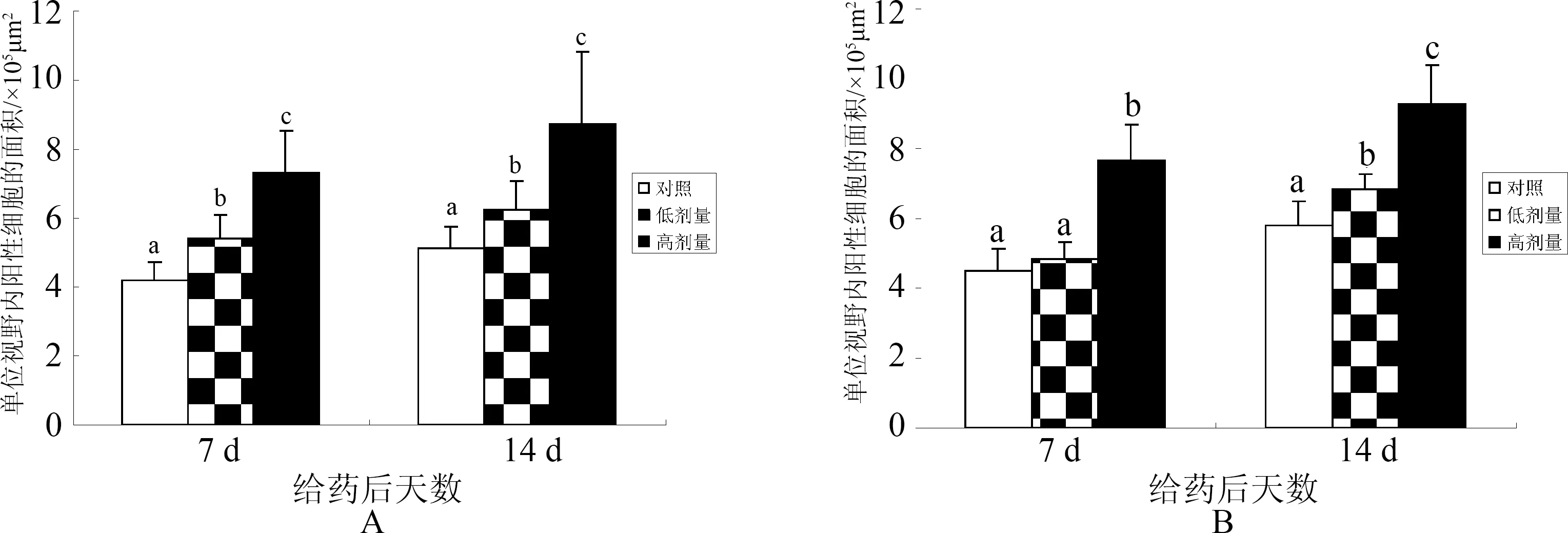
A:CD3+ T细胞的数量变化;B:Bu-1+ B细胞的数量变化不同字母表示差异显著(P﹤0.05)图2 刺五加多糖对脾脏中T、B淋巴细胞数量的影响
脾脏作为鸡体内的最大的外周免疫器官对T依赖性抗原产生体液免疫应答是通过动脉周围淋巴鞘和椭球周围淋巴鞘之间的相互作用诱导产生的[9]。本研究发现,ASPS能够明显促进由CD3+T淋巴细胞构成的动脉周围淋巴鞘和由Bu-1+B淋巴细胞过程的椭球周围淋巴鞘的发育,能够分别增加CD3+T淋巴细胞和Bu-1+B淋巴细胞的数量、分布密度和范围。这实际上是直观显示了ASPS对T、B淋巴细胞在实体组织中的增殖促进情况,这与ASPS能够体外促进淋巴细胞增殖的研究结果一致[10-12]。另外ASPS促进脾脏的这些特征性结构以及细胞的增殖,必然会导致脾脏指数的增加。
本研究发现T淋巴细胞和B淋巴细胞在ASPS影响下的分布趋势和变化强度有所不同,与对照组比较,低剂量的ASPS在给药后7 d T淋巴细胞的数量以及定位分布就呈现比较显著的变化,而B淋巴细胞在此时变化较小,但是高剂量的ASPS在给药后7 d以及低剂量的ASPS在到给药后14 d均能促进B淋巴细胞的数量增加和定位分布。本研究证明ASPS对T、B淋巴细胞的增殖和定位分布均有影响,而Han等[13]的研究结果发现,ASPS能直接刺激B细胞的增殖、分化及抗体生成,但对T细胞的增殖及IL-2、IL-4、IL-6和IFN-γ的表达无影响,但更多的研究结果还是证明ASPS能够促进T细胞的增殖以及细胞因子的分泌[7]。研究结果不同可能是与ASPS对T、B淋巴细胞刺激时,实时的信号的转导途径和通路受ASPS的剂量、给药时间点以及个体等因素不同有关,具体机制还有待于进一步研究。
本研究同时发现低剂量和高剂量ASPS均能诱导脾脏红髓和白髓中产生形态较大、浓染的浆细胞。中药多糖不仅可以增强淋巴细胞增殖能力,而且可增加细胞因子的分泌,有些细胞因子如IFN-γ可增强抗原提呈细胞与T细胞相互作用,增加了抗原的呈递,从而刺激B淋巴细胞增殖为浆细胞,进而促进抗体产生[14]。很多研究都证明,多糖能够促进鸡细胞因子的分泌以及新城疫等疫苗免疫后抗体的产生[15-17],因此研究通过免疫组化观察到ASPS促进脾脏中浆细胞的产生,是对ASPS促进抗体产生的进一步印证。
通过观察雏鸡注射不同浓度ASPS后脾脏中T、B淋巴细胞定位分布的变化情况,表明ASPS能够增加脾脏中T、B淋巴细胞的数量,并且能够影响其在PALS、EALS等脾脏特征性结构中的定位分布,从而从组织学角度进一步证明ASPS对鸡免疫功能具有显著的增强作用。
[1] 张英楠,刘洪章,刘树英,等. 中药多糖对鸡的免疫增强作用研究进展[J]. 中国家禽,2014,36(03):40-42.
[2] Ruizhan C, Zhiqiang L, Jimin Z,etal. Antioxidant and immunobiological activity of water-soluble polysaccharide fractions purified from Acanthopanax senticosu.[J]. Food Chemistry, 2011, 127(2):434-440.
[3] Lee J B, Tanikawa T, Hayashi K,etal. Characterization and biological effects of two polysaccharides isolated from Acanthopanax sciadophylloides[J]. Carbohydrate Polymers, 2015, 116:159-166.
[4] 段雪磊, 马奎红, 包永占,等. 刺五加免疫调节功能的研究进展[J]. 中兽医学杂志, 2015, 6:72-75.
[5] 罗强, 任鸿, 孙黎,等. 刺五加多糖对小鼠淋巴细胞转化率及外周血淋巴细胞亚群的影响[J]. 河南农业科学, 2013, 42(8):137-140.
[6] 杨树宝, 张英楠, 张延林,等. 鸡脾脏中B淋巴细胞的发育及其定位分布[J]. 中国兽医学报, 2010, 30(03):379-383.
[7] Yongbing Z, Shifa Y, Xue Z,etal. Immune enhancement of TaishanRobiniapseudoacaciapolysaccharide on recombinant Proteus mirabilis OmpA in chickens.[J]. International Immunopharmacology, 2014, 22(1):236-241.
[8] 易阳, 曹银, 张名位. 多糖调控T/B淋巴细胞免疫应答机制的研究进展[J]. 中国细胞生物学学报, 2012, 34(1):67-74.
[9] Jeurissen S H. The role of various compartments in the chicken spleen during an antigen-specific humoral response[J]. Immunology, 1993, 80(1): 29- 33.
[10]韩杰, 边连全, 刘显军,等. 刺五加多糖对断奶仔猪外周血淋巴细胞信号传导的影响[J]. 天然产物研究与开发, 2014, 26(10):1589-1592.
[11]Alina S, Nijole S, Virgilijus Z,etal. Effect of Acanthopanax senticosus on the accumulation of cadmium and on the immune response of spleen cells.[J]. Journal of Toxicology & Environmental Health Part A, 2014, 77(21):1311-1318.
[12]Han S B, Yoon Y D, Ahn H J,etal. Toll-like receptor-mediated activation of B cells and macrophages by polysaccharide isolated from cell culture of Acanthopanax senticosus.[J]. International Immunopharmacology, 2003, 3(9):1301-1312.
[13]Han S B, Park S K, Ahn H J,etal. Characterization of B cell membrane receptors of polysaccharide isolated from the root of Acanthopanax koreanum.[J]. International Immunopharmacology, 2003, 3(5):683-691.
[14]王勇, 李明春, 付青姐. 中药多糖对免疫细胞的作用及其机制研究进展[J]. 实用医药杂志, 2013, 30(4):363-365.
[15]Jing Z, Jin C, Wang D,etal. Immune-enhancing activity comparison of sulfated ophiopogonpolysaccharide and sulfated jujube polysaccharide[J]. International Journal of Biological Macromolecules, 2013, 52(1):212-217.
[16]Xie Y, Bo Z, Zhang Y. Protective effects of Acanthopanax polysaccharides on cerebral ischemia-reperfusion injury and its mechanisms[J]. International Journal of Biological Macromolecules, 2015, 72:946-950.
[17]Chen X, Chen X, Qiu S,etal. Effects of epimedium polysaccharide-propolis flavone oral liquid on mucosal immunity in chickens[J]. International Journal of Biological Macromolecules, 2014, 64(2):6-10.
(编辑:陈希)
Effects of Acanthopanax senticosus Polysaccharide on Distribution of T and B Lymphocytes in Chicken Spleen
ZHANG Ying-nan1,2, YANG Shu-bao3, SHAN Chun-lan3, HU Qing-hua3, SUN Bo-dong3, LIU Hong-zhang1*
(1.CollegeofLifeScience,JilinAgriculturalUniversity,Changchun,130118,China; 2.ChangchunUniversityofScienceandTechnology,Changchun, 130600,China;3.CollegeofAnimalScienceandtechnology,JilinAgriculturalUniversity,Changchun, 130118,China)
The aim of this study was to investigate the effect of different concentration ASPS on distribution of T and B lymphocytes in chicken spleen. The chicks were divided into control group, low-dose group and high-dose group. There were 20 chicks in each group. The chicks in low-dose group and high-dose group respectively subcutaneous injected 0.2 mL ASPS with the dose of 50 and 200 mg/mL, The control group were administered saline and treated as the same way as the fore groups. The same operation was repeated 4 d. Five chicken spleen were removed from each group on the day 4 and 14 after the last day of immunization. The localization of T and B lymphocytes in chicken spleen were detected by Immunohistochemistry staining. The result showed the number of CD3+T lymphocytes and Bu-1+B lymphocytes in the spleen were increased in both low dose group and high dose group compared with the control group after injection for 7 d and 14 d. The area of periarterial lymphatic sheath which was composed of CD3+T lymphocytes was also increased, meanwhile CD3+T lymphocytes in the red pulp also increased obviously, and the distribution range gradually increased. At the same time, the area of periellipsoid lymphatic sheath which is composed of Bu-1+B lymphocytes was also increased, and the number of plasma cells in red pulp and white pulp was significantly increased, and even the germinal center were appeared in 14 d after injection. Compared with the control group, the change tendency of high dose group and 14 d after injection were more obvious. In conclusion, ASPS can increase the number of T and B lymphocytes in spleen, and can affect their localization in the characteristic structures of spleen like periarterial lymphatic sheath and periellipsoid lymphatic sheath, and further prove that ASPS have significant enhancement effect on immune function of chicken from the histological angle.
Acanthopanaxsenticosuspolysaccharide; chick; T lymphocyte; B lymphocyte; distribution
国家自然科学基金项目(31372391);吉林省自然科学基金项目(20150101106JC);长春科技学院科研启动基金
张英楠,讲师,在读博士,从事植物资源开发与利用的研究。
刘洪章。 E-mail: lhz999@126.com
2016-03-06
A
1002-1280 (2016) 04-0035-06
S853.7
