克氏原鳌虾产ESBLs大肠杆菌的分离鉴定与耐药研究
2016-02-07贾敏周伟韩一啸梁冰梁津豪纪雪孙洋刘军祝令伟陈萍郭学军
贾敏,周伟,韩一啸,梁冰,梁津豪,纪雪,孙洋,刘军,祝令伟,陈萍,郭学军*
(1.吉林农业大学食品科学与工程学院,长春 130118; 2.军事医学科学院 军事兽医研究所,长春 130122)
克氏原鳌虾产ESBLs大肠杆菌的分离鉴定与耐药研究
贾敏1,周伟2,韩一啸2,梁冰2,梁津豪2,纪雪2,孙洋2,刘军2,祝令伟2,陈萍1,郭学军2*
(1.吉林农业大学食品科学与工程学院,长春 130118; 2.军事医学科学院 军事兽医研究所,长春 130122)
为了解克氏原螯虾产ESBLs大肠杆菌的耐药流行情况,采集来自山东、江苏、浙江、湖北和辽宁五省共计198份活体克氏原螯虾肠道样品,采用头孢噻肟抗性选择性培养基培养、PCR方法和BD PhoenixTM-100全自动微生物鉴定/药敏系统筛选、鉴定产ESBLs大肠杆菌并检测其药物敏感性。结果显示,从198份克氏原螯虾样品中共分离获得107株产ESBLs大肠杆菌,分离率为54.0%。所有分离菌株对青霉素类、一代头孢和部分三代头孢菌素均耐药;对四环素类、氟喹诺酮类、氯霉素类和磺胺类药物的耐药率均在60% 以上(>65株);对氨基糖苷类药物耐药率较低;多重耐药(R≥3类)菌株所占比例为86.7%(96/107),且以5类(30%,31/107)和6类耐药(28%,30/107)为主。通过试验初步获得了克氏原螯虾产ESBLs大肠杆菌耐药水平的基础数据,为克氏原螯虾细菌耐药性防控和水产品公共卫生监测奠定基础。
克氏原螯虾;产ESBLs大肠杆菌;多重耐药
克氏原螯虾(Procambarusclarkii),也称红沼泽蝲蛄(Red swamp crawfish),俗称小龙虾,属于淡水螯虾[1];它适应能力强,生长快,食杂性,肉质鲜嫩,营养丰富,是原鳌虾属中很有经济价值的品种[2]。近些年,伴随着抗生素的大量生产和使用,致使细菌耐药成为全球性的公共卫生问题。现已在多种环境介质如土壤、水体、水生生物和细菌体内检测到耐药基因的存在,且耐药基因能通过可移动的遗传元件在不同细菌及不同生物之间扩散、传播,进一步对环境造成污染,危及公共健康和食品安全[3]。在多种耐药细菌中,产β-内酰胺酶,尤其是产超广谱β-内酰胺酶(extended spectrum belta lactamase, ESBLs)肠杆菌科细菌的耐药情况最为严重,对人类健康危害也最大[4]。ESBLs能钝化所有青霉素类、头孢类药物包括第三代头孢菌素(如头孢噻肟、头孢曲松、头孢他啶)和单酰胺环类药物(氨曲南)的抗菌活性[5]。现阶段,我国对水产细菌耐药性研究及监测远没有对人和畜禽细菌耐药的研究深入和系统[6]。因此,本研究对小龙虾源产ESBLs大肠杆菌进行了分离和耐药性研究。
1 材料与方法
1.1 材料
1.1.1 小龙虾样品 2015年5-8月期间共采集来自山东(41份)、江苏(81份)、辽宁(36份)、浙江(20份)和湖北(20份)五省共计198份成年活体小龙虾样品。
1.1.2 主要试剂 麦康凯琼脂培养基(青岛海博);ECC显色培养基(法国科玛嘉);头孢噻肟200 mg标准品(139483-200204,中国药品生物制品检定所);胰蛋白胨、酵母提取物、牛肉浸粉、可溶性淀粉和酸性水解酪蛋白(英国Oxoid公司);Mueller Hinton培养基(法国梅里埃公司)。
1.1.3主要仪器 BD PhoenixTM-100全自动微生物鉴定仪、PhoenixSpecTM比浊仪,均购自美国BD公司;PCR扩增仪(EDC-810),购自北京东胜创新生物科技有限公司;生物安全柜(1300A2),购自美国Thermo公司。
1.2 方法
1.2.1 大肠杆菌的分离纯化 用75%酒精棉擦拭活体小龙虾体表,再用高压灭菌的剪刀剪掉尾部,慢慢拔下头部。无菌操作取出小龙虾肠道组织移至含有500 μL LB液体培养基的离心管中,使用无菌研磨棒室温研磨、振荡混匀;静置3 min后,吸取100 μL上清液涂布于头孢噻肟(8 μg/mL)抗性麦康凯显色培养平板上,37 ℃过夜培养14 h;每个平板上随机挑取一个紫红色、边缘光滑的菌落划线于头孢噻肟(8 μg/mL)抗性ECC显色培养平板上进行二次纯化,37 ℃过夜培养14 h;最后挑取一个绿色单菌落接种于1 mL头孢噻肟(8 μg/mL) LB液体培养基中,37 ℃恒温160 r/min震荡过夜培养14 h。
1.2.2 大肠杆菌PCR鉴定 根据文献[7],利用大肠杆菌16S rDNA特异性引物(Fd.5’-TGTGGGAACGGCGAGTCGGAATAC-3’和Rev.5’-GGGCGCAGGGGATGAAACTCAAC-3’,由吉林库美生物科技公司合成)对大肠杆菌分离株进行PCR鉴定。50 μL反应体系包含:1×PCR缓冲液(含1.5 mmol/L MgCl2),25 pmol上游、下游引物,250 μmol dNTPs,1U Taq DNA聚合酶和100 ng DNA模板。PCR扩增条件为95 ℃预变性10 min,94 ℃变性40 s,60 ℃退火40 s,72 ℃延伸1 min, 72 ℃总延伸7 min,30个循环,4 ℃保存。使用2%的琼脂糖凝胶进行电泳,缓冲液为1×TAE,110 V恒压电泳30 min,后,进行成像观察。目的产物为1467 bp大小。
1.2.3 产ESBLs大肠杆菌生化鉴定和药敏检测 使用BD PhoenixTM-100 system全自动微生物鉴定/药敏系统和双纸片协同实验[8]对大肠杆菌分离株进行生化鉴定、药敏检测和ESBLs表型确认。
1.2.4 大肠杆菌的系统进化分群 利用PCR方法对分离到的大肠杆菌进行分群鉴定,实验方法参考文献[9], PCR扩增条件:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s, 72 ℃总延伸7 min,30个循环,4 ℃保存,余下步骤同1.2.2。可将获得的产ESBLs大肠杆菌分为五群:A、B1、B2、D和未知群,大肠杆菌分群引物序列及产物大小详见表1。

表1 大肠杆菌分群鉴定引物
大肠杆菌分群鉴定引物由吉林库美生物科技公司合成
2 结果
2.1 大肠杆菌的分离鉴定 通过头孢噻肟抗性麦康凯显色培养基、抗性ECC显色培养基及大肠杆菌16S rDNA 特异性PCR方法进行分离鉴定,获得耐头孢噻肟(8 μg/mL)大肠杆菌分离株107株。
2.2 产ESBLs大肠杆菌的鉴定 使用BD PhoenixTM-100 全自动微生物鉴定仪对107株大肠杆菌分离株进行ESBLs表型筛选,然后进行双纸片协同实验[8]验证,结果107株大肠杆菌分离株均为产ESBLs大肠杆菌。
2.3 大肠杆菌分离株药敏鉴定 根据文献[8],参考CLSI2012耐药标准对107株小龙虾大肠杆菌分离株进行氨基糖苷类、β-内酰胺类(下分为碳青霉烯类、一、三、四代头孢菌素、青霉素类等类)、氯霉素类、四环素类、磺胺类和氟喹诺酮类6大类共计19种临床治疗常用抗菌药物进行药物敏感性检测,结果见表2。107株大肠杆菌分离株对青霉素类、一代头孢和部分三代头孢菌素100%耐药。对四环素类药物的耐药率为93.5%(100/107);对氟喹诺酮类(60.8%,65/107)、氯霉素类(78.5%,84/107)、磺胺类(80.4%,86/107)药物的耐药率均在60% 以上;所有检测菌株对碳青霉烯类药物敏感。另外,我们又对小龙虾源产ESBLs大肠杆菌进行了β-内酰胺类药物/酶抑制剂(阿莫西林-克拉维酸、哌拉西林-他唑巴坦、氨苄西林-舒巴坦)的药物敏感性进行了检测,结果107株样品分离菌株对阿莫西林-克拉维酸(8.4%,9/107)、哌拉西林-他唑巴坦(0.9%,1/107)仍保持较好的敏感性。
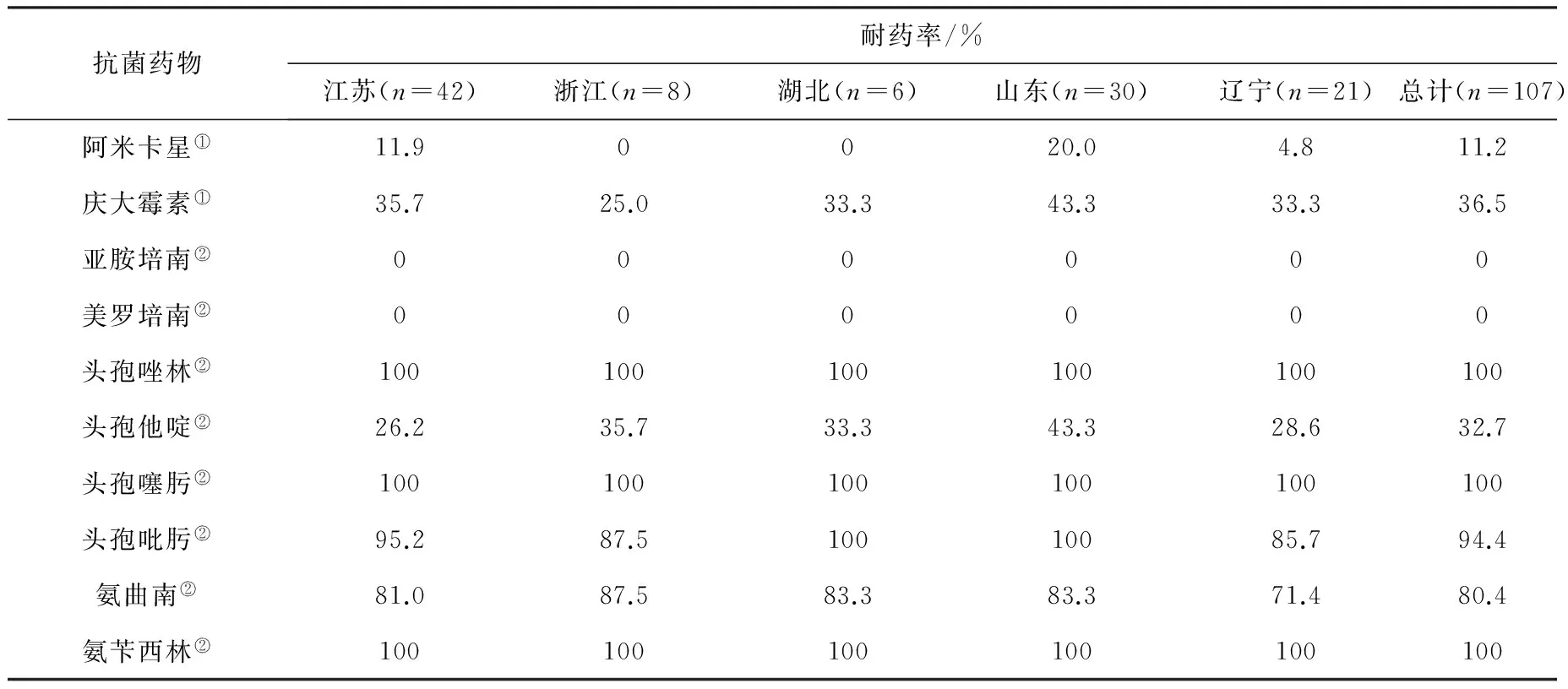
表2 小龙虾大肠杆菌对抗菌药物的耐药性结果
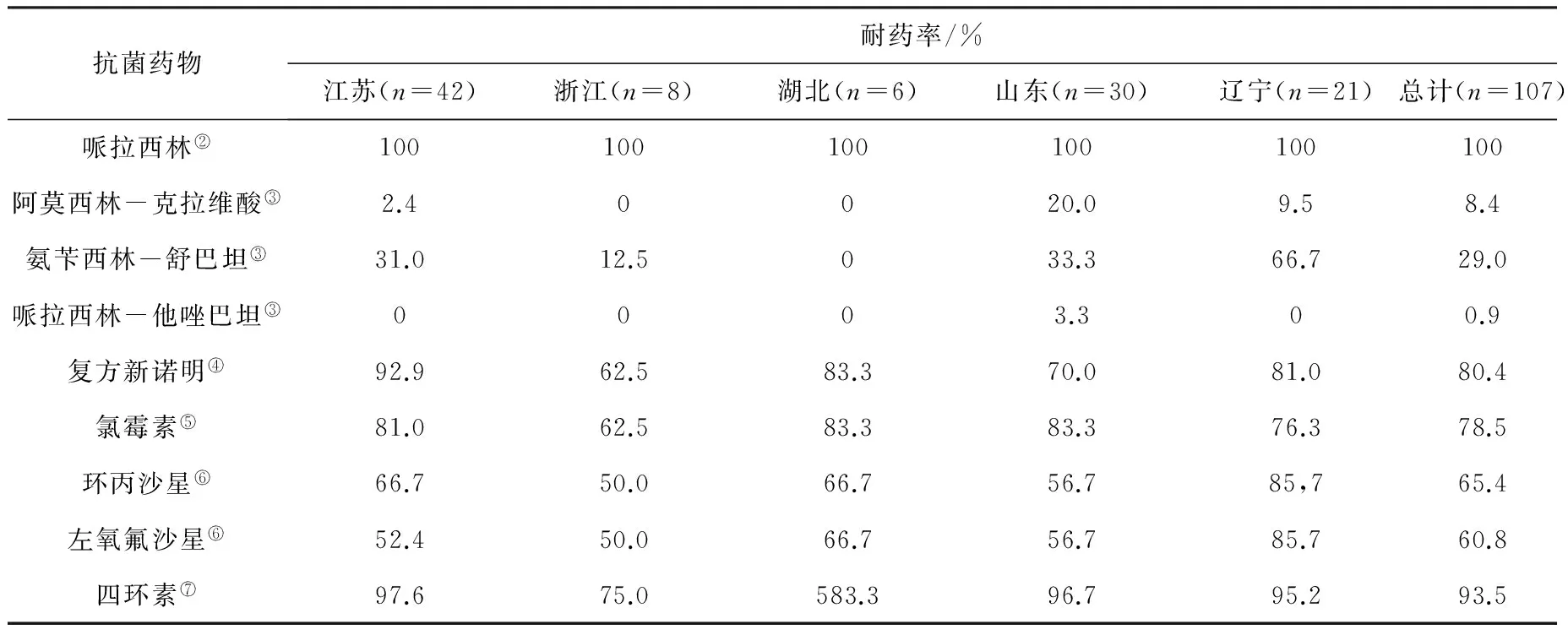
续表
①:氨基糖苷类药物;②:β-内酰胺类药物;③:抗生素/抑制剂;④:磺胺类药物;⑤:氯霉素类药物;⑥:喹诺酮类药物;⑦:四环素类药物
在107株大肠杆菌分离株中,多重耐药(同时对三类以上抗生素耐药)大肠杆菌菌株有96株,占总分离株的89.7%,其中耐5类抗生素(5R)的菌株最多,占总分离株的30%(31/107);其次是耐6类抗生素(6R)的菌株,占总分离株的28%(30/107)。多重耐药性统计结果见图1。
2.4 大肠杆菌系统进化分群结果 大肠杆菌经过长期进化演变成为致病群和非致病群,致病群一般为B2群和D群,非致病群一般为A群、B1群和未知群[9]。本研究中,107株产ESBLs大肠杆菌分群结果见表3:B1群为主要优势群(47.66%,51/107),A群次之(27.10%,29/107),未知群(14.95%,16/107)、 D群(9.35%,10/107)较少,B2群(0.93%,1/107)最少;除江苏地区以外,其他四个地区在系统进化分群结果上高度相似,均以B1群为主。
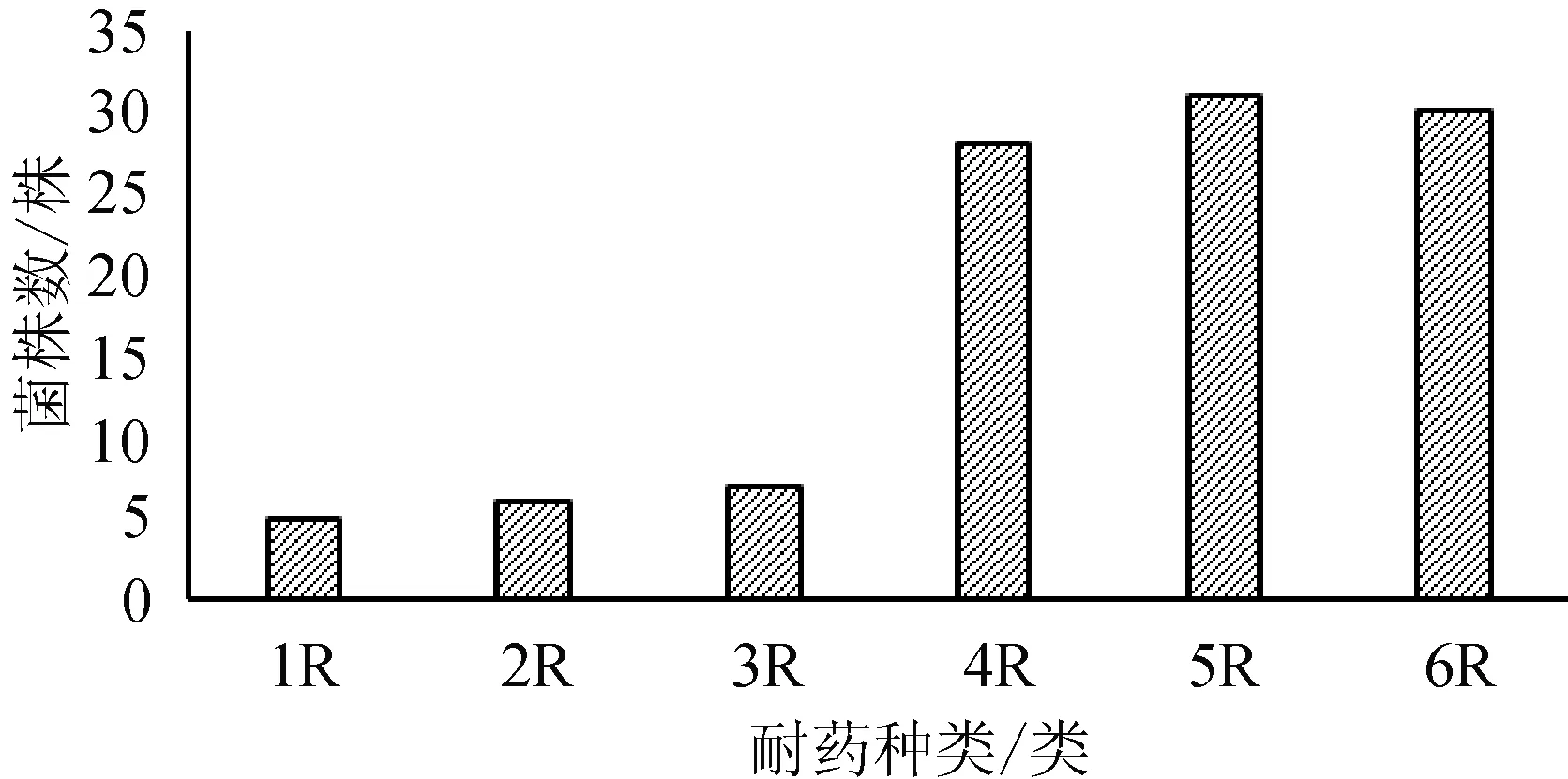
图1 小龙虾大肠杆菌不同耐药类型菌株数
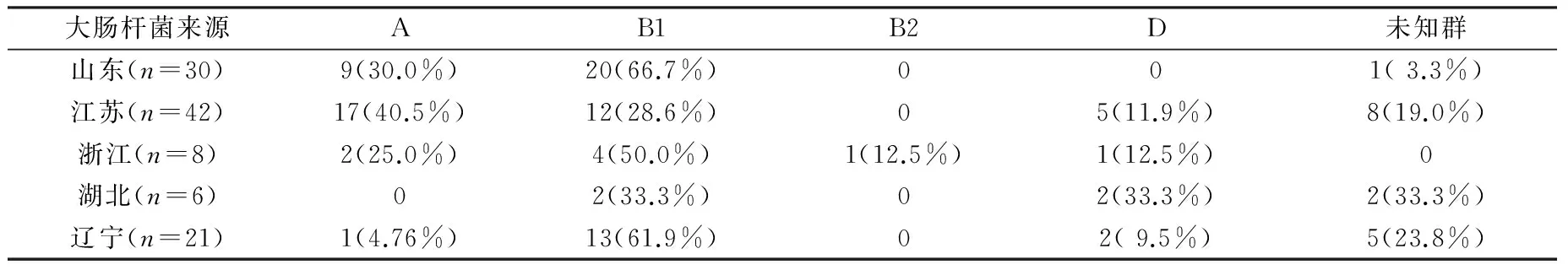
表3 大肠杆菌系统进化分群结果
3 讨论
近年来,产ESBLs肠杆菌科细菌在亚洲呈现蔓延和上升趋势。2011年报道显示,中国71%的大肠杆菌分离株和超过一半的肺炎克雷伯菌分离株均为ESBLs阳性株[10];2009-2010年,对从11个亚洲国家的尿路感染患者体内分离的肠杆菌科细菌分析发现,有28% 是ESBLs阳性,且对三代和四代头孢菌素耐药率介于26%至50%之间[11],足见其传播、蔓延的广泛性和严重性。
本研究对我国小龙虾产ESBLs大肠杆菌的耐药情况进行了初步调查,从198份小龙虾样品中获得107株产ESBLs大肠杆菌分离株,对β-内酰胺类抗生素如头孢唑林,氨苄西林,头孢吡肟等具有较高的耐药性,对头孢唑林、头孢噻肟则是完全耐药(100%);多重耐药率也高达89.7%(96/107),且以5类和6类耐药最为普遍,这与之前报道过的鸡源[12]、犬源[13]大肠杆菌多重耐药状况基本相似,由此可见小龙虾体内大肠杆菌耐药水平高,耐药丰度大,应当加强对水产细菌耐药性的流行本底统计,重视水体环境内细菌耐药性扩散、传播的危害性,同时也不能忽视水体环境的抗生素污染问题。
从地域来看,五个省份小龙虾源大肠杆菌耐药水平与趋势基本一致,但也有一些不同之处,如山东省小龙虾肠道产ESBLs大肠杆菌对阿米卡星和阿莫西林-克拉维酸的耐药性高于其他省份,辽宁省小龙虾样品中分离出的产ESBLs大肠杆菌对氨苄西林-舒巴坦的耐药性也远高于其他省份,这可能与不同省份该类药物对水体污染程度有一定关系。由于本研究中部分地区的样品数量较小,所以还需扩大样品基数,以便提高其科学性。
本研究还对分离的大肠杆菌进行了遗传进化分群并结合多重耐药进行了分析。基于大肠杆菌的致病性可将大肠杆菌分为非致病群(A+B1+未知群)和致病群(B2+D)两组,本研究结果发现,多重耐药的致病性大肠杆菌所占比例较小(9.4%,9/96),耐药性远低于非致病性大肠杆菌(90.6%,87/96),可见非致病菌的多重耐药程度十分严重。有研究表明,携带耐药基因的细菌死亡后,其耐药基因会释放到环境中并持久存在[14-16]。由此推断,小龙虾源非致病性大肠杆菌携带较大丰度的耐药基因,在死亡后这些耐药基因仍会游离在复杂的水体环境中,并随时可能转入其他微生物细胞内;更为重要的是,这些细菌虽然不能致病,但是可以通过接合、转化等方式扩大传播范围,造成耐药基因的传播、扩散,甚至可以将这些耐药基因传递给致病菌[17],这些获得多种耐药基因的致病性细菌一旦感染人、动物后,就会给临床治疗带来巨大的困难,最终导致无药可治。
本研究通过对克氏原鳌虾源产ESBLs大肠杆菌进行分离和耐药性研究,发现克氏原鳌虾体内携带的产ESBLs大肠杆菌具有多样性,并初步获得了克氏原鳌虾肠道产ESBLs大肠杆菌耐药性的基础数据。通过数据分析发现,耐药,尤其是多重耐药情况严重,因此需要加强对抗生素的监管力度,同时对水产品公共卫生实施监测并建立有效的耐药性监控体系。
[1] 周冬仁.克氏原螯虾细菌性病原的分离与鉴定[J]. 中国农学通, 2011, 27(26):102-105.[2] 夏晓飞, 郑小婧, 王玉凤. 不同开口饵料对克氏原螯虾幼虾发育及消化酶活性的影响[J].水产养殖, 2011 (7): 16-21.
[3] 高盼盼, 罗义, 周启星, 等. 水产养殖环境中抗生素抗性基因 (ARGs) 的研究及进展[J]. 生态毒理学报, 2009, 4(6): 770-779.
[4] Partridge S R. Analysis of antibiotic resistance regions in gram-negative bacteria[J]. Fems Microbiology Reviews, 2011, 35(5): 820-855.
[5] Gelband H, Miller P M, Pant S,etal. The state of the world′s antibiotics 2015[J]. Wound Healing Southern Africa, 2015, 8(2): 30-34.
[6] 王瑞旋, 冯 娟, 耿玉静, 等. 水产细菌耐药性的最新研究概况[J]. 海洋环境科学, 2010, 29(5): 770-776.
[7] Shahi S K, Singh V K, Kumar A. Detection ofEscherichiacoliand associated β-lactamases genes from diabetic foot ulcers by multiplex PCR and molecular modeling and docking of SHV-1,TEM-1, and OXA-1 β-lactamases with clindamycin and piperacillin-tazobactam[J]. Plos One, 2013, 8(7): e68234.
[8] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; twenty-second informational supplement[S]. Wayne:Clinical and Laboratory Standards Institute, 2012.
[9] Clermont O, Bonacorsi S, Bingen E. Rapid and simple determination of theEscherichiacoliphylogenetic group[J]. Applied and Environmental Microbiology, 2000, 66(10): 4555-4558.
[10]Xiao Y, Shen P, Wei Z,etal. Mohnarin report of 2011: monitoring of bacterial resistance in China [J]. Chinese Journal of Chinese Journal of Nosocomiology, 2012, 22: 4946-4952.
[11]Lu P L, Liu Y C, Toh H S,etal. Epidemiology and antimicrobial susceptibility profiles of gram-negative bacteria causing urinary tract infections in the Asia-Pacific region: 2009-2010 results from the study for monitoring antimicrobial resistance trends (SMART)[J]. International Journal of Antimicrobial Agents, 2012, 40: S37-S43.
[12]佟盼盼. 鸡粪便菌耐药基因及其产 ESBLs 大肠杆菌耐药性的研究[D]. 吉林大学, 2015.
[13]赵相胜, 孙洋, 纪雪, 等. 犬源大肠杆菌分离鉴定及耐药性分析[J]. 中国人兽共患病学报, 2014, 30(3): 268-272.
[14]Blum S A E, Lorenz M G,etal. Mechanism of retarded DNA degradation and prokaryotic origin of DNases in nonsterile soils[J]. Systematic and Applied Microbiology, 1997, 20(4): 513-521.
[15]Hill K E, Top E M. Gene transfer in soil systems using microcosms[J]. FEMS Microbiology Ecology, 1998, 25(4):319-329.
[16]Crecchio C, Ruggiero P,etal. Binding of DNA fromBacillussubtilison montmorillonite-humic acids-aluminum or iron hydroxypolymers: Effects on transformation and protection against DNase[J]. Soil Science Society of America, 2005, 69(3): 834-841.
[17]Smet A, Martel A, Persoons D,etal. Diversity of extended-spectrum β-lactamases and class C β-lactamases among cloacalEscherichiacoliisolates in Belgian broiler farms [J]. Antimicrobial Agents and Chemotherapy, 2008, 52(4): 1238-1243.
(编辑:李文平)
Study on Antibiotic Resistance of Extended-Spectrum β-lactamases in Escherichiacoli Isolated from Procambarus clarkii
JIA Min1, ZHOU Wei2, HAN Yi-xiao2, LIANG Bing2, LIANG Jin-hao2, JI Xue2,SUN Yang2, LIU Jun2, ZHU Ling-wei2, CHEN Ping1, GUO Xue-jun2*
(1.FoodScienceandEngineering,JilinAgriculturalUniversity,Changchun130118,China; 2.InstituteofMilitaryVeterinaryScience,theAcademyofMilitaryMedicalScienceofPLA,Changchun130122,China)
In order to explore the prevalence of ESBLs-producingE.coliand the status of antibiotic resistance inProcambarusclarkii, 107 ESBLs-producingE.colifrom 198Procambarusclarkiiswere collected from five provinces in China (Shandong, Jiangsu, Zhejiang, Hubei, Liaoning). The antimicrobial susceptibility and ESBLs phenotype of these stains were determined by cefotaxime-containing medium, PCR and BD PhoenixTM-100 system. The results showed that ESBLs-producingE.coliratio was 54%. All ESBLs-producingE.colistains were resistant to penicillins, the first generation cephalosporins and part of the second generation cephalosporins. The average drug-resistance rate to tetracyclines, fluoroquinolones, chloramphenicols and sulfonamides was all above 60% (>65/107). The resistance rate to aminoglycosides was lower. All strains were sensitive to the carbapenems. Among these ESBLs-producingE.colistrains, the percentage of multi-drug resistant (R≥3classes) isolates was 86.7%(96/107), isolates with resistance to five (30%, 31/107) or six (28%, 30/107) classes of drugs were predominated. This study obtained basic data about drug-resistance in ESBLs-producingE.coli. All the results were beneficial for monitoring public hygiene of aquatic product.
Procambarusclarkii;ESBLs-producingE.coli;multi-drug resistance
国家"863"项目(2012AA022006);军队医药卫生课题(13CXZ024)
贾敏,硕士研究生,从事细菌耐药性研究。
郭学军。E-mail:xuejung@yahoo.com
2016-01-10
A
1002-1280 (2016) 04-0006-05
S852.61
