牛病毒性腹泻病毒E2蛋白的亚细胞定位研究
2016-02-07刁乃超时坤李健明李仲乐姜园园刘东旭王春凤杜锐
刁乃超,时坤,李健明,李仲乐,姜园园,刘东旭,王春凤,杜锐,3*
(1.吉林农业大学动物科技学院,长春 130118;2.吉林农业大学中药材学院,长春 130118;3. 教育部动物生产及产品质量安全重点实验室,吉林省梅花鹿生产与产品应用研究室,长春 130118)
牛病毒性腹泻病毒E2蛋白的亚细胞定位研究
刁乃超1,时坤2,李健明2,李仲乐1,姜园园1,刘东旭1,王春凤1,杜锐2,3*
(1.吉林农业大学动物科技学院,长春 130118;2.吉林农业大学中药材学院,长春 130118;3. 教育部动物生产及产品质量安全重点实验室,吉林省梅花鹿生产与产品应用研究室,长春 130118)
为深入研究牛病毒性腹泻病毒E2蛋白的生物学功能,了解其在哺乳动物细胞中的亚细胞定位情况,采用RT-PCR扩增牛病毒性腹泻病毒Changchun184株E2基因,将其克隆至真核表达载体pcDNA3.1/V5HisA中,并进行酶切鉴定和测序分析,将构建的重组质粒pcDNA3.1/V5HisA-E2经脂质体介导转染至MDBK细胞。继续培养48 h后,在激光共聚焦显微镜下观察E2蛋白在细胞中的亚细胞定位情况。结果表明,E2蛋白在细胞核与细胞质中均有表达,且绿色荧光呈点状均匀分布。该研究为进一步研究牛病毒性腹泻病毒E2蛋白的相关功能奠定了基础。
牛病毒性腹泻病毒;E2蛋白;亚细胞定位
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)为牛病毒性腹泻-黏膜病的病原,会引起牛发热、腹泻、急性慢性肠炎、怀孕母畜流产或产畸形胎、持续感染等临床症状。该病传染性强、感染率高,虽有疫苗应用但仍时常爆发。目前还没有治疗该病的特效药物[1-3],因此应对其致病的分子作用机制进行深入研究,以期寻求预防和治疗该病的新途径。
蛋白质的代谢以及信号转导等生物过程都与其亚细胞定位密切相关。病毒蛋白与宿主细胞蛋白之间的相互作用是病毒致病的基础,成熟蛋白质必须在特定的细胞部位才能发挥其生物学功能[4-5]。BVDV E2蛋白是一种囊膜蛋白,为BVDV的主要保护性抗原,在参与BVDV与宿主细胞的识别、吸附和介导免疫中和反应等过程中起重要作用[6-8]。但目前对E2基因及E2蛋白的研究主要集中在E2基因的表达和E2蛋白抗体的制备以及新型疫苗的研制方面[9-11],在E2蛋白与宿主细胞的确切分子致病作用机制方面鲜有相关报道。因此,本试验对BVDV E2蛋白在哺乳动物细胞中的亚细胞定位进行了研究,旨在为进一步研究其生物学功能奠定基础。
1 材料与方法
1.1 材料1.1.1 病毒、载体和细胞 牛病毒性腹泻病毒Changchun 184株为本实验室保存;pcDNA3.1/V5HisA真核表达载体购于Invitrogen公司;E.coliDH5α菌株由本实验室保存;MDBK细胞购自中国科学院上海细胞库。1.1.2 主要试剂 DNA Marker DL 15000、 DNA Marker DL 2000、DNA Polymerase、限制性内切酶EcoR I和XhoI、T4DNA连接酶,均购自TaKaRa生物工程有限公司;凝胶回收试剂盒、质粒抽提试剂盒,购自杭州维特洁生化技术有限公司;脂质体转染试剂盒购自Promega公司,鼠源V5-tag Monoclonal Antibody和FITC标记的羊抗鼠单抗购自Proteintech公司,HRP标记的羊抗鼠IgG购自博士德生物公司。
1.2 方法
1.2.1 E2基因的扩增与克隆 根据GenBank收录E2(登录号:AF526380.1)基因序列设计一对引物,上游引物P1:5′- GGAATTCATGCTCCCAGCCTGTAAACCTGAC-3′,引入EcoR I酶切位点;下游引物P2:5′-CCGCTCGAGTTAACCTAAGGTCGTTTGTTCTG-3′,引入XhoI酶切位点,扩增目的片段大小为1122 bp,引物由库美生物技术有限公司合成。采用Trizol方法,提取BVDV基因组,进行RT-PCR扩增, 反转录体系10 μL:MgCl22 μL,10×RT Buffer 1 μL,RNase Free dH2O 3.25 μL,dNTP Mixture 1 μL,RNsae Inhibitor 0.25 μL,AMV 0.5 μL,下游引物P2 0.5 μL,模板1.5 μL;反转录条件:30 ℃ 10 min,42 ℃ 30 min,95 ℃ 5 min,5 ℃ 5 min,1个循环。PCR反应体系40 μL:5×PCR Buffer10 μL,DEPC水28.5 μL,TaKaRa Ex Taq HS 1 μL,上游引物P1 0.5 μL。将PCR反应液加入到反转录产物中,混匀,按如下条件进行PCR反应。94 ℃ 30 s,60.1 ℃ 30 s,72 ℃ 1 min,30个循环。PCR产物经1%琼脂糖凝胶电泳鉴定,回收纯化后与pGEM-T载体连接,转化到E.coliDH5α感受态细胞,经蓝白斑筛选后,小量提取质粒,进行酶切鉴定,并送库美生物公司测序。
1.2.2 真核表达载体pcDNA3.1/V5HisA-E2的构建及鉴定EcoR I和XhoI分别对pGEM-T-E2和真核表达载体pcDNA3.1/V5HisA双酶切,回收目的片段后,用T4DNA连接酶16 ℃连接过夜,转化到E.coliDH5α感受态细胞中,37 ℃培养12~16 h,挑取重组质粒,进行双酶切鉴定,并将阳性重组质粒送库美生物技术有限公司测序。测序正确的质粒命名为pcDNA3.1/V5HisA-E2。
1.2.3 真核表达载体pcDNA3.1/V5HisA-E2的转染 将MDBK细胞接种到铺有盖玻片的6孔板中,2.5×105~3×105/mL,待融合度达到70%~80%时,用FuGENE HD将重组质粒pcDNA3.1/V5HisA-E2和pcDNA3.1/V5HisA转染到MDBK细胞中,同时设空白对照,具体操作参照说明书。
1.2.4 间接免疫荧光检测 取转染48 h后MDBK细胞,用PBS洗3遍,每次10 min,4%多聚甲醛室温固定12 min,PBS洗3遍,5%胎牛血清37 ℃封闭1 h,PBS洗3遍,加入鼠抗V5标签抗体(1∶200)4 ℃过夜,用4 ℃预冷的PBS洗3遍,加入FITC标记的羊抗鼠IgG 37 ℃孵育1 h,用4 ℃预冷的PBS洗3遍,DAPI室温染核3 min,甲醇漂洗后加入封片剂封片。用倒置荧光显微镜进行观察。
1.2.5 E2蛋白的亚细胞定位 将制备好的细胞爬片置于激光共聚焦显微镜下,观察E2蛋白亚细胞定位情况。1.2.6 pcDNA3.1/V5HisA-E2表达产物的Western blot 分析 取转染48 h后MDBK细胞,弃去培养液,PBS漂洗3次后加入裂解液,冰上裂解30 min,将裂解液及细胞碎片收集于1.5 mL EP管中,12000 g离心10 min,取上清20 μL进行SDS-PAGE电泳,湿转至PVDF膜后用脱脂奶粉封闭。抗体孵育:一抗为鼠抗V5标签抗体(1∶20000)4 ℃过夜,二抗为HRP标记羊抗鼠IgG(1∶3000)37 ℃孵育1 h,加入ECL显色液,用化学发光成像系统记录结果。
2 结果
2.1 E2基因的扩增和克隆 以提取BVDV Changchun184株总RNA为模板,进行RT-PCR扩增,获得PCR产物大小约为1000 bp(图1),与预期结果一致。EcoR I和XhoI对 pGEM-T- E2双酶切,获得大小约为1122 bp的目的片段(图2)。
2.2 真核表达载体pcDNA3.1/V5-HisA-E2的构建 真核表达载体pcDNA3.1/V5HisA-E2经EcoR I和XhoI双酶切后,获得片段大小正确的目的片段和载体片段(图3)。DNA测序结果表明,E2基因已经插入到pcDNA3.1/V5HisA载体中且方向正确,将其命名为pcDNA3.1/V5HisA-E2。
2.3 E2蛋白间接免疫荧光检测 将制备好的细胞爬片置于倒置荧光显微镜下进行观察,可以观察到DAPI将细胞核染成蓝色(图4A),表达E2蛋白的MDBK细胞呈现绿色荧光(图4B)。表明pcDNA3.1/V5HisA-E2在MDBK细胞中成功表达。
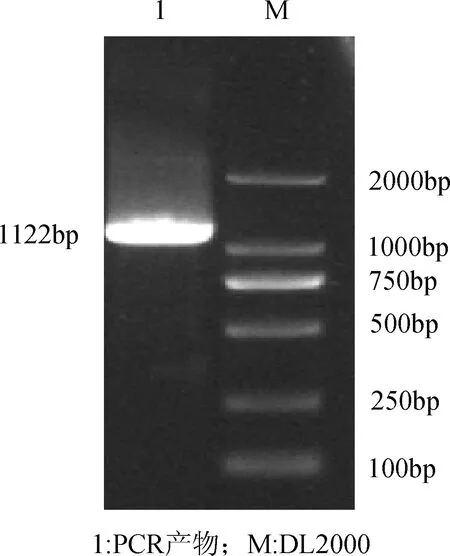
图1 E2基因PCR扩增结果

图2 重组克隆载体的酶切验证
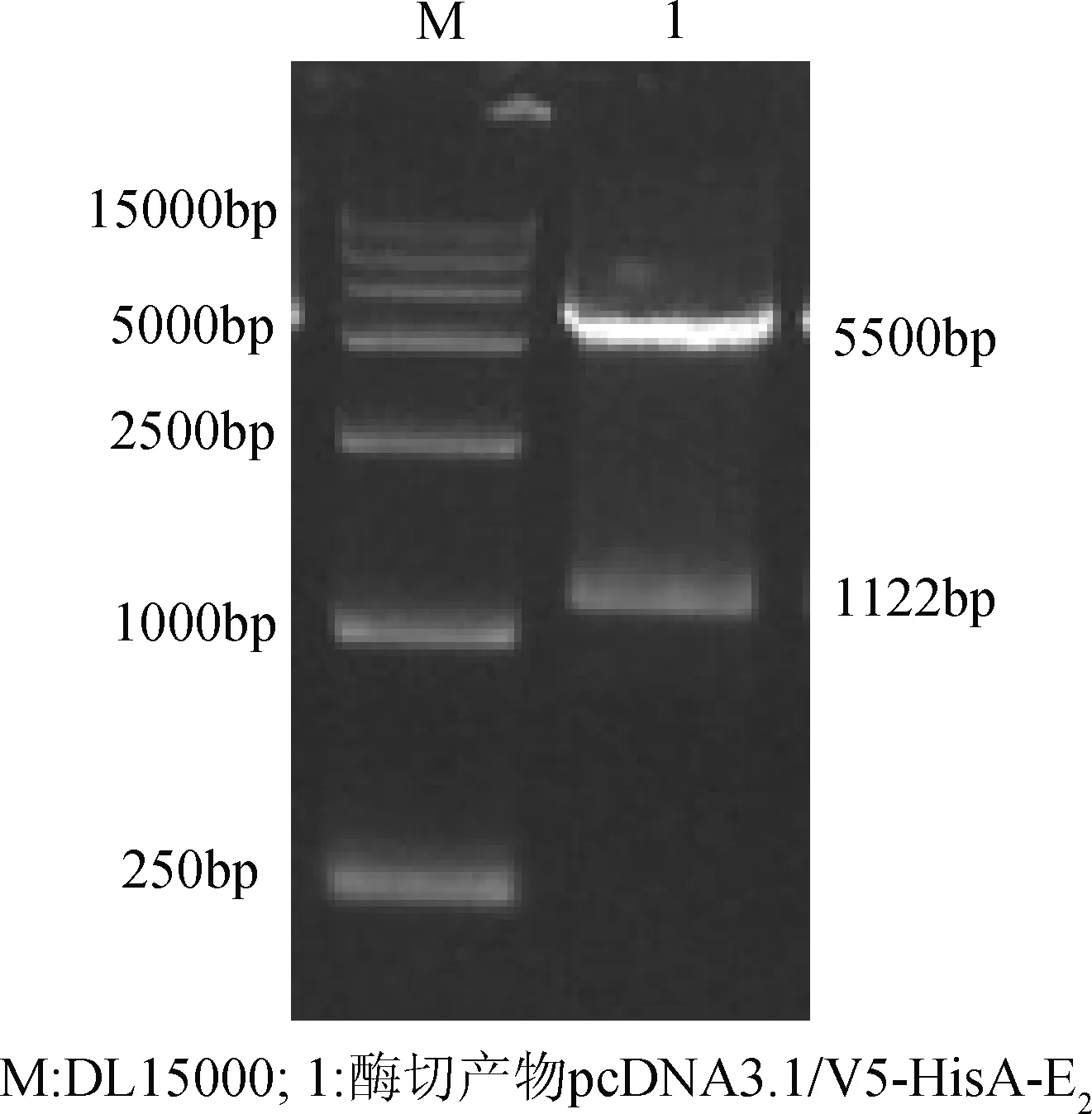
图3 pcDNA3.1/V5HisA-E2重组质粒的酶切鉴定结果
2.4 E2蛋白的亚细胞定位分析 在激光共聚焦显微镜下进行观察(图5A、B、C)未转染的MDBK细胞细胞核和细胞质中均未出现绿色荧光;转染pcDNA3.1/V5HisA-E2的MDBK细胞(图5D、E、F)细胞核上和细胞质中均呈现点状均匀分布的绿色荧光。
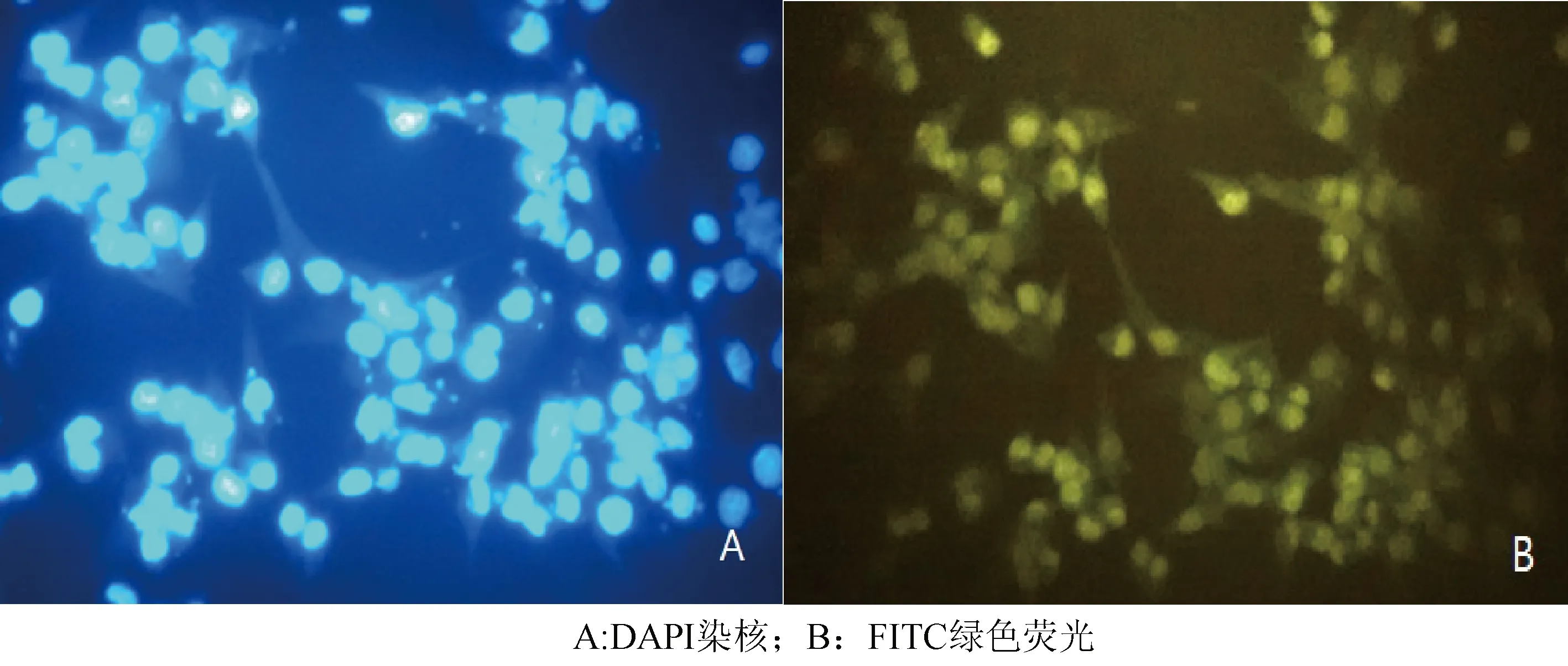
图4 pcDNA3.1/V5HisA-E2蛋白间接免疫荧光结果
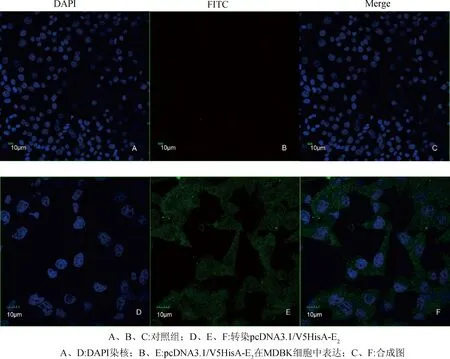
图5 pcDNA3.1/V5HisA-E2蛋白的亚细胞定位情况
2.5 E2蛋白Western blot检测 对转染细胞裂解后进行Western blot分析(图6),转染pcDNA3.1/V5HisA-E2的MDBK细胞样品呈现单一的目的条带(泳道3、4),大小与预期结果相符, pcDNA3.1/V5HisA空载体(泳道2)和空白对照(泳道1)均无条带,表明E2蛋白在MDBK细胞中正确表达。
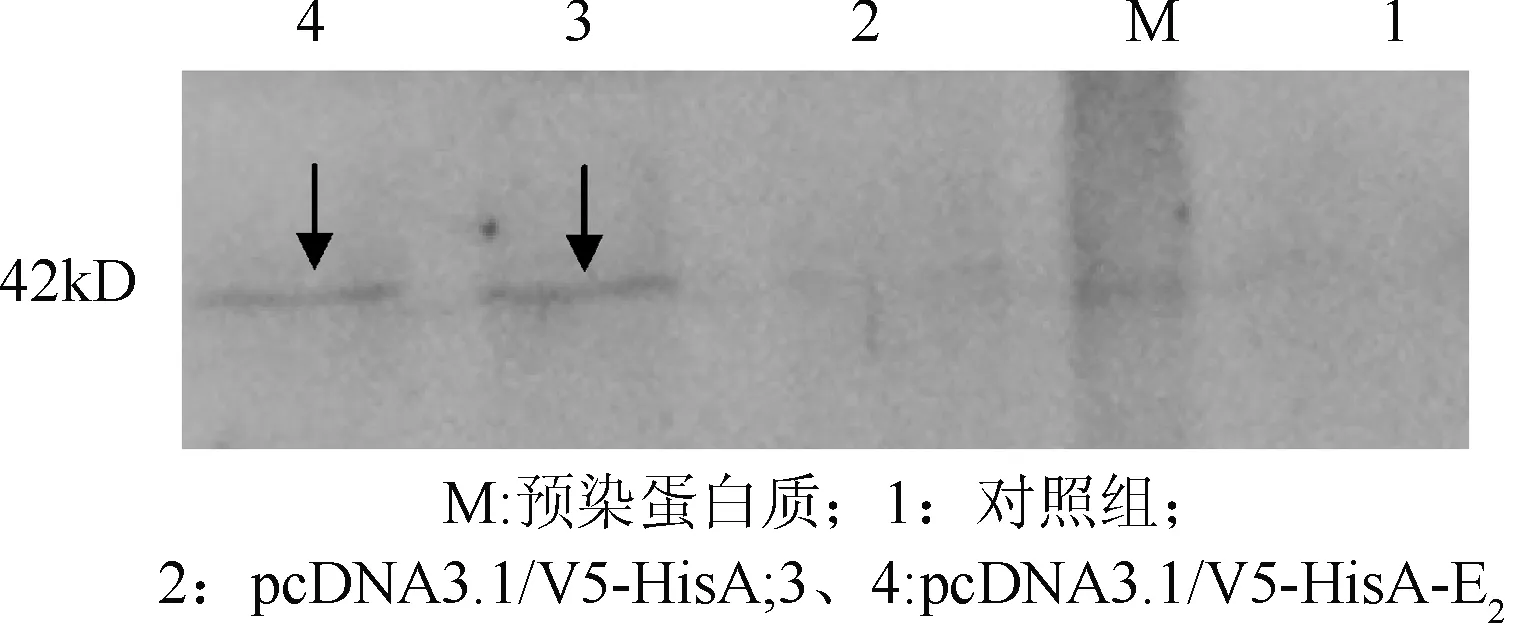
图6 pcDNA3.1/V5-HisA-E2和pcDNA3.1/V5-HisA的Western blot分析
3 讨论
本研究选择含有V5和HisA双标签的真核表达载体pcDNA3.1/V5-HisA来研究目的蛋白的亚细胞定位情况,这与常用的含有绿色荧光蛋白(GFP)标签的真核表达载体相比,能够更准确的显示出目的蛋白在细胞中的分布情况,因为V5-HisA双标签分子量(约2 kD)远小于GFP标签的分子量(约25 kD)[12],能够克服因大的标签分子量对蛋白亚细胞定位产生的影响。
本试验选择MDBK细胞作为E2蛋白表达和定位的对象,这更接近E2蛋白所在的天然宿主细胞模式,更有利于后期E2蛋白与宿主蛋白互作机制的研究。E2蛋白在MDBK细胞中的表达时限由转染预试验确定,经脂质体介导转染的MDBK细胞,分别于转染后12、24、36、48、72 h用倒置荧光显微镜观察,结果显示在转染24 h后E2蛋白开始表达,在转染48 h时达到峰值并趋于稳定,因此选择转染48 h的MDBK细胞做进一步分析。
激光共聚焦显微镜观察转染48 h的MDBK细胞,结果显示E2蛋白在细胞核上和细胞质中均有表达,且绿色荧光大多呈点状均匀分布。此外,在细胞转染48 h后,转染有pcDNA3.1/V5HisA-E2的MDBK细胞有少部分出现变圆、皱缩的形态变化,这在转染pcDNA3.1/V5-HisA空载体和正常MDBK细胞对照组中并没有出现,这很可能与E2蛋白表达诱导MDBK细胞凋亡或自噬有关[13]。本试验将pcDNA3.1/V5HisA-E2转入MDBK细胞,通过激光共聚焦显微镜确定E2蛋白定位于细胞质和细胞核中,为进一步筛选与E2蛋白互作的宿主蛋白,研究二者在牛病毒性腹泻分子致病机制中的作用奠定了基础。
[1] 殷震, 刘景华. 动物病毒学[M]. 2版. 北京 : 科学出版社, 1997.
[2] 张丽颖, 涂长春. 牛病毒性腹泻病诊断方法的研究进展[J]. 畜牧兽医科技信息, 2004 (5) : 17 - 19.
[3] 宫晓炜, 曹小安, 郑福英, 等. 牛病毒性腹泻病毒感染的免疫应答研究进展[J]. 中国兽医科学, 2012, 42 (11) : 1200-1205.
[4] 张松, 黄波, 夏学峰, 等. 蛋白质亚细胞定位的生物信息学研究[J]. 生物化学与生物物理进展, 2007, 34 (6) : 573 - 579.
[5] 刘宁. 猪瘟病毒核衣壳蛋白C亚细胞定位信号的鉴定[D]. 长春: 吉林农业大学, 2014.[6] 范进江, 薄新文, 钟发刚. 牛病毒性腹泻病毒基因组结构与蛋白功能研究进展[J]. 动物医学进展, 2008, 29 (5) : 68-72.
[7] 李佑民, 刘振润, 武银莲, 等. 牛病毒性腹泻-黏膜病病毒株(长春184)的分离和鉴定[J]. 中国人民解放军兽医大学学学报, 1983, 3 (2) : 113-121.
[8] 李庆超,苗利光. 牛病毒性腹泻病毒研究进展[J]. 动物医学进展, 2009, 30 (5) : 68 - 72.
[9] 王伟利, 钱爱东, 胡桂学, 等. 地高辛标记核酸探针检测牛粘膜病病毒[J]. 中国兽药杂志, 2000, 34 (5):1-4.
[10]陈其兵, 薛霜, 漆世华, 等. 牛病毒性腹泻-粘膜病病毒TaqMan荧光定量RT-PCR检测方法的建立及初步应用[J]. 中国兽药杂志, 2012, 46 (4) : 4 - 6, 47.
[11]张云, 郝俊伟, 刘红娜, 等. 牛病毒性腹泻—黏膜病病毒C24V株E0 截短基因密码子优化及其在卡介苗中的表达[J]. 中国畜牧兽医, 2014, 41 (3) : 71 - 76.
[12]龚燕华. 蛋白质相互作用及亚细胞定位原理与技术[M]. 中国协和医科大学出版社, 2010.
[13]Singh M, Fraefel C, Bello L J,etal. Identification and characterization of BICP27, an early protein of bovine herpesvirus 1 which may stimulate mRNA 3′ processing[J]. Journal of General Virology, 1996, 77 (4): 615 - 625.
(编辑:李文平)
Subcellular Localization Analysis of Bovine Viral Diarrhea Virus E2Protein
DIAO Nai-chao1, SHI Kun2, LI Jian-ming2, LI Zhong-le1, JIANG Yuan-yuan1,LIU Dong-xu1, WANG Chun-feng1, DU Rui2,3*
(1.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118 ,China; 2.CollegeofChineseMedicineMaterial,JilinAgriculturalUniversity,Changchun130118,China; 3.KeyLaboratoryofAnimalProduction,ProductQualityandSecurity,MinistryofEducationofthePeople'sRepublicofChina,LaboratoryofProductionandProductApplicationofSikaDeerofJinlinProvince,Changchun130118,China)
This experiment was designed to make a thorough study on the biological function of bovine viral diarrhea virus E2protein by investigating its subcellular localization in mammalian cells. The E2gene fragments of Changchun184 were amplified by RT-PCR, cloned into eukaryotic expression vector pcDNA3.1/V5HisA, and then identified by restriction enzymes digestion and sequencing analysis. The subcellular location of E2protein in MDBK cells was observed by confocal laser scanning microscope after that the recombinant plasmid pcDNA3.1/V5HisA-E2was transfected into MDBK cells by lipofectin for 48 h. The results showed that the E2protein was expressed in both the nucleus and cytoplasm, and most of the green fluorescence was distributed in a speckled pattern. All of these results will be as a basis for the further research on E2protein’s functions.
bovine viral diarrhea virus; E2protein; subcelluar localization
国家自然基金(31372436);科技部星火计划(2014GA660004)
刁乃超,硕士,从事经济动物疫病的研究。
杜锐。E-mail: durui71@126.com
2016-01-19
A
1002-1280 (2016) 04-0001-05
S852.65+3
