肥猪散发酵制剂的制备方法及质量评价
2016-02-07郭芳茹张遂平杨慧敏苑青艳
郭芳茹,张遂平,杨慧敏,苑青艳
(河南亚卫动物药业有限公司,郑州 450008)
肥猪散发酵制剂的制备方法及质量评价
郭芳茹,张遂平,杨慧敏,苑青艳
(河南亚卫动物药业有限公司,郑州 450008)
为了对肥猪散进行发酵和质量评价,采用固态发酵法,以各活性成分的含量为指标对其进行处方筛选及优化工艺,从性状、粒度、活菌数、游离大豆异黄酮的含量及稳定性等方面评价其质量。结果表明:最适宜的发酵菌株为纳豆芽孢杆菌,发酵温度为38 ℃,发酵时间为4 d,接菌量为12%,含水量为140%,干燥温度为47 ℃。肥猪散发酵制剂性质稳定,游离大豆异黄酮的含量为99.36 μg/g。采用固态发酵法制备的发酵肥猪散活性物质含量高,稳定性好。
肥猪散;固态发酵;工艺优化;质量评价;活菌数
肥猪散由绵马贯众、制何首乌、麦芽和炒黄豆组成,具有开胃、驱虫、补养和催肥的作用,能够提高畜禽的消化吸收机能和饲料利用率[2]。肥猪散传统使用方法是将中药粉碎后直接拌料饲喂,操作简单,但由于药物粒度较大,其中又存在很多难以溶出的活性成分,造成药物的利用率低,药效不能得到充分发挥。
中药发酵技术是在一定的温度和湿度条件下,利用酶和微生物的分解催化作用,将药物发泡、生衣的方法。该方法结合了传统发酵炮制工艺和现代生物技术、微生态学的优势,可以提高中药有效成分的提取率、增强药效、产生新的活性物质、减轻药物的毒副作用,为中药的应用开辟新的途径。文献报道[1],黄芪发酵后所含的黄芪多糖是普通煎、煮、熬水提方法的0.365~5.040倍,我国卫生部药品检验所动物试验结果显示,发酵中草药只需1/28的量,即可与一般煎、煮、熬水提物一份的量发挥同等的药效。
试验将中药发酵技术应用到肥猪散中,利用现代生物技术和传统中药炮制方法结合,采用微生物发酵的方式对中药散剂进行科学处理,降低药物的毒副作用,以期弥补中药散剂起效慢和生物利用度低的缺陷。
1 材料
1.1 仪器 依利特P230高效液相色谱仪,HS3120型超声波清洗机,YXQL31400型立式电热压力蒸汽消毒器,HHB11420型电热恒温培养箱,SWCJ1F型净化工作台,XS-18型显微镜,南京胜光医疗器械厂产品。
1.2 试剂与药品 黄豆(市售),麦芽(郑州龙海啤酒物资有限公司),绵马贯众(湖南省龙山县春燕中药材种植专业合作社),何首乌(安徽曙光药业销售有限公司),大豆苷元对照品(中国药品生物制品检定所,批号111602-200901),染料木素对照品(中国药品生物制品检定所,批号111802-201001),MRS培养基(上海源叶生物科技有限公司)、麦芽汁培养基(自制)、牛肉膏蛋白胨培养基(北京双旋微生物培养基制品厂)、PDA培养基(自制),琼脂粉(北京索莱宝科技有限公司),乙腈为色谱纯,其余试剂均为分析纯。
1.3 菌株 保加利亚乳杆菌(Lactobacillusbulgaricus,广东省微生物研究所,编号:GIM1.204)、啤酒酵母菌(Saccharomycescerevisiae,中科院微生物菌种保藏中心,编号:ATCC9763)、纳豆芽孢杆菌(Bacillusnatto,河南农大微生物实验室提供,编号:ATCC6633)、米曲霉(Aspergillusoryzae,上海通派生物科技有限公司,编号:CGMCC3.336)。
2 方法与结果
2.1 单因素试验 设计单因素试验,考察发酵菌种类、发酵时间、发酵温度、接菌量和干燥温度对游离大豆异黄酮含量的影响,试验内容及结果见表10所示。

表1 单因素试验结果
游离大豆异黄酮的测定采用高效液相色谱法[3],色谱柱Diamonsil-C18(250 mm×4.6 mm,5 μm),流动相为乙腈-0.2%磷酸(36∶64),流速为1.0 mL/min,柱温30℃,检测波长260 nm,进样量为20 μL。
对照品溶液的制备:精密称取染料木素和大豆苷元对照品各25 mg,分别用无水乙醇定容至25 mL作为储备液,精密吸取两种储备液各1 mL置于同一100 mL容量瓶中,无水乙醇定容至刻度作为对照品溶液,其中含两种对照品的浓度均为10 μg/mL。
供试品溶液的制备:取肥猪散发酵制剂1 g,精密称定,置锥形瓶中,加入70%乙醇25 mL,超声处理30 min,用70%乙醇补足减失的重量,摇匀过滤,取续滤液经0.45 μm微孔滤膜过滤即得供试品溶液。
2.2 多因素试验优化处方和工艺 采用三因素三水平正交试验的方法对发酵时间、接种量、发酵温度进行优化,按照正交试验表制备出发酵肥猪散样品。
肥猪散发酵制剂的制备工艺为:取绵马贯众30 g,何首乌30 g,麦芽500 g,炒黄豆500 g,混合后粉碎过5号筛,得到浅黄色粉末。称取10 g平铺于90 mm平皿中,厚度约为3 mm,盖好后正置,121℃高压灭菌30 min,即得发酵培养基;配制牛肉膏蛋白胨培养基,分装灭菌后,挑取斜面菌种接种于液体培养基,于120 r/min,37℃条件下振荡培养18 h[4],加入适量的无菌水稀释得到发酵用菌悬液,将菌悬液与发酵培养基均匀混合,置于适宜的温度下发酵一定时间后取出,烘干,粉碎过筛得到颜色较深、气味浓郁的肥猪散发酵制剂成品。
利用样品中活菌数、游离大豆异黄酮、结合蒽醌[5]、麦芽碱[6]以及绵马素[7]的含量5个综合指标筛选出最佳的处方和工艺,设置分值分别为30、30、15、15、10。正交试验及各指标的测定结果和结果分析见表2所示。
由正交试验分析结果得出,接种量对工艺的影响较大,其次是培养时间,温度的影响较小,通过综合评分和直观分析,得出A3B3C2为最佳制备工艺。即:发酵菌种为纳豆芽孢杆菌,加水量为140%,接菌量12%,发酵温度38℃,发酵时间为4 d,干燥温度为47℃。制备出的肥猪散发酵制剂性状为深棕褐色粉末,有浓郁的酱香味。

表2 正交试验结果
2.3 基本性质及含量测定 按照最佳制备工艺制备出三批样品,参照参考文献[2],测定以下检测指标。结果见表3所示。
2.3.1 性状 取适量肥猪散发酵制剂,置光滑纸上,平铺约5 cm2,将其表面压平,在明亮处观察,为色泽均匀的深棕褐色粉末。
2.3.2 粒度 采用筛分法,测定方法为:称取100 g样品,置5号药典筛内,通过5号筛的样品平均为96.3%。
2.3.3 水分 水分平均含量为3.8%。
2.3.4 游离大豆异黄酮的含量 采用高效液相色谱法,三批发酵肥猪散中游离大豆异黄酮的平均含量为99.36 μg/g,RSD为2.1。2.3.5 活菌数 按平板菌落计数法对制剂中活菌数进行检测,以每个平板上生长30~300个菌落为宜,试验重复三次,取平均值,计算肥猪散发酵制剂中含有的活菌数为3.34×1010CFU/g。

表3 肥猪散发酵制剂质量评价结果
2.4 加速试验
将三批肥猪散发酵制剂粉末置于培养皿中,摊成厚度小于5 mm的薄层,置于药物稳定性试验箱中,在温度为40 ℃±2 ℃,RH为75%±5%的条件下放置6个月,试验期间第1个月、2个月、3个月、6个月末分别取样一次,对肥猪散发酵制剂的外观、游离大豆异黄酮的含量和活菌数进行考察,与0天结果比较。三批肥猪散发酵制剂的外观性状均为棕褐色粉末,其它数据见表4。
采用单因素试验和正交试验确定的处方和工艺条件制备出3批肥猪散发酵制剂样品,并对游离大豆异黄酮的含量、活菌数及制剂稳定性进行了考察,含量结果分别为97.15%、101.25%、99.67%,在加速条件下放置6个月,含量无明显变化,说明该工艺稳定可靠,适用于制备肥猪散发酵制剂。
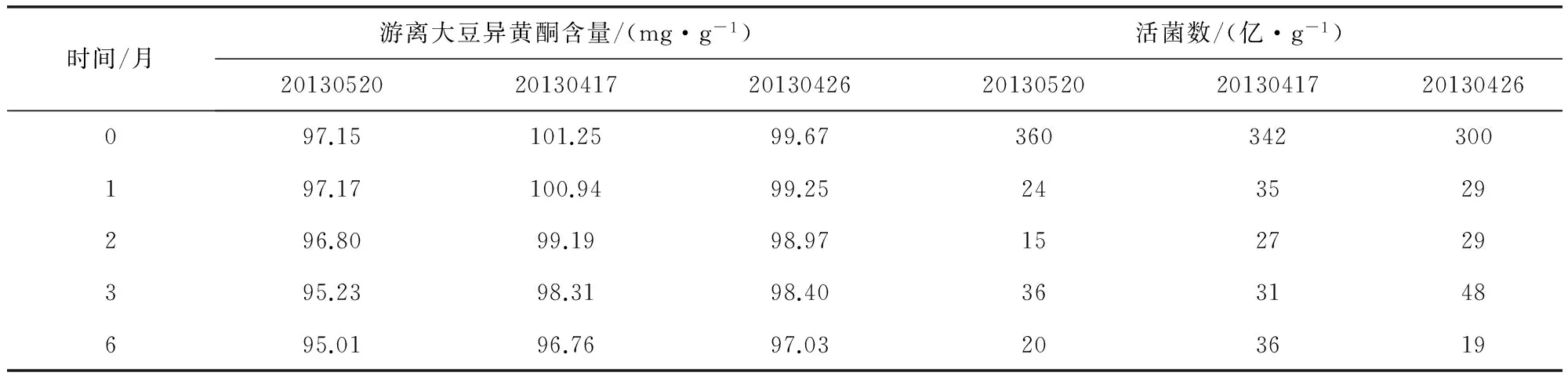
表4 肥猪散发酵制剂加速试验稳定性
3 讨论与小结
影响散剂发酵结果的因素很多,本试验先采用单因素试验的方法对制备发酵菌种、发酵时间、发酵温度、接种量等因素进行了考察,再采用正交试验的方法对处方和工艺进行优化,得出制备肥猪散发酵制剂理想的工艺条件。
肥猪散中含有4种中药,每种中药的活性成分在发酵时都会发生变化,因此,本试验先以含量最高的游离大豆异黄酮为指标进行单因素试验,确定发酵工艺的主要影响因素及其大致范围,再综合考虑各活性成分的含量变化,确定制备的最佳处方和工艺。陈富文等[8]采用响应面法优化复方中药的发酵工艺,以高效液相色谱图中总峰面积的提高率为指标确定最佳发酵工艺,为复方中药发酵工艺开发提供了基础和参考,但本试验中的结合蒽醌类物质是以其含量的下降为判断指标,因此不适合采用总峰面积法。
本试验制备的肥猪散发酵制剂活菌数含量高,游离大豆异黄酮的含量比发酵前提高1倍,何首乌中致下泄作用的蒽醌类物质的含量显著降低,说明微生物发酵过程能够提高药物活性物质的含量,降低毒性[9],这与张炳文[10]和杜晨晖等[11]研究的结果是一致的。 有关资料显示麦芽经发酵炮制后,可产生新的活性物质,能够抑制动物的支原体感染[12],这种新活性物质的成分和结构有待于进一步研究。
肥猪散发酵制剂的质量评价结果符合药典对中药散剂的要求,在加速条件下放置6个月,外观无明显变化,含量无明显下降现象,活菌数先下降后保持稳定,说明该发酵制品稳定性较好,可以在室温下存放。
发酵中药中还含有大量的活性益生菌,其本身就具有调节胃肠道菌群平衡,助消化和促生长的作用,因此发酵中药在我国畜牧生产上发挥“量少、高效、安全”的优势,对我国发展无公害畜牧业,生产绿色畜产品,增强我国畜产品在国际上的竞争力具有重要作用[13]。最近几年,发酵技术在饲料上应用很多,但在兽用中药散剂中应用并不常见[14]。随着现代制药技术的发展,发酵技术将会成为中药现代化的重要手段。
[1] 张高娜,张建梅,谷巍. 微生物发酵中草药在动物生产中的应用[J]. 广东饲料,2012,21(10):28-31.
[2] 中国兽药典委员会. 中华人民共和国兽药典(2010)[S].
[3] 张敏,王鹏娇,舒阳,等. 贵州豆豉发酵前后大豆异黄酮含量测定. 贵阳医学院学报[J],2011,36(4):359-361.
[4] 帅明,黄占旺,牛丽亚. 纳豆芽孢杆菌的固态发酵条件[J]. 食品与生物技术学报,2009,28(1):122-126.
[5] 施群,施淑琴. 炮制对何首乌总蒽醌含量的变化研究[J]. 中华中医药学刊,2012,30(12):2770-2772.
[6] 王晓荣,李菊平,孙绪丁. HPLC法测定唐古特乌头中大麦芽碱的含量[J]. 实用医药杂志,2013,30(7):624-625.
[7] 司云珊,徐暾海,韩冬,等. RP-HPLC法测定绵马贯众药材中绵马贯众素[J]. 中草药,2008,39(12):1894-1895.
[8] 陈富文,史高峰,王国英,等. 响应面法优化复方中药发酵工艺[J],中国中医药信息杂志,2014,21(4):73-77.
[9] 高慧娟,郑林用,余梦瑶,等. 微生物技术在中药开发中的应用[J],时珍国医国药,2011,22(3):728-730.
[10]张炳文,宋永生,郝征红,等. 发酵处理对大豆制品中异黄酮含量与组分的影响[J] .食品与发酵工业. 2002(7):6-9.
[11]杜晨晖,王兴红,赵荣华,等. 发酵法炮制何首乌的初步研究[J]. 天然产物研究与开发,2008(3):540-544.
[12]梅特·希德弗吉. 发酵的麦芽在饲养和兽医实践中的用途. 匈牙利,02829451.3[P]. 2005-08-03.
[13]张高娜,张建梅,谷巍. 微生物发酵中草药在动物生产中的应用[J].广东饲料,2012,21(10):28-31.
[14]张秀云. 微生物发酵在中药研究中的应用[J]. 北方药学,2012,9(4):110.
(编辑:陈希)
Preparation and Quality Evaluation of Fermented Feizhusan
GUO Fang-ru,ZHANG Sui-ping,YANG Hui-min,YUAN Qing-yan
(HenanYaweiVeterinaryPharmaceutcalCo.,LTD,Zhengzhou450008;China)
To prepare fermented Feizhusan and to evaluate the quality of the product. Fermented Feizhusan was prepared by solid fermentation, suitable prescription was screened out by single factor tests and orthogonal test was performed to optimize the technological conditions. The quality of fermented Feizhusan was evaluated in properties, granularity, viable count, content of active ingredients and stability. Results revealed that the optimal fermentation strain wasbacillusnattoand temperature was 38 ℃, time was 4 d, quantity of bacteria was 12%, water content was 140% and drying temperature was 47 ℃. The basic properties was stability, the content of soybean isoflavones aglycon was 99.36 μg/g. Solid fermentation can be used to prepare fermented Feizhusan which contains high quantities of active ingredients and stable character.
Feizhusan;solid fermentation;technology optimization;quality evaluation;viable count
郭芳茹,硕士。从事兽药新产品和新剂型研发。E-mail : 460294979@qq.com
2015-09-08
A
1002-1280 (2016) 01-0066-04
S852.65
