哺乳期磺胺间甲氧嘧啶暴露对仔鼠骨骼肌蛋白质代谢及mTOR信号通路的影响
2016-02-07张强姚慧媛来汉麟汪海晴阮亮胡纯秋刘开永
张强,姚慧媛,来汉麟,汪海晴, 阮亮,胡纯秋,刘开永
(安徽医科大学公共卫生学院,合肥 230601)
哺乳期磺胺间甲氧嘧啶暴露对仔鼠骨骼肌蛋白质代谢及mTOR信号通路的影响
张强,姚慧媛,来汉麟,汪海晴, 阮亮,胡纯秋,刘开永*
(安徽医科大学公共卫生学院,合肥 230601)
为了研究哺乳期磺胺间甲氧嘧啶(SMM)暴露对仔鼠骨骼肌蛋白质代谢及mTOR信号通路的影响,以0、10、50、200 mg/(kg·d)剂量对哺乳期ICR小鼠灌胃给药直至出生后21 d;第22天断乳时剖杀部分仔鼠,采集腓肠肌,BCA法测定其腓肠肌总蛋白含量,氨基酸分析仪测定其游离氨基酸水平,RT-PCR法检测其mTOR信号通路关键基因表达水平;另一部分仔鼠以性别分笼喂养至出生后63 d,并每周称重1次。与对照组比较,结果表明仔鼠体重无统计学差异(P>0.05);中剂量组仔鼠腓肠肌谷氨酸(Glu), 甘氨酸(Gly), 丙氨酸(Ala),瓜氨酸(Cit),蛋氨酸(Met),组氨酸(His)和鹅肌肽(Ans)含量显著升高(P< 0.05);高剂量组的Cit和Ans含量也显著升高(P< 0.05),而低剂量组的Cit含量显著降低(P< 0.01);仔鼠腓肠肌Mtor,Pi3k3ca,Pi3k3cb,Akt1,Eif4ebp1和Rps6kb1等基因表达无统计学差异(P> 0.05);腓肠肌总蛋白含量无统计学差异(P > 0.05)。哺乳期SMM暴露对仔鼠骨骼肌氨基酸代谢有一定的改变作用;对mTOR信号通路并未产生显著影响,为临床上探讨生命早期SMM暴露是否引起代谢性疾病问题提供了毒理学风险评估依据。
哺乳期;磺胺间甲氧嘧啶;骨骼肌;mTOR
磺胺间甲氧嘧啶(Sulfamonomethoxine, SMM)是长效磺胺类药物(SAs)中的一员,是我国生产量和使用量最大的兽药之一[1]。SAs(包含SMM)在城市污水、蔬菜、牛奶、动物性食品等中都有检出,甚至部分食品中超标[2-4]。长期低剂量摄入SAs会导致机体造血系统、免疫系统、甲状腺组织等功能异常[5]。
有文献报导表明哺乳动物雷帕霉素靶蛋白(mTOR)是调节肌肉质量的关键信号分子,骨骼肌对运动产生的适应性重塑有赖于mTOR信号通路[6-7]。体内和体外试验均表明:氨基酸和胰岛素能够独立地通过mTOR途径而调控蛋白质合成[8]。胰岛素通过PI3K/Akt/mTOR途径激活mTOR,进而激活其下游效应器;氨基酸则可能直接激活mTOR的效应分子或通过间接途径对mTOR通路起作用,从而调控蛋白质转录起始[9]。近年来,动物模型和人群研究表明,生命早期抗生素暴露可能增加其成年肥胖、糖尿病等风险[10]。本课题组前期研究表明哺乳期母鼠接触SMM升高了子代小鼠的胰岛素水平[11]。但是哺乳期SMM暴露是否通过调控PI3K/Akt/mTOR通路影响仔鼠骨骼肌蛋白质的代谢尚未见报导。所以本研究拟观察哺乳期小鼠SMM暴露是否调控mTOR信号通路分子基因表达,影响仔鼠骨骼肌蛋白质代谢。为其毒理学风险评估提供数据依据。
1 材料与方法:
1.1 仪器和试剂
1.1.1 仪器 A300氨基酸分析仪,德国MembraPure公司;LightCycler480 PCR仪,Roch公司;TU1901紫外可见分光光度计,北京普析通用仪器有限责任公司;酶标仪(美国Thermo MultiSkan3型)。
1.1.2 试剂 SMM原料药(有效成分含量为99.8%),安徽华澳生物技术有限公司;氨基酸分析仪 A、B、C、D、E、F、W锂盐流动相,茚三酮,德国MembraPure公司;磺基水杨酸(分析纯),天津博迪化工股份有限公司。RNA提取试剂盒LS1000,逆转录试剂盒A3500,qPCR试剂盒A6001,美国promega公司;BCA总蛋白测定试剂盒,上海碧云天生物技术有限公司。
1.2 动物来源与处理 SPF级ICR小鼠(8周龄),北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2012-0001),雄鼠15只,雌鼠30只;雄鼠体重(30±2)g,雌鼠体重(25±2)g。试验前适应性喂养1周,温度23~25 ℃,湿度45%~55%,昼夜均衡,自由饮食。晚8点,24只雌鼠按雌∶雄=2∶1合笼,次日早7点查到阴栓者确定受孕,孕鼠正常喂养直到自然分娩,分娩后,每窝随机保留雄、雌仔鼠各5只,再将母鼠随机分入对照组(Control)、低剂量SMM处理组(Low)、中剂量SMM处理组(Middle)、高剂量SMM处理组(High),分娩后第1天开始,母鼠每天分别灌胃给予生理盐水和10、50、200 mg/kg SMM(溶于生理盐水),染毒至仔鼠出生后第21天(PND21)。第22天时,每组麻醉处死10只仔鼠(5雄5雌),取其腓肠肌。剩余仔鼠雌、雄分笼正常喂养至PND63。仔鼠每周称体重1次直至PND63。
1.3 氨基酸的测定
1.3.1 组织前处理方法 称取0.10 g腓肠肌组织(精确到0.001 g)于1.5 mL离心管中加入0.5 mL 0.01 mol/L HCl水溶液和0.5 mL 0.01 mol/L HCl水溶液,匀浆。4 ℃,5000 r/m离心5 min,取上清0.5 mL,加0.4 mL磺基水杨酸(去蛋白作用),静置15 min。4 ℃,10000 r/m离心10 min,取上清,过0.22 μL滤膜,上氨基酸分析仪A300检测。
1.3.2 氨基酸分析条件 采用柱后茚三酮衍生法分析氨基酸,进样20 μL。流动相采用锂盐体系,分配时间为:A 25 min, B 10 min, C 30 min, D 5 min, E 55 min, F 25 min。
1.4 PI3K/Akt/mTOR通路相关基因的检测
1.4.1 总RNA提取 腓肠肌组织匀浆后,按照RNA提取试剂盒(Promega)说明书提取仔鼠腓肠肌组织总mRNA。用琼脂糖凝胶电泳检测RNA的完整性。将所有总RNA定量至0.2 μg/μL,分装样品,保持于-80 ℃冰箱。
1.4.2 逆转录 按照逆转录试剂盒说明书进行逆转录反应。(1)反应体系(20 μL体系):总RNA 5 μL,4.75 μL的无核酸酶水,反转录10×缓冲液2 μL,MgCl2(25 mM) 4 μL,dNTP混合物(10 mM)2 μL,AMV 反转录酶0.75 μL,重组的RNasin核糖核酸酶抑制剂 0.5 μL,Oligo(dT)15引物 1 μL。(2)反应条件:70 ℃温育10min,42 ℃孵育60 min,再95 ℃孵育5 min以终止逆转录反应。将合成的cDNA保持于-20 ℃冰箱,用于RT-PCR分析。
1.4.3 实时定量PCR (1)配置反应体系中(20 μL体系):2 μL cDNA,10 μL GoTaq qPCR Master mix,上下游引物(10 μM)各1 μL,无核酸酶水6 μL。(2)反应条件:95 ℃预变性10 min,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 20 s,循环45次。末次循环后进行溶解曲线分析。引物使用PubMed在线Primer3软件设计,由上海生工公司成,各基因引物序列见表1。以磷酸甘油醛脱氧酶基因(Gapdh)作内参基因。

表1 各基因引物序列和基因片段长度
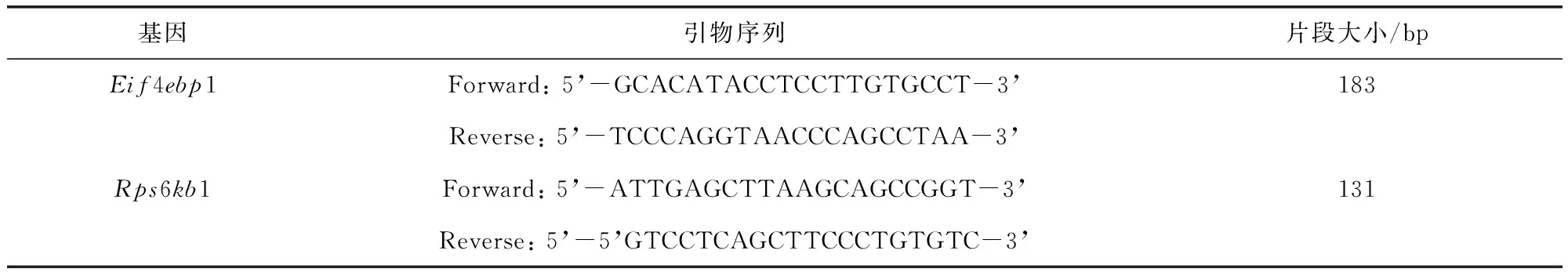
续表1
1.5 总蛋白的提取及测定 取30 mg腓肠肌放入1.5 mL离心管中,加入预冷的RIPA裂解液300 μL,PMSF 3 μL,冰上匀浆,裂解30 min后,4 ℃,15000 g离心15 min,取上清。用BCA法测定总蛋白含量,其原理与步骤见参考文献[12]。1.6 统计分析 采用SPSS17.0统计软件进行分析,数据以均数±标准差(x ±SD)表示。所有行为参数采用单因素方差分析,各组间两两比较采用最小显著差法检验,P<0.05视为差异有统计学意义。
2 结果
2.1 哺乳期SMM暴露对仔鼠体重的影响 雄性和雌性仔鼠在各时期各剂量组间体重差异均无统计学意义,但是与对照组相比,各剂量组有降低趋势(图1)。
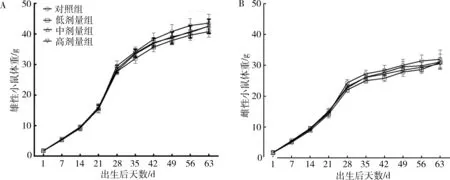
图1 哺乳期SMM暴露对仔鼠体重的影响
2.2 哺乳期SMM暴露对断乳时仔鼠腓肠肌组织游离氨基酸谱的影响 仔鼠断乳时的腓肠肌组织共检测出23种游离氨基酸:P-丝氨酸(P-Ser),丝氨酸(Ser), 天冬氨酸(Asn), 谷氨酸(Glu), 甘氨酸(Gly), 丙氨酸(Ala), 瓜氨酸(Cit), 缬氨酸(Val), 蛋氨酸(Met), 异亮氨酸(Ile), 亮氨酸(Leu), 酪氨酸(Tyr), 苯丙氨酸(Phe), H-半胱氨酸(H-Cysteine), 组氨酸(His), 色氨酸(Trp), 肌肽(Car),鹅肌肽(Ans), 羟赖氨酸(Hylys), 鸟氨酸(Orn),赖氨酸(Lys), 精氨酸(Arg),脯氨酸( Pro)。由表2可见,与对照组比较,中剂量组必需氨基酸(EAA)和非必须氨基酸(NEAA)有增高趋势,高剂量组芳香族氨基酸(AAA)有降低趋势。与对照组比较,中剂量组的Glu, Gly, Ala, Cit, Met, His, Ans含量显著升高(P<0.05),高剂量组的Cit和Ans含量也是显著升高的(P<0.05),而低剂量组的Cit含量是显著降低的(P<0.01)。

表2 哺乳期SMM暴露断乳时仔鼠腓肠肌游离氨基酸谱

续表2
与对照组相比,*P<0.05,**P<0.01,***P<0.001
2.3 哺乳期SMM暴露对仔鼠腓肠肌mTOR信号通路相关基因表达的影响 如图2所示,哺乳期SMM暴露对断乳时仔鼠腓肠肌mTOR上下游基因的表达情况。由图可知,Mtor,Pi3k3ca,Pi3k3cb,Akt1,Eif4ebp1和Rps6kb1各剂量组间表达量无统计学差异(P>0.05),但是Pi3k3ca,Pi3k3cb和Rps6kb1表达量高剂量组与对照组比较有增高的趋势;Eif4ebp1表达量低、中剂量组与对照组比较有增高趋势。
2.4 哺乳期SMM暴露对仔鼠腓肠肌总蛋白含量的影响 断乳时,各剂量组之间的总蛋白含量没有显著差异(P>0.05),如图3所示。
3 讨论与小结
在众多的与蛋白质合成相关的信号通路里,mTOR信号通路是公认蛋白合成的主要通路。mTOR在翻译调控中占有中心的地位,调节蛋白翻译的起始,主要通过其下游的p70S6K、4E-BP1的活性来控制肌肉的生长[13]。已有研究表明胎盘组织中胰岛素可以通过PI3K/AKT/mTOR信号通路对p70S6K进行调节,进而可以影响胎儿体重[14]。前期研究表明哺乳期SMM暴露影响子代仔鼠体内胰岛素水平,而骨骼肌是胰岛素发挥效应的主要靶器官之一,负责餐后 2/3 以上的血糖利用。目前,未发现该抗生素通过mTOR上下游关键信号通路调节动物骨骼肌营养代谢、生长发育或其它相关的研究报告。
本研究结果发现哺乳期SMM暴露引起的仔鼠骨骼肌mTOR信号通路的基因表达没有统计学差异,同时小鼠的体重也没有明显变化,但是mTOR下游信号p70S6K在高剂量组具有上升趋势。推测mTOR信号通路在仔鼠骨骼肌中基因表达水平没有统计学差异,可能与其暴露剂量、暴露时间和仔鼠间接暴露有关。有研究报导,小鼠连续7周暴露于抗生素也没有引起小鼠体重增加的改变[15],与本研究结果一致。又有研究表明SD成年大鼠连续以270 mg/kg的剂量内服SMM 5周后,大鼠血清甲状腺素降低,甲状腺肿大[16],而以上研究的服用剂量或时间都超过本次试验。前期研究发现哺乳期SMM暴露,高剂量组仔鼠血清中的SMM浓度和N4-乙酰化磺胺间甲氧嘧啶(ACSMM)的浓度分别为1.97±0.81 μg/mL 和0.77±0.29 μg/mL[17],该浓度诱导仔鼠体内升高的胰岛素水平不足以激活mTOR信号显著增强。所以同时腓肠肌中的总蛋白含量也没有发生变化。

图2 哺乳期SMM暴露对断乳时仔鼠腓肠肌mTOR信号通路基因表达的影响。

图3 哺乳期SMM暴露对仔鼠腓肠肌总蛋白含量的影响。
支链氨基酸(BCAA)尤其是Leu能够刺激肌肉的蛋白质合成,在mTOR介导的蛋白质合成途径中发挥重要作用,虽然研究结果说明了哺乳期SMM暴露对骨骼肌组织中的氨基酸代谢有一定的改变作用,但是BCAA和Leu的含量没有统计学差异,这与mTOR的基因表达结果一致。有报导称,Gly激活AKT/mTOR信号通路,促进蛋白质的合成,是其促进肠上皮细胞增殖及仔猪生长的机理之一[18]。本次研究虽然说明哺乳期SMM暴露导致仔鼠骨骼肌中Gly含量升高,但是mTOR信号通路没有变化,可能与其他氨基酸的变化有关。如Glu,Glu是构成蛋白质的氨基酸之一,但是过量Glu可以引起神经元的变性与坏死,其机制有待进一步研究。
大量动物和人群研究表明,抗生素的暴露会引起肠道菌群功能紊乱,尤其是生命早期暴露会对宿主造成长期影响包括肥胖和糖尿病,甚至影响宿主行为和脑功能[19-20]。综上所述,哺乳期SMM暴露虽然对仔鼠骨骼肌中氨基酸代谢有一定的影响,但不足以引起骨骼肌中mTOR信号通路发生明显变化,也未引起小鼠体重的变化。为临床上探讨生命早期SMM暴露是否引起健康问题如肥胖和哺乳期暴露SMM的毒理学风险评估提供科学依据。同时也为进一步探讨SMM诱导mTOR信号通路变化的条件和分子机制提供指导依据。
[1] Van Miert A S. The sulfonamide-diaminopyrimidine story [J]. Journal of Veterinary Pharmacology and Therapeutics, 1994, 17(4): 309-316.
[2] Tang J, Shi T, Wu X,etal. The occurrence and distribution of antibiotics in lake chaohu, china: seasonal variation, potential source and risk assessment [J]. Chemosphere, 2015, 122:154-161.
[3] Yamaguchi T, Okihashi M, Harada K,etal. Antibiotic residue monitoring results for pork, chicken, and beef samples in vietnam in 2012-2013 [J]. Journal of Agricultural and Food Chemistry, 2015, 63(21): 5141-5145.
[4] Lu K H, Chen C Y, Lee M R. Trace determination of sulfonamides residues in meat with a combination of solid-phase microextraction and liquid chromatography-mass spectrometry [J]. Talanta, 2007, 72(3): 1082-1087.
[5] Littlefield N A, Sheldon W G, Allen R,etal. Chronic toxicity/carcinogenicity studies of sulphamethazine in fischer 344/n rats: two-generation exposure [J]. Food and Chemical Toxicology, 1990, 28(3): 157-167.
[6] Bodine S C, Stitt T N, Gonzalez M,etal. Akt/Mtor pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophyinvivo[J]. Nature Cell Biology, 2001, 3(11): 1014-1019.
[7] Pallafacchina G, Calabria E, Serrano A L,etal. A protein kinase b-dependent and rapamycin-sensitive pathway controls skeletal muscle growth but not fiber type specification [J]. Proceedings of The National Academy of Sciences of The United States of America, 2002, 99(14): 9213-9218.
[8] O'connor P M, Bush J A, Suryawan A,etal. Insulin and amino acids independently stimulate skeletal muscle protein synthesis in neonatal pigs [J]. American Journal of Physiology Endocrinology and Metabolism, 2003, 284(1): E110-119.
[9] 张柏林, 张林, 于长宁,等. 哺乳动物雷帕霉素靶蛋白对仔猪蛋白质沉积的调控 [J]. 动物营养学报, 2013, 25(11): 2509-2514.
[10]Saari A, Virta L J, Sankilampi U,etal. Antibiotic exposure in infancy and risk of being overweight in the first 24 months of life [J]. Pediatrics, 2015, 135(4): 617-626.
[11]张强, 张丹, 叶逵, 等. 哺乳期磺胺间甲氧嘧啶暴露对仔鼠生长发育及相关激素的影响 [J]. 中国妇幼保健, 2015, 02: 276-278.
[12]吕媛, 马钰, 冯志明,等. 二喹啉甲酸法在牛奶蛋白质定量中的应用[J]. 食品科学, 2010, 31(6):151-154.
[13]Shen W, Boyle D W, Liechty E A. Changes in 4e-bp1 and p70s6k phosphorylation in skeletal muscle of the ovine fetus after prolonged maternal fasting: effects of insulin and Igf-I [J]. Pediatric Research, 2005, 58(5): 833-839.
[14]李冬梅, 宋薇薇, 王阳,等. 胎儿出生体重与p~(70) S6K关系及胰岛素调节出生体重的机制研究[J]. 中华医学杂志, 2009, 41(41):2924-2927.
[15]Ilseung C, Shingo Y, Laura C,etal. Antibiotics in early life alter the murine colonic microbiome and adiposity[J]. Nature, 2012, 488(7413):621-626.
[16]Takayama S, Aihara K, Onodera T,etal. Antithyroid effects of propylthiouracil and sulfamonomethoxine in rats and monkeys [J]. Toxicology And Applied Pharmacology, 1986, 82(2): 191-199.
[17]张强, 张丹, 刘业好, 等. 高效液相色谱法测定小鼠血清中磺胺间甲氧嘧啶及其n4-乙酰化代谢物含量 [J]. 中国兽药杂志, 2015, 2(02): 27-31.
[18]王薇薇, 王斌, 刘闯, 等. 甘氨酸添加对新生仔猪生长性能及肠道发育的影响[C]. 中国畜牧兽医学会动物营养学分会第七届中国饲料营养学术研讨会论文集. 2014.
[19]Desbonnet L, Clarke G, Traplin A,etal. Gut microbiota depletion from early adolescence in mice: implications for brain and behaviour [J]. Brain, Behavior and Immunity, 2015, 48:165-173.
[20]Yallapragada S G, Nash C B, Robinson D T. Early-life exposure to antibiotics, alterations in the intestinal microbiome, and risk of metabolic disease in children and adults [J]. Pediatric Annals, 2015, 44(11): 265-269.
(编辑:陈希)
Effects of Lactational Exposure to Sulfamonomethoxinon Keletal Muscle Protein Metabolism and mTOR Signaling Pathway in Mice Offspring
ZHANG Qiang,YAO Hui-yuan, LAI Han-lin, WANG Hai-qing,RUAN Liang, HU Chun-qiu, LIU Kai-yong*
(SchoolofPublicHealth,AnhuiMedicalUniversity,Hefei230601,China)
The aim of this study was to explore the effects of lactating mice exposed to sulfamonomethoxine (SMM) on skeletal muscle protein metabolism and the mTOR signaling pathway in offspring muscle.The lactating mice were gavaged with 0, 10, 50, 200 mg/(kg·d) SMM for 21 d. On postnatal day(PND) 22, some of the offspring were sacrificed and the gastrocnemius muscles were collected. And then the other offspring were separated with gender, raised normally until PND 63, weighted once every week.The composition of free amino acids in muscle was analyzed by the automatic amino acid analyzer, the key gene expressions of mTOR pathwaywere quantitatively determined using real-time polymerase chain; Finally, the contents of total protein were determined by bicinchoninic acid method in muscle.Compared with controls, the exposure to SMM on body weight of the offspring made no significant difference during the experimental period (P>0.05). And at PND 22, the concentrations of Glu, Gly, Ala, Cit, Met, His and Ans were increased significantly in middle dose group (P<0.05), the ones of Cit and Ans were increased significantly at the high dose (P<0.05), but the one of Cit was notably decreased in the low dose group (P<0.01). The expressionsofMtor,Pi3k3ca,Pi3k3cb,Akt1,Eif4ebp1 andRps6kb1 were not changed significantly (P>0.05). Moreover, the content of total protein in muscle were not changed in the treated groups.Together, lactating exposure to SMM altered the free amino acid profilingin offspring skeletal muscle, but the mTOR signaling pathway was not obviouslyaffected, all of whichwill provide a scientific basis for toxiclogic risk assessment ofcausing metabolic problems when in early lifeexposure to SMM.
lactation; sulfamonomethoxine; skeletal muscle; mTOR
国家自然科学基金项目(81202209);安徽省高等学校优秀青年人才基金(2012SQRL075ZD);安徽医科大学中青年学术骨干资助基金(2012051)
2015-11-22
A
1002-1280 (2016) 01-0036-07
S859.795
