一株新型鸭肝炎病毒的分离与鉴定
2016-02-07陈生雷李凤艳郭华边少国项伟舒秀伟苗玉和
陈生雷,李凤艳,郭华,边少国,项伟,舒秀伟,苗玉和
(辽宁益康生物股份有限公司,辽宁辽阳 111000)
一株新型鸭肝炎病毒的分离与鉴定
陈生雷,李凤艳,郭华,边少国,项伟,舒秀伟,苗玉和
(辽宁益康生物股份有限公司,辽宁辽阳 111000)
从辽宁省某鸭场疑似鸭病毒性肝炎病料中分离到一株病毒,经PCR检测初步鉴定其为鸭肝炎病毒,命名为YK株,应用易感鸭胚和雏鸭进行传代及病毒含量测定,E1~E5代鸭胚适应毒病毒含量在106.5~106.9ELD50/0.2 mL之间,E2代鸭肝组织毒病毒含量为106.3LD50/0.1 mL。动物试验结果表明,YK株鸭胚适应毒E2代对7日龄雏鸭的致死率高达100%。序列测定分析表明,YK株与DHV-A的VP1基因同源性在71.4%~72.3%之间,与DHV-B的VP1基因同源性在71.9%~72.3%之间,与DHV-C的VP1基因同源性在94.3%~98.8%之间。试验表明,YK株与韩国新型鸭肝炎病毒在同一分支上,属于基因C型DHV。
鸭肝炎病毒;分离;鉴定
鸭病毒性肝炎(duck viral hepatitis,DVH)是由鸭肝炎病毒(duck hepatitis virus,DHV)引起的一种传播迅速并高度致死雏鸭的病毒性传染病,以发病急、传播快、病程短、死亡率高为主要特征,主要侵害4周龄以内雏鸭,1周内最易感,死亡率可高达90%以上[1-2]。研究表明,鸭肝炎病毒有三个血清型,即Ⅰ型(DHV-1)及其变异株(la型)、Ⅱ型(DHV-2)和Ⅲ型(DHV-3),DHV-2和DHV-3又分别被称为台湾新型和韩国新型,三个血清型之间没有交叉保护和交叉中和作用。
为了更好地研究鸭病毒性肝炎的病原,根据DHV的基因进化规律又将其分为A、B、C型,分别对应原有的DHV-1、台湾新型、韩国新型[3-5]。新型的鸭肝炎病毒的出现给养鸭业带来了严重的经济损失。近年来,戴玉婷[6]、孙林杰[7]、张雪[8]等相继报道了与DHV-1不同的新型鸭肝炎病毒。本试验对辽宁省疑似鸭病毒性肝炎病鸭进行了病原分离和鉴定,以期为鸭病毒性肝炎的防治提供依据。
1 材料与方法
1.1 材料 DHV-1型病毒SDE株及其阳性血清,由辽宁益康生物股份有限公司提供;疑似DHV病料来自辽宁省一鸭场的发病鸭。
1.2 实验动物 易感鸭胚及健康易感雏鸭,由辽宁益康生物股份有限公司提供,使用前检测抗体为阴性。
1.3 试剂 核酸提取试剂盒和RT-PCR一步法试剂盒,购自北京全式金生物科技有限公司。
1.4 病毒鉴定与增殖
1.4.1 RT-PCR初步鉴定 根据GenBank中已公布的新型鸭肝炎病毒全基因序列,设计引物,上游引物:5’-AGCACGAGAGACCCTTACG-3’,下游引物:5’-CCCACAGGCTCTCACTAAAG-3’,由宝生物工程(大连)有限公司合成。将采集的病料处理后,应用上述特异性引物按程序进行RT-PCR扩增,产物于1%琼脂糖凝胶电泳后观察,预计扩增片段长度为770 bp。
1.4.2 在鸭胚上增殖 将无菌采集的病鸭肝脏在灭菌的研磨器内充分研磨,用灭菌生理盐水制成l︰5乳剂,3000 r/min 离心30 min,取上清液,加青、链霉素,使终浓度为2000 IU/mL,4 ℃过夜。取11日龄易感鸭胚20枚,分为2组,第1组为试验组,经尿囊腔途径接种病料,0.2 mL/胚;第2组为对照组,经尿囊腔途径接种灭菌生理盐水,0.2 mL/胚。接种后继续孵化,每日照蛋2次,收获24~144 h死亡胚尿囊液,观察胚体及内脏病变,参照《中国兽药典》[9]经无菌、支原体及外源病毒检测合格后冻干保存、备用。按此方法连续传代。
1.4.3 在易感雏鸭上增殖 将1.4.2样品做100倍稀释后,经胸部肌肉注射7日龄雏鸭,0.1 mL/只。观察7日,无菌采集攻毒后死亡且具有典型病变的鸭肝脏,研磨后分装,-20 ℃保存。
1.4.4 对鸭胚的半数致死量测定 取分离株鸭胚尿囊液作10倍系列稀释,取适宜稀释度经尿囊腔接种11日龄易感鸭胚,每个稀释度接种5枚,0.2 mL/枚,37 ℃孵育,观察7日,记录鸭胚死亡情况,按Reed-Muench 法计算鸭胚半数致死量(ELD50)[9]。
1.4.5 对易感雏鸭的半数致死量 将肝组织毒E2经10倍系列稀释,取适宜稀释度经胸部肌肉注射7日龄易感雏鸭,每个稀释度接种6只,0.1 mL/只,观察10日,计算雏鸭半数致死量(LD50)[9]。
1.4.6 动物致病性试验 取7日龄雏鸭20只,随机分为2组,第1组将收获的E2代鸭胚尿囊液作10倍稀释,经胸部肌肉接种雏鸭10只,0.2 mL/只;第2组将0.85%灭菌生理盐水经胸部肌肉接种雏鸭10只,0.2 mL/只,作为对照组。观察10日,记录发病死亡情况,死亡鸭解剖观察病理变化。
1.4.7 特异性血清中和试验 采用固定病毒稀释血清法进行测定,将鸭胚适应毒E2代和SDE株E2代病毒液稀释至病毒含量为200 ELD50/0.1 mL,取适宜稀释度SDE株阳性血清与等量的200 ELD50病毒液混合,37 ℃中和1 h,0.2 mL/枚,同时设立血清对照和病毒对照组,5枚/组,37 ℃孵育7日,记录各组死亡情况。1.4.8 基因序列测定与分析 将PCR产物送至宝生物工程(大连)有限公司进行测序,并将结果用DNAStar软件进行序列分析,参考序列见表1。
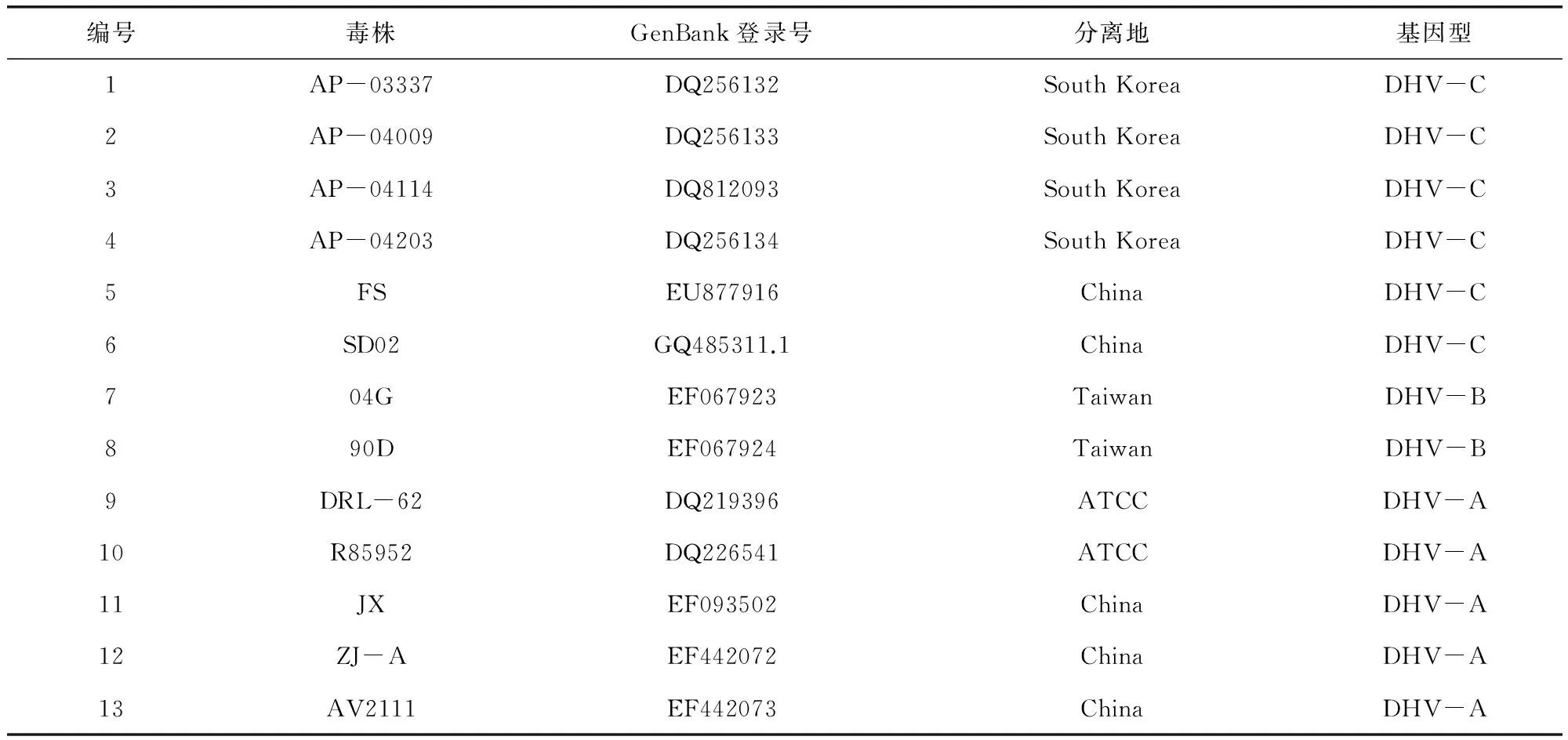
表1 参考序列
2 结果
2.1 分离鉴定结果 将临床疑似鸭肝炎病例的感染动物,采集肝组织,经研磨处理经RT-PCR初步鉴定为新型鸭肝炎病毒(图1),此病毒能在鸭胚上增殖,并能使7日龄易感雏鸭发病。
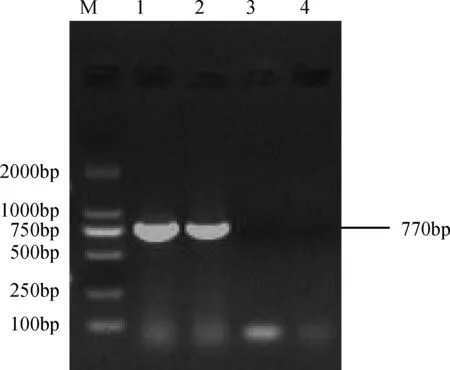
M:DL2000 Marker;1:YK株鸭胚毒;2:YK株肝组织毒;3:SDE株;4:阴性对照图1 RT-PCR结果
2.2 鸭胚传代及病毒含量测定 在11日龄鸭胚上连续传代至E5代,接种鸭胚后死亡时间主要集中在96~120 h,死亡胚皮下出血、水肿,肝脏有明显的坏死灶或坏死点(图2),对照组鸭胚则全部存活。传至E3代后鸭胚死亡规律,毒价稳定,表明该分离株能很好的适应11日龄易感鸭胚。结果见表2。

表2 鸭胚传代死亡比例及病毒测定结果
2.3 雏鸭半数致死量测定 将YK株E2代肝组织毒应用7日龄易感雏鸭进行半数致死量测定,易感雏鸭于攻毒后24 h开始死亡,死亡高峰集中在24~48 h,死亡雏鸭呈现典型的角弓反张状态,剖检肝脏有明显的点状出血。结果YK株E2代肝组织毒对雏鸭的半数致死量为106.3LD50/0.1mL。2.4 动物致病性试验 第1组试验鸭攻毒后24 h开始发病死亡,72 h全部死亡,死亡主要集中在攻毒后24~48 h,共死亡20只,致死率高达100%;临床症状为突然发病,精神萎靡,食欲废绝,发病片刻即倒地,先是两腿向上作游泳样划动,后头部向后仰,呈现角弓反张状。解剖死亡鸭,肝脏肿胀,呈土黄色,有明显的出血斑点,其他脏器无显著变化,剖检结果见图3。第3组对照鸭则全部健康存活。
2.5 血清中和试验 表3结果表明,YK株不能被Ⅰ型鸭肝炎病毒阳性血清中和,SDE株能被Ⅰ型鸭肝炎病毒阳性血清中和,说明YK株和SDE株为不同血清型。
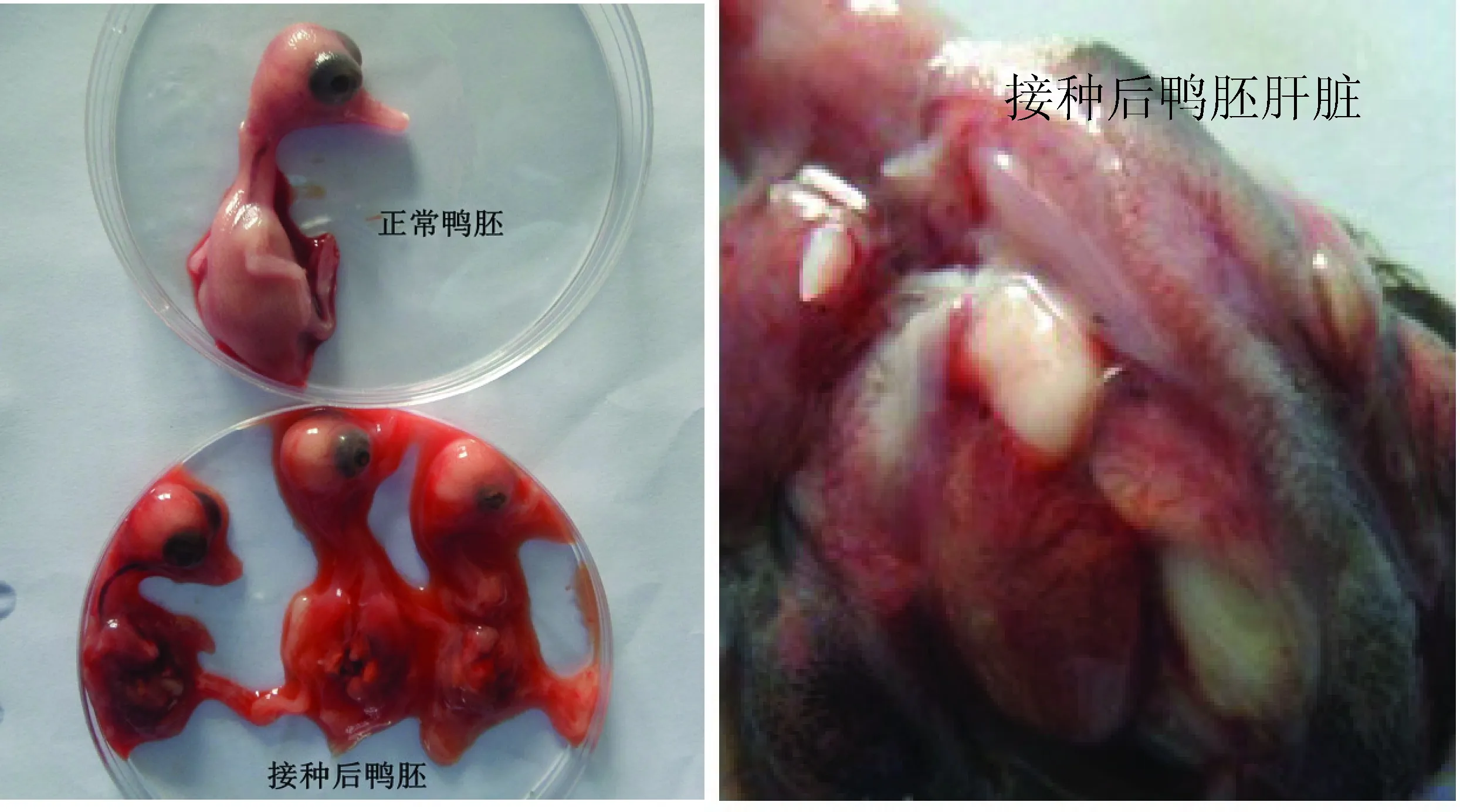
图2 YK株接种后鸭胚及肝脏病变
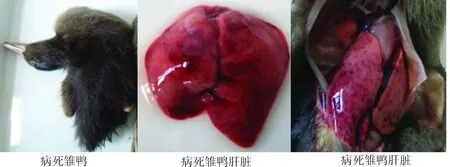
图3 攻毒后死亡雏鸭及病变肝脏

毒株鸭胚死亡比例DHV-1阳性血清病毒对照空白对照YK株5/55/50/5DHV-1型SDE株0/55/5/
2.6 测序分析 应用设计引物,对YK株进行RT-PCR扩增并将产物进行测序,将测序结果与鸭肝炎病毒VP1基因序列进行比对,并构建进化树。结果显示,YK株与DHV-C型基因同源性为94.3%~99.0%,与台湾新型(04G和90D)基因同源性分别为71.9%和72.3%,该分离株与DHV-C型属于同一基因型,且与DHV-B型相邻,但与DHV-A处于不同的分支。结果见图4、图5。
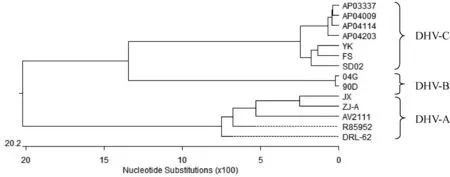
图4 YK株测序结果进化分析
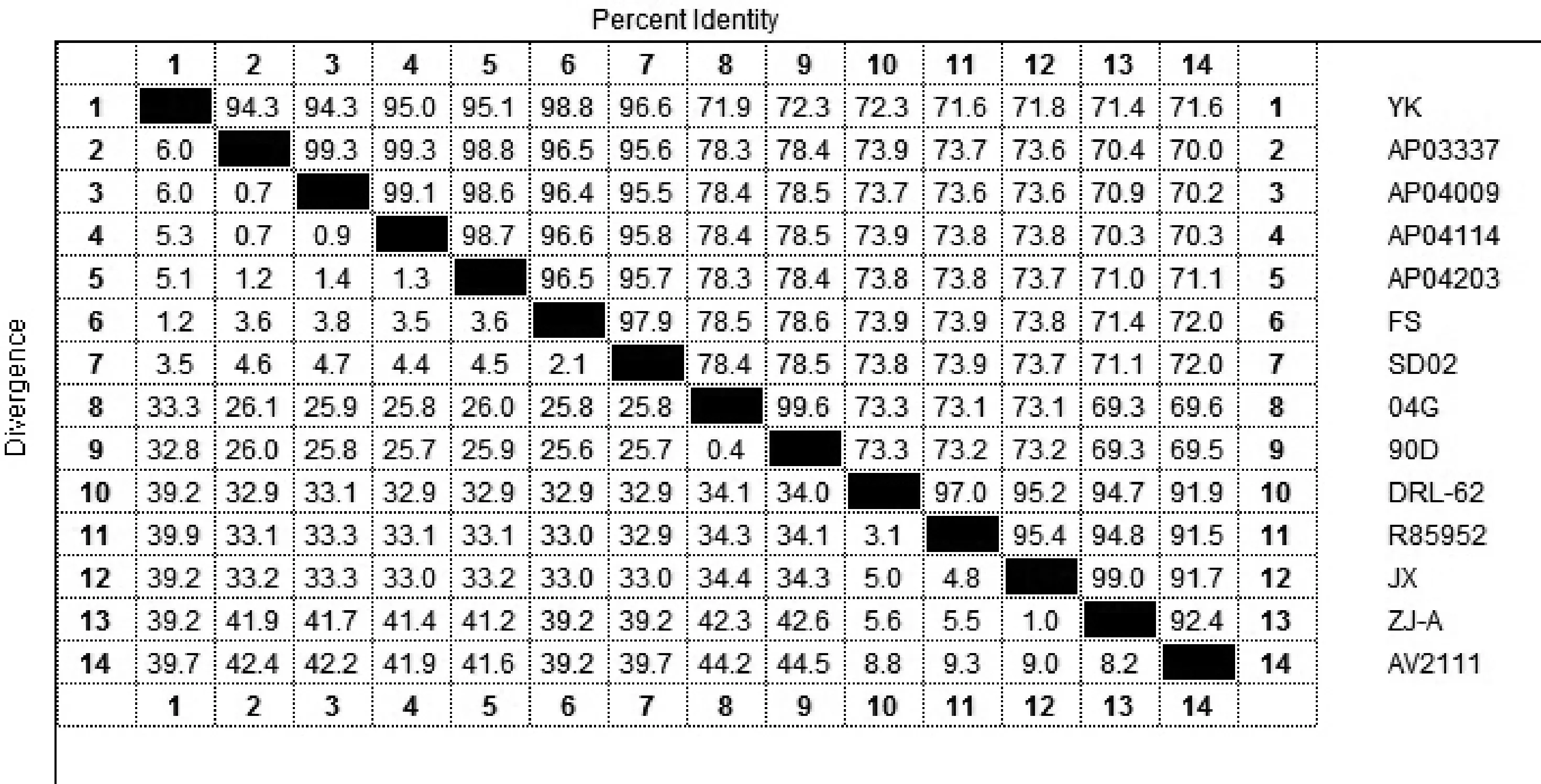
图5 不同毒株基因序列比较分析
3 讨论与小结
本试验应用RT-PCR检测,对辽宁省某地发病鸭初步鉴定为新型鸭肝炎病毒,并使用易感鸭胚对病料进行分离传代培养,该分离株经病毒含量测定、半数鸭胚致死量测定、本动物回归试验、血清中和试验鉴定为为DHV-C型鸭肝炎病毒,并命名为YK株。
目前鸭病毒性肝炎的预防与治疗主要以Ⅰ型的弱毒疫苗和卵黄抗体制剂为主,但Ⅰ型和新型的鸭肝炎病毒之间不具备交叉保护。本研究中成功分离到DHV-C型鸭肝炎病毒,为进一步研制针对DHV-C型鸭肝炎病毒的抗体制剂或疫苗奠定了基础。
[1] 陆承平. 兽医微生物学[M]. 3版. 北京: 中国农业出版社,2001.
[2] 刘美玲. 鸭病毒性肝炎的流行病学特征及防制[J]. 中国畜牧兽医, 2008,35(7): 103-104.
[3] Kim M C,Kwon Y K,Joh S J,etal. Recent Korean isolates of duck hepatitis virus revealed the presence of a newgeno-and serotype when compared to duck hepatitis virus type 1 type strain[J]. Arch Virol, 2007,152 (11) : 2059-2072.
[4] Wang L,Pan M,Fu Y,etal. Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis[J]. Virus Genes,2008,37(1) :52-59.
[5] 韦天超,石梦霞,兰奉瑜,等. 一株广西新型鸭肝炎病毒的分离与初步鉴定[J].广西畜牧兽医,2012,28(5):259-260.
[6] 戴玉婷,王杉,宋扬,等. 鸭甲肝病毒VP1基因克隆及序列分析[J]. 中国兽药杂志,2015,49(2):18-21.
[7] 孙林杰,王雪平,宋国亮,等.一株鸭肝炎病毒的分离与鉴定[J].中国兽药杂志,2014,48(4):15-18.
[8] 张雪,龚文孝,胡勇,等.Ⅰ型鸭肝炎病毒基因C型株的分离与鉴定[J]. 动物医学进展,2015,36(1):23-26.
[9] 中国兽药典委员会. 中和人民共和国兽药典[S]. 2010版. 北京:中国农业出版社,2011.
(编辑:李文平)
Isolation and Identification of a Duck Hepatitis Virus Strain
CHEN Sheng-lei, LI Feng-yan, GUO Hua, BIAN Shao-guo,XIANG Wei, SHU Xiu-wei, MIAO Yu-he
(LiaoningYikangBiologicalCo.,Ltd,Liaoyang,Liaoning111000,China)
A virus strain was isolated from suspected duck viral disease from dead duck in liaoning Province,and identified by reverse-transcriptase polymerase chain reaction.It is a duck hepatitis virus that named YK strain.The isolates were passed from E1to E5,the titer determination in duck embryos were from 106.5to 106.9ELD50/0.2 mL; the titer determination in duckling hepatitis tissue titer was 106.3/0.1mL at E2. Animal regression experimental results showed that The YK strain in duck embryos to 7- day- old duckling mortality was 100%.Sequence comparison with DHV-A serotype showed that the identity was 71.4%~72.3%, 71.9%~72.3% with DHV-B serotype and 94.3%~98.8% with DHV-C serotype.It proves that the YK strain and new serotype strain in Korea belongs to DHV-C serotype.
duck hepatitis virus;isolation;identification
陈生雷,兽医师,从事生物制品研究工作。E-mail: chenshenglei1028@163.com
2015-09-18
A
1002-1280 (2016) 01-0019-05
S852.65
