抗鹅α-干扰素单链抗体基因扩增与表达
2016-02-06姚志兰邓祖丽颖傅宏庆江明香刘永鑫王永娟江苏农牧科技职业学院江苏省兽用生物制药高技术研究重点实验室江苏泰州00郑州幼儿师范学校河南郑州0000湖州市安吉县畜牧兽医局浙江安吉000安吉以琳生物科技有限公司浙江湖州000阜宁县鑫永生态饲养场江苏阜宁00
姚志兰,邓祖丽颖,傅宏庆,黄 平,江明香,刘永鑫,王永娟*(.江苏农牧科技职业学院 江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 00; .郑州幼儿师范学校,河南 郑州 0000; .湖州市安吉县畜牧兽医局,浙江 安吉 000;.安吉以琳生物科技有限公司,浙江 湖州 000; .阜宁县鑫永生态饲养场, 江苏 阜宁 00)
抗鹅α-干扰素单链抗体基因扩增与表达
姚志兰1,邓祖丽颖2,傅宏庆1,黄 平3,江明香4,刘永鑫5,王永娟1*
(1.江苏农牧科技职业学院 江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300; 2.郑州幼儿师范学校,河南 郑州 450000; 3.湖州市安吉县畜牧兽医局,浙江 安吉 313000;4.安吉以琳生物科技有限公司,浙江 湖州 313000; 5.阜宁县鑫永生态饲养场, 江苏 阜宁 224400)
为制备抗鹅α-干扰素的单链抗体,以抗鹅α-干扰素的杂交瘤细胞株总RNA为模板,RT-PCR 法扩增鹅α-干扰素的抗体轻、重链基因,再采用SOE-PCR法,以编码柔性多肽(Gly4Ser)3为接头,组装出完整的鹅α-干扰素的单链抗体可变区片段(ScFv)基因,并将ScFv基因克隆到pGEMT-Easy载体中进行测序分析,将测序正确的ScFv基因片段克隆入pET-30a载体中进行诱导表达。结果显示,成功组装了ScFv基因,其全长为726 bp,为VH- Linker-VL 结构,其中VH 长357 bp、VL长324 bp,成功表达了ScFv蛋白,大小为 27 ku。
鹅; α-干扰素; 单链抗体; 测序; 表达
鹅α-干扰素属于细胞因子家族,具有加强NK细胞杀伤力、抑制细胞增殖、抑制病毒复制、增强MHC Ⅰ 类和MHC Ⅱ 类分子表达的功能[1]。定量检测机体内产生的干扰素,可以了解机体针对病原的免疫状态。常用于干扰素水平检测的方法主要有微生物法、仪器分析法和免疫分析法。免疫分析法具有操作简便快速、成本低、灵敏度较高、分析样本量大的优点。目前,用于免疫检测的抗体有单克隆抗体、多克隆抗体。随着第三代抗体技术的诞生,单链抗体被逐步应用到免疫学检测中。单链抗体是由抗体重链可变区(VH)和轻链可变区(VL)通过一段连接肽(Linker)连接而成的单链抗体可变区片段(single-chain antibody variable fragment,ScFv)[2],是抗原发生特异性结合的最小功能结构单位,分子质量为27~30 ku,其免疫特异性好,在免疫学检测、医学检验等方面已得到了广泛应用[3-4]。ScFv的分子质量小,组装和折叠的条件温和,能适应比其他大部分分子更广谱的表达载体,大部分基因工程载体可被用于ScFv的表达。目前,尚未有关于鹅α-干扰素单链抗体的报道。为此,利用基因工程方法表达了抗鹅α-干扰素ScFv蛋白,以期为建立以鹅α-干扰素单链抗体技术为支撑的细胞因子快速检测方法奠定基础。
1 材料和方法
1.1 材料
T4 DNA连接酶、反转录酶、TaqDNA聚合酶、RNase抑制剂、1 kb DNA Marker、随机引物及各种限制性内切酶均购自Fermentas公司;pET-30a和 pGEMT-easy载体、TRIzol试剂购自美国Promega公司;DH5α大肠杆菌感受态细胞、DNA提取试剂盒、rTaq Master Mix购自康为世纪生物科技有限公司;其他生化试剂均为国产分析纯级。
抗鹅α-干扰素的单克隆抗体杂交瘤细胞株G1由本实验室保存。
1.2 引物设计
[5]的方法,在柔性多肽 (Gly4Ser)3两端分别添加重链和轻链基因序列的互补序列设计Linker 序列,参考文献[6]设计扩增鼠源抗体VH及VL的引物。引物序列见表1,由英潍捷基(上海)贸易有限公司合成。

表1 扩增鼠源单链抗体基因的引物序列
1.3 杂交瘤细胞总RNA提取
培养并收集本实验室保存的抗鹅α-干扰素的杂交瘤细胞株G1细胞,按TRIzol试剂盒说明书提取细胞总RNA,紫外分光光度计测定RNA浓度和纯度。
1.4ScFv的克隆与测序
1.4.1 可变区基因扩增 以大于1 μg的总RNA为模板,利用随机引物参考反转录酶说明书反转录cDNA。取cDNA 5 μL,VH基因上、下游引物(VH-B、VH-F)各1 μL,按常规比例配置50 μL PCR体系,经95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s, 30个循环; 72 ℃ 10 min的反应程序后,取5 μL PCR产物进行琼脂糖凝胶电泳分析,获得VH基因。同样以VL基因上、下游引物(VL-B和VL-F1~4)扩增VL基因。
1.4.2 Linker-VL基因扩增 以VL基因为模板,等摩尔的VL-F1~4的引物混合液与Linker为引物进行Linker-VL基因的PCR扩增。PCR反应体系为50 μL,反应程序为:95 ℃ 5 min;95 ℃ 1 min,55 ℃ 3 min,72 ℃ 2 min,30个循环;72 ℃ 10 min。取5 μL PCR产物进行琼脂糖凝胶电泳分析,获得Linker-VL基因。
1.4.3ScFv全长基因扩增 取等量VH和Linker-VL基因(各150 ng),经94 ℃ 2 min;94 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min扩增得到预拼接产物VH-Linker-VL片段(即为全长ScFv)。以50倍稀释的预拼接产物为模板,全长基因的整套引物(全-B与全-F1~4等摩尔混合)为上、下游引物进行ScFv全长基因的拼接,反应程序为:94 ℃ 1 min;94 ℃ 20 s,55 ℃ 35 s,72 ℃ 1 min,35个循环;72 ℃ 10 min,取5 μL PCR产物进行琼脂糖凝胶电泳分析,获得ScFv全长基因。
参考pGEMT-easy载体说明书,连接ScFv与pGEMT-easy载体,连接产物按常规方法转化、筛选、鉴定,获得经NotⅠ与SfiⅠ双酶切鉴定正确的重组质粒pGEMTeasy-ScFv,送英潍捷基(上海)贸易有限公司进行测序。
1.5 pET-ScFv的构建与鉴定
NdeⅠ和XhoⅠ双酶切重组质粒pGEMTeasy-ScFv,酶切产物经0.8%琼脂糖凝胶分离后,切下ScFv目的条带,纯化回收后与同样经NdeⅠ 和XhoⅠ 双酶切的原核表达载体pET-30a连接,常规方法获得经酶切鉴定正确的重组质粒pET-ScFv。
1.6 ScFv的原核表达
将pET-ScFv转化 BL21(DE3)感受态,挑取阳性克隆分别接种含卡那霉素的LB液体培养基,用1 mmol/L的IPTG在37 ℃诱导培养4 h后收获细菌沉淀物并行超声裂解,将裂解上清和沉淀分别于12% SDS-PAGE胶中分析鉴定。同时,设pET-30a空载体为阴性对照。
2 结果与分析
2.1 鹅α-干扰素可变区基因扩增结果
提取的杂交瘤细胞总RNA质量浓度约为1.3 μg/μL,A260/A280为2.03,质量较高,可以用于进一步试验。扩增获得的全套VH基因经琼脂糖凝胶电泳,可见预期约350 bp的条带;扩增的全套VL基因,在约320 bp处可见清晰条带(图1)。
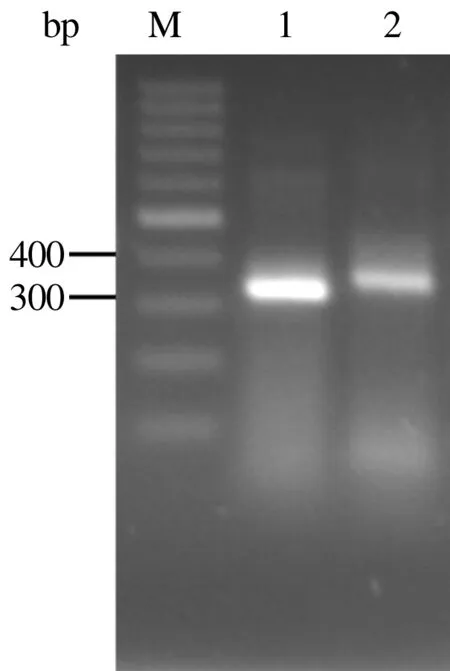
M.DNA Marker; 1.VL基因扩增产物; 2.VH基因扩增产物图1 鹅α-干扰素VH、VL基因扩增结果
2.2ScFv全长基因的组装结果
将VL基因与Linker以PCR方法进行扩增, 获得了Linker-VL基因(中间产物图略)。在PCR反应液中完成了VH和Linker-VL的预拼接。以50倍稀释的预拼接产物为模板,全长基因的整套引物为上、下游引物进行ScFv全长基因的拼接扩增,经琼脂糖凝胶电泳分析,可见约750 bp的清晰条带,即全长ScFv(图2)。
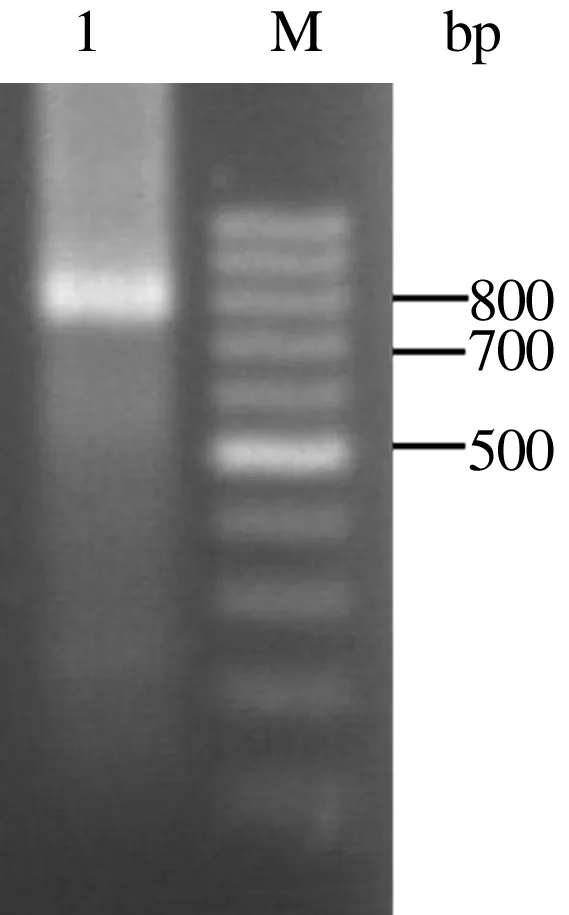
1.全长ScFv扩增产物; M.DNA Marker图2 鹅α-干扰素ScFv全长扩增结果
2.3ScFv的克隆与测序结果
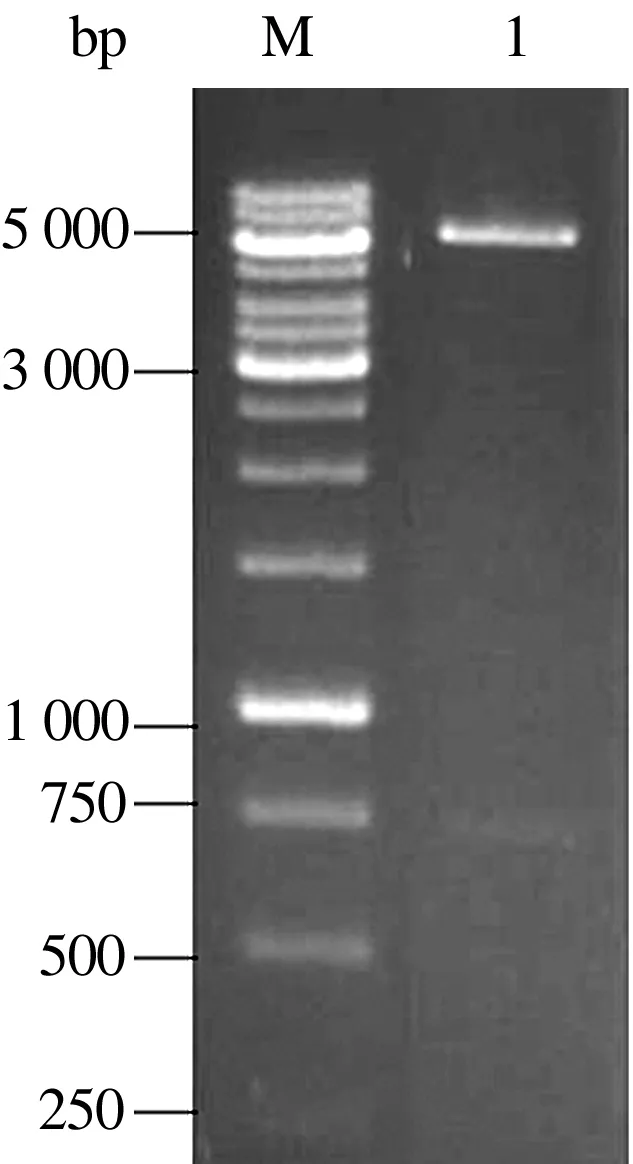
将ScFv全长基因克隆入pGEMT-easy载体中构建pGEMTeasy-ScFv,重组载体经NotⅠ和SfiⅠ双酶切后可释放出预期的插入片段(图3)。随机取2个重组质粒进行序列测定,结果显示,测定的2个质粒序列完全一致,ScFv全长为VH- Linker-VL结构,大小726 bp,其中VH基因357 bp,VL基因324 bp。

1.NotⅠ、SfiⅠ双酶切pGEMTeasy-ScFv; M.DNA Marker图3 pGEMTeasy-ScFv酶切鉴定结果
2.4 ScFv的原核表达
从图4可以看出,将全长ScFv克隆入pET-30a中,用NdeⅠ和XhoⅠ对重组质粒pET-ScFv进行酶切鉴定,可见预期大小的插入片段(图4)。重组菌pET-ScFv经37 ℃、1 mmol/L IPTG诱导培养4 h后,超声裂解并将上清和沉淀分别于12% SDS-PAGE胶中分析鉴定,结果显示,在27 ku处有特异性蛋白质表达(图5)。
M.1kb DNA Marker; 1.Nde Ⅰ、XhoⅠ双酶切pET-ScFv图4 pET-ScFv酶切鉴定结果

1.pET-32a表达产物上清; 2.pET-32a表达产物沉淀; 3.pET-ScFv表达产物上清; 4.PET-ScFv表达产物沉淀; M.蛋白质分子质量标准图5 ScFv重组蛋白的SDS-PAGE分析
3 讨论
前人研究表明,VH-Linker-VL和VL-Linker-VH这2种特异性单链抗体的连接方式,前者的亲和力比后者高10倍以上,而后者的表达量比前者高20倍[7-8],考虑到所制备抗体的实际应用需求,选取亲和力比较好的VH-Linker-VL连接方式。为保证制备的ScFv能正确表达并具有生物学活性,Linker设计非常重要,要符合不干扰VH和VL的空间构象,不引起分子动力学改变,不造成对抗原结合部位的阻碍,尽量减少蛋白酶攻击及防止ScFv 聚集[9]。目前,重复出现的4个甘氨酸和1个丝氨酸(Gly4Ser)3序列是最广泛应用的Linker,本试验选取了这一序列并成功表达了鹅α-干扰素的ScFv,这可以为其他单链抗体的设计提供参考。
良好的免疫学检测和治疗的前提是特异性好、亲和力高的抗体制备。单链抗体结合位点单一、免疫原性低、分子质量小且易于在基因工程载体中表达[10-12],是近年来报道较多的一类抗体。目前,有关ScFv的应用多集中于疾病的诊断与治疗,尚未有关于细胞因子检测的报道。本研究从抗鹅α-干扰素的单克隆抗体杂交瘤细胞株中提取总RNA,利用基因工程方法表达了抗鹅α-干扰素ScFv,可为建立以单链抗体技术为支撑的细胞因子快速检测方法奠定基础。同时,重组DNA技术可以将多个单链抗体基因串联表达,获得多特异性单链抗体,从而克服传统单克隆抗体检测目标单一的缺点,为多基因检测提供可能。
参考文献:
[1] 郑晓灵,刘艳芬,陈绍红,等.重组狮头鹅α-干扰素的制备及抗病毒活性[J].中国兽医科学,2010,40(7):733-737.
[2] Zhang Z X,Lazdina U,Chen M,etal.Characterization of a monoclonal antibody and its single-chain antibody fragment recognizing the nucleoside Triphosphatase/Helicase domain of the hepatitis C virus nonstructural 3 protein[J].Clinical and Diagnostic Laboratory Immunology,2000,7(1):58-63.
[3] Blazek D,Celer V.The production and application of single-chain antibody fragments[J].Folia Microbiologica,2003,48(5):687-698.
[4] 秦丽莉,张春明.单链抗体研究进展及其在医学中的应用[J].国外医学(放射医学核医学分册),2005,29(6):255-257.
[5] Huston J S, Levinson D, Mudgetthunter M,etal.Protein engineering of antibody binding sites:Recovery of specific activity in an anti-digoxin single-chain Fv analogue produced inEscherichiacoli[J].Proceedings of the National Academy of Sciences of the USA,1988,85(16):5879-5883.
[6] 郑志明,金社胜,肖希龙.抗诺氟沙星噬菌体单链抗体库的构建与筛选[J].动物医学进展,2010,31(z1):36-41.
[7] Krebber A,Bornhauser S,Burmester J,etal.Reliable cloning of functional antibody variable domains from hybridomas and spleen cell repertoires employing a reengineered phage display system[J].Journal of Immunological Methods,1997,201(1):35-55.
[8] Gu X,Jia X,Feng J,etal.Molecular modeling and affinity determination of scFv antibody:Proper linker peptide enhances its activity[J].Annals of Biomedical Engineering,2010,38(2):537-549.
[9] Takkinen K,Laukkanen M L,Sizmann D,etal.An active single-chain antibody containing a cellulase linker domain is secreted byEscherichiacoli[J].Protein Engineering,1991,4(7):837-841.
[10] 秦海艳,毛晓燕,乔玉玲,等.单链抗体的研究进展[J].现代生物医学进展,2011,11(4):795-798.
[11] 罗义辉,罗天培.抗有机磷农药单链抗体cDNA文库的构建与鉴定[J].河南农业科学,2014,43(5): 97-101.
[12] 王承民,初冬,秦建华,等.抗堆型艾美耳球虫子孢子单链抗体的构建及表达 [J].河南农业大学学报,2007,41(2):207-211.
Amplification and Expression of the Single-chain Fv Gene
Specific for Goose IFN-α
YAO Zhilan1,DENGZU Liying2,FU Honqing1,HUANG Ping3,JIANG Mingxiang4,LIU Yongxin5,WANG Yongjuan1*
(1.Jiangsu Agri-animal Husbandry Vocational College,Jiangsu Provincial Key Laboratory of Veterinary Bio-pharmaceutical High-tech Research,Taizhou 225300,China; 2.Zhengzhou Infant Normal School,Zhengzhou 450000,China; 3.Animal Husbandry and Veterinary Bureau of Anji,Anji 313000,China; 4.Anji to Lin Biological Technology Co.Ltd.,Huzhou 313000; 5.Funing County Xinyong Ecological Farms,Funing 224400,China)
In order to obtain the single chain variable fragment (ScFv) gene specific for goose IFN-α,total light and heavy domains of the immunoglobulin were amplified from the RNA isolated from anti goose IFN-α monoclonal hybridoma cells by RT-PCR method.Full length ofScFvwas assembled by overlap extension PCR with a linker containing flexible polypeptide (Gly4Ser)3.TheScFvfragment was cloned into the vector pGEMT-Easy and sequenced.And then it was cloned into pET-30a for expression.As a result,theScFvgene related to goose IFN-α,consisting of 726 bp with the structure of VH-Linker-VL was successfully amplified.The VH gene was 357 bp,while the VL gene was 324 bp.ScFv could be expressed in pET-30a(27 ku).
goose; IFN-α; single chain variable fragment; sequencing; expression
2016-02-20
江苏省“六大人才”高峰第十二批培养对象支助项目(10410015002);江苏省农业科技支撑计划(BE2014380);江苏农牧科技学院“凤凰人才工程”项目;江苏农牧科技职业学院重点支持项目(NSFZD1405,NSFPT201510,NSFPT201512)
姚志兰(1979-),女,江苏泰兴人,兽医师,硕士,主要从事动物传染病防治研究。E-mail:1318575080@qq.com
*通讯作者:王永娟(1980-),女,江苏海门人,副教授,博士,主要从事动物传染病防治研究。E-mail:43088591@qq.com
时间:2016-8-4 16:04:13
S852.4
A
1004-3268(2016)08-0136-04
网络出版地址:http://www.cnki.net/kcms/detail/41.1092.S.20160804.1604.001.html
