谷氨酰胺对断奶应激仔猪大肠黏膜抗氧化性能和增殖细胞核抗原表达的影响
2016-02-06陈静,王丽
陈 静,王 丽
(沈阳农业大学 畜牧兽医学院,辽宁 沈阳 110866)
谷氨酰胺对断奶应激仔猪大肠黏膜抗氧化性能和增殖细胞核抗原表达的影响
陈 静,王 丽
(沈阳农业大学 畜牧兽医学院,辽宁 沈阳 110866)
将40头(28±1)日龄的长白×约克夏断奶仔猪随机分为2组,每组设5个重复,分别饲喂基础日粮(对照组)、基础日粮+1.2%谷氨酰胺(谷氨酰胺组),研究日粮中添加谷氨酰胺对断奶仔猪大肠黏膜抗氧化性能和增殖细胞核抗原(PCNA)表达的影响。试验第7天,取仔猪大肠组织,测定其抗氧化指标和PCNA的表达情况。结果表明,谷氨酰胺组大肠黏膜的CAT活性、GSH和NO含量分别比对照组显著提高162.7%、8.3%和47.8%;日粮中添加谷氨酰胺降低了大肠黏膜MDA含量,但与对照组差异未达到显著水平;谷氨酰胺组大肠中PCNA蛋白阳性面积比显著高于对照组61.2%。可见,断奶仔猪日粮中添加1.2%谷氨酰胺能提高大肠黏膜的抗氧化性能,并对大肠黏膜细胞的增殖有一定促进作用。
谷氨酰胺; 抗氧化性能; PCNA; 大肠; 断奶仔猪
谷氨酰胺是机体内含量最丰富的游离氨基酸,是嘌呤和嘧啶核苷酸以及氨基糖合成的前体物,具有许多重要的生理功能。在肠道中,谷氨酰胺可维持肠黏膜细胞的代谢,促进黏膜细胞分裂增殖,加快上皮增生与修复,保护黏膜屏障,提高肠黏膜的抗氧化性能,抑制其通透性[1]。目前,谷氨酰胺对肠道的研究主要集中在小肠,对于猪的主要发酵器官——大肠的研究较少。大肠对动物消化功能有非常重要的作用。大肠微生物能发酵分解小肠中未消化的日粮纤维,产生丰富的挥发性脂肪酸等物质,为动物提供能量[2]。对断奶仔猪而言,由于发育的不完善和饲粮的改变,大肠上皮黏膜细胞易受到氧自由基的攻击,影响大肠发酵功能的同时也影响仔猪的消化效率[3]。前期研究表明,日粮中添加1.2%谷氨酰胺可以显著提高断奶仔猪生产性能,缓解断奶应激[4]。为了进一步探索谷氨酰胺对大肠功能的影响,本研究以断奶仔猪为试验对象,研究谷氨酰胺对大肠黏膜的抗氧化性能和增殖细胞核抗原(PCNA)表达的影响,以阐明谷氨酰胺对大肠功能的调节作用,也为揭示谷氨酰胺的营养调控机制提供依据。
1 材料和方法
1.1 试验动物与试验日粮
选用40头(28±1)日龄平均体质量为(6.8±0.3)kg的长白×大约克夏二元杂交断奶仔猪作为供试动物。仔猪基础日粮配方和营养水平见表1。

表1 基础日粮配方和营养水平
注:每千克日粮含有:维生素A 15 000 IU、维生素B13.0 mg、维生素B29.0 mg、维生素B66.0 mg、维生素B120.03 mg、维生素D33 300 IU、维生素E 60 IU、维生素K36.0 mg、烟酸 60.0 mg、泛酸 18.0 mg、叶酸 1.5 mg、生物素 0.46 mg、氯化胆碱 750 mg、铜12 mg、铁80 mg、锌75 mg、碘0.35 mg、锰10 mg、硒0.30 mg。粗蛋白、钙和磷为实测值,其他均为计算值。
1.2 试验设计与饲养管理
本试验采用单因素完全随机设计。将40头二元杂交仔猪随机分为2组,即对照组和谷氨酰胺组,对照组饲喂基础日粮,谷氨酰胺组在基础日粮中添加1.2%的谷氨酰胺。每个处理5个重复。日粮为粉料,仔猪自由采食,乳头饮水器自由饮水。试验猪舍防疫按照常规程序进行。
1.3 样本制备
试验第7天,每个处理重复随机选取并屠宰1头仔猪,将盲肠组织(中段)取出,一部分组织进行黏膜抗氧化性能测定,另一部分组织进行石蜡切片后,采用S-P免疫组织化学染色方法对大肠黏膜细胞PCNA表达情况进行检测。
1.4 测定项目及方法
1.4.1 大肠黏膜抗氧化性能 将大肠组织(盲肠中段)黏膜与生理盐水制成10%匀浆,测定大肠黏膜过氧化氢酶(CAT)的活性,谷胱甘肽(GSH)、丙二醛(MDA)和一氧化氮(NO)含量。试验方法按南京建成生物工程研究所生产试剂盒说明书进行。
1.4.2 PCNA表达
1.4.2.1 PCNA的免疫组织化学染色 将石蜡切片脱腊。3%H2O2去离子水和蒸馏水混合,室温孵育5~10 min。蒸馏水冲洗,PBS浸泡数分钟。用正常山羊血清工作液封闭,室温孵育15 min,倾去。谷氨酰胺组分别滴加适当比例的PCNA一抗(北京中衫金桥生物技术有限公司),4 ℃过夜。PBS冲洗3次。在37 ℃下用生物素化二抗(北京中衫金桥生物技术有限公司)工作液孵育15 min。PBS冲洗3次后,在37 ℃下用辣根酶标记链卵白素工作液孵育15 min。PBS冲洗。在室温下,用DAB显色液显色5 min,蒸馏水洗涤3次。 苏木精轻度复染10 min。水洗返兰30 min。脱水、透明,最后封片。
1.4.2.2 PCNA表达 用捷达图像分析系统对组织切片进行分析,每片组织切片随机观察5个视野。测定每个视野内免疫组化阳性细胞(即细胞质出现棕黄色颗粒的细胞)的面积占所观察视野面积的百分比。本试验采用的免疫组化染色试剂盒为北京中衫金桥生物技术有限公司产品。
1.5 统计分析
本试验统计分析均采用SPSS 17.0软件中的独立样本t检验,P<0.05为差异显著,结果表示为平均值±标准差。
2 结果与分析
2.1 谷氨酰胺对断奶仔猪大肠黏膜抗氧化指标的影响
由表2可知,仔猪日粮中添加谷氨酰胺对大肠黏膜的CAT活性、GSH和NO含量影响显著。与对照组相比,谷氨酰胺组大肠黏膜中的CAT活性、GSH和NO含量分别显著提高162.7%、8.3%和47.8%,说明谷氨酰胺提高了肠道黏膜的抗氧化性能。在MDA含量方面,日粮中添加谷氨酰胺可降低MDA含量,较对照组降低13.9%,但2个处理间差异未达到显著水平。

表2 谷氨酰胺对断奶仔猪大肠抗氧化指标的影响
注:同行数据肩标不同小写字母表示差异显著(P<0.05)。
2.2 谷氨酰胺对断奶仔猪大肠黏膜PCNA表达的影响
本试验中,谷氨酰胺对仔猪大肠黏膜PCNA蛋白阳性面积比的影响达到了显著水平。谷氨酰胺组仔猪大肠的PCNA蛋白阳性面积比显著高于对照组61.2%(P<0.05)。本试验免疫组化染色结果显示(图1),肠黏膜增殖细胞主要位于黏膜中下部。
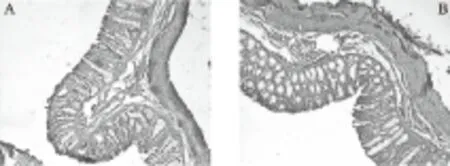
A.对照组(40×); B.谷氨酰胺组(40×)
3 结论与讨论
3.1 谷氨酰胺对断奶仔猪大肠的抗氧化性能的影响
无论是肠组织形态的变化,还是黏膜细胞的凋亡与增殖,都与肠黏膜抗氧化性能有关。仔猪断奶后,由于生理和饲料改变使机体产生氧自由基,氧自由基能攻击肠道细胞膜中的不饱和脂肪酸产生MDA等脂质过氧化物[5],同时导致NO含量增加,NO合成酶的mRNA表达量也下降,降低了NO对肠黏膜的保护作用,加重了肠黏膜的损伤[6]。这种损伤不仅降低胃肠细胞的吸收能力,更严重的是黏膜通透性加大,造成肠道细菌和内毒素移位[7]。还原型GSH是体内保护组织细胞免受自由基损伤、维护组织正常结构与功能的一种重要的抗氧化剂。GSH含量是衡量机体抗氧化能力大小的重要因素[8]。CAT具有防止细胞氧中毒的作用[9]。
本试验结果表明,外源补充谷氨酰胺提高了断奶应激仔猪大肠的GSH含量,这是因为谷氨酰胺是合成还原型GSH的重要前体物质。谷氨酰胺在小肠中被利用后经脱氨反应产生谷氨酸而合成GSH[10]。席鹏彬等[11]认为,外源谷氨酰胺能够补充消失的母源乳汁中的谷氨酰胺,维持和增加肠黏膜细胞内GSH的合成与储备,提高肠黏膜细胞的抗氧化损伤能力,同时增加了CAT活性,降低细胞毒性,减少了MDA的生成。此外,谷氨酰胺代谢产生的精氨酸也是合成NO的前体,因此,谷氨酰胺的添加降低了自由基的损害,提高了肠道的屏障功能,保持了大肠黏膜的完整性。本试验结果与王现盟[12]的研究结果相近。
3.2 谷氨酰胺对断奶仔猪大肠黏膜PCNA表达的影响
PCNA又称周期蛋白,是一种与细胞增殖有关的核内蛋白质[13],是细胞增殖状态的一个重要评价指标[14]。正常生理情况下,猪肠道表面大量黏膜细胞处于快速增殖的状态,细胞的更新需要的能量主要由血流供应和肠腔内的食物来供应。而断奶应激下,由于神经内分泌因素和细胞因子的作用,仔猪会出现食欲抑制,导致肠内营养物质减少,同时应激造成黏膜血管收缩、血流量减少,PCNA合成减少,从而限制了黏膜增生的速度,黏膜出现萎缩,导致肠屏障功能受损。
谷氨酰胺不仅是抗氧化物质合成的底物,还是合成营养成分的原料与底物。谷氨酰胺被认为是黏膜细胞首选的呼吸底物,其氨基氮也被用来合成嘧啶、嘌呤、α-氨基和碳链,以及促进细胞增殖的氨基酸,如鸟氨酸、精氨酸等[15]。本试验结果表明,仔猪日粮中添加谷氨酰胺,提高了大肠黏膜PCNA的阳性表达面积比,说明谷氨酰胺促进了肠黏膜细胞的增殖。张军民[16]研究表明,断奶仔猪日粮中加入谷氨酰胺使肠黏膜质量和黏膜DNA含量显著增加,这可能与PCNA增加有关。Milan等[17]也证实,谷氨酰胺二肽能显著提高肠道的增殖率,提高肠道固有层PCNA细胞阳性表达面积比。PCNA主要在大肠黏膜中下部表达,这种表达特点体现了胃肠黏膜上皮自基底向表层逐渐成熟、衰老、死亡的生长规律。
本试验结果表明,断奶仔猪日粮中添加1.2% 的谷氨酰胺能显著提高大肠黏膜的抗氧化性能和增殖细胞核抗原的表达。
[1] 杨家军,张敏红,冯京海.早期断奶对仔猪肠上皮细胞氧化与损伤的影响[J].安徽农业大学学报,2013,40(1):77-82.
[2] 钟永兴,梁展雯,胡光源,等.猪大肠消化生理的研究进展[J].中国畜牧杂志,2009,45(13):63-66.
[3] 刘巧婷,何若钢,刘谨,等.谷氨酰胺对保育猪生长性能、免疫器官及其小肠形态学发育程度影响的研究[J].饲料工业,2014(15):35-40.
[4] 陈静,刘显军,边连全,等.谷氨酰胺对早期段仔猪生长性能和免疫性能的影响[J].西北农业学报,2006,15(4):58-62.
[5] 张海平,程小爱.水涝胁迫下欧李丙二醛和氧自由基的变化[J].天津农业科学,2015,21(12):15-20.
[6] Janero D R.Nitric oxide(NO)related pharmaceuticals:Contemporary approaches to therapeutical NO modulation [J].Free Radical Bio Med,2002,28(10):1495-1506.
[7] 张秀英.断奶应激对仔猪血清抗氧化功能指标的影响[J].畜禽业,2010(11):42-43.
[8] 赵骏,杨超,王传鹏,等.芹菜素对雄性小鼠肝脏组织总抗氧化能力、还原型谷胱甘肽/氧化型谷胱甘肽值、丙二醛含量影响研究[J].中国医药导报,2013(18): 7-9.
[9] 杨家军.早期断奶仔猪肠上皮细胞氧化与损伤及二氢杨梅素对其调控作用[D].北京:中国农业科学院,2012:60-62.
[10] 连慧香,程丰,朱凤霞,等.饲喂鲜胡萝卜对豫南黑猪产后母猪健康状况及血清免疫和抗氧化指标的影响[J].河南农业科学,2015,44(7):128-131.
[11] 席鹏彬,林映才,蒋宗勇,等.谷氨酰胺二肽对断奶仔猪生长、免疫、抗氧化力和小肠粘膜形态的影响[J].动物营养学报,2007,19(2):135-141.
[12] 王现盟.谷氨酰胺对断奶仔猪肠黏膜形态和细胞能量合成的影响[D].杭州:浙江大学,2010:43-44.
[13] Noha G B,Ezzat A E E.Immunoelectron microscope localization of androgen receptors and proliferating cell nuclear antigen in the epithelial cells of albino rat ventral prostate[J].Journal of Microscopy and Ultrastructure,2015,3(2):75-81.
[14] 章平,张自富.FSH激活的ERKl/2信号通路在GC细胞增殖分化过程中的作用[J].河南农业科学,2014,43(8):120-125.
[15] Kan C C,Chung T Y,Hsieh M H.Gene expression profiling of rice seedlings in response to glutamine treatment[J].Genomics Data,2015,6:123-124.
[16] 张军民.谷氨酰胺对早期断奶仔猪肠道的保护作用及其机理研究[D].北京:中国农业科学研究所,2000:71-77.
Effects of Dietary Glutamine on Antioxidant Traits and Expression of PCNA of Large Intestine of Weaned Piglets
CHEN Jing,WANG Li
(College of Animal Science & Veterinary Medicine,Shenyang Agricultural University,Shenyang 110866,China)
In order to determine the effect of glutamine on antioxidation and cell proliferation of large intestine of weaned piglets,a total of 40 crossbred (Landrace×Yorkshire) pigs were divided into two treatments based on weight and gender.The control group were fed with basal diet,glutamine group were fed with diet added 1.2% glutamine.On the seventh day after weaned,antioxidant traits and masculin area rate of PCNA of large intestine mucosal were measured.The results showed that glutamine supplementation significantly increased GSH,CAT and NO concentrations by 8.3%,162.7% and 47.8%,respectively,compared with the control diet.There was no differences in MDA concentration of large intestine mucosal between two treatments.Pigs fed with diet supplemented with glutamine had 61.2% greater PCNA masculin area rate in large intestine compared that fed with control diet.The test results showed the addition of 1.2% glutamine could significantly increase antioxidation and cell proliferation of large intestine in piglets.
glutamine; antioxidation; PCNA; large intestine; weaned piglets
2016-05-10
辽宁省自然科学基金项目(2014027014);辽宁省教育厅项目(L2013259)
陈 静 (1975-),女,辽宁北票人,讲师,博士,主要从事动物营养与免疫调控研究。E-mail:chenjinglxj@163.com
S816.7
A
1004-3268(2016)11-0122-04
