热激对玉米大斑病菌Stste12基因沉默突变体发育的影响
2016-02-06张运峰
张运峰
(唐山师范学院 生命科学系,河北 唐山 063000)
热激对玉米大斑病菌Stste12基因沉默突变体发育的影响
张运峰
(唐山师范学院 生命科学系,河北 唐山 063000)
为了探明温度升高对玉米大斑病菌Stste12基因沉默突变体生长发育、基因表达水平等方面的影响,对玉米大斑病菌野生型菌株Wt01-23和Stste12基因沉默突变体StRNAi9-10同时进行热激处理,比较2个菌株菌落形态、菌丝形态、菌落生长速度及分生孢子产量方面的差异,并通过半定量PCR技术检测热激处理对Stste12基因表达的影响。结果显示,热激处理提高了突变体StRNAi9-10菌落的生长速度,其菌落形态和生长速度接近Wt01-23菌株,但对Wt01-23菌落的生长速度和形态无显著影响;半定量PCR检测显示,StRNAi9-10在热激处理后Stste12基因表达量增加,且随着温度的升高而增加,而Wt01-23菌株的Stste12基因表达量未发生显著变化。以上结果表明,热激处理恢复了玉米大斑病菌RNAi突变体的生理特征,具有抑制RNAi的作用。
热激; 玉米大斑病菌; 发育;Stste12; 半定量PCR
玉米大斑病菌(Exserohilumturcicum)属无性菌亚门凸脐蠕孢属,其有性态学名为Setosphaeriaturcica,称大斑刚毛座腔菌,属子囊菌亚门座囊菌目[1]。玉米大斑病菌可以引起玉米叶部病害玉米大斑病,在流行年份可造成玉米减产50%以上[2]。目前,在植物病菌中发现了3条与生长发育和致病性有关的信号途径:Ca2+途径、cAMP途径和MAPK(mitogen-activated protein kinase,促分裂原活化蛋白激酶)途径,其中MAPK信号转导途径研究最为深入[3-5],分为Fus3/Kss1-homolog途径、Slt2-homolog途径和Hog1-homolog MAP kinase途径3类保守途径,其中Fus3/Kss1-homolog途径又称PMK 信号途径(pathogenicity MAPK Cascade),主要通过转录因子STE12影响病菌附着胞等侵染结构的形成,从而调控病菌的致病性。STE12首先在酿酒酵母(Saccharomycescerevisiae)中被发现,其作为Fus3/Kssl MAPK 途径的底物,调控酿酒酵母的交配反应、假菌丝的发育及侵入生长[6]。目前,已经在植物病原真菌中发现了很多STE12-like转录因子,它们主要参与调控病菌的侵染过程和有性发育,进而影响病菌的致病性[7-8]。吴敏[9]研究中获得了玉米大斑病菌的STE12-like基因Stste12,并构建了Stste12基因沉默突变体StRNAi 9-10。
热激反应是细胞和生物体对热刺激的一种保守性反应,亚致死剂量的热激诱发热激反应,对细胞或生物体有积极的保护作用[10]。近年来,随着全球气温的升高,频繁出现的极端天气已经开始影响生物的生长和发育,例如,Milus等[11]研究发现,高温会使小麦条锈病菌生长速度增快、产孢量增大。Zhong等[12]对拟南芥的研究显示,温度升高能够恢复拟南芥NRG1 RNAi(RNA interference,RNA干涉)突变体的生长和形态建成。虽然RNAi技术广泛用于生物的基因功能研究,在植物病原真菌中用于弱毒力菌株的培育,但是,在真菌中还没有关于高温环境对RNAi效应影响的研究报道。
本研究通过对玉米大斑病菌野生型菌株Wt01-23及其Stste12沉默突变体StRNAi9-10进行热激处理,比较了Wt01-23 和StRNAi9-10的菌落形态、生长速度、菌丝形态、产孢量,并利用半定量PCR技术检测Stste12基因的表达情况,分析热激处理对玉米大斑病菌形态发育和Stste12基因表达的影响,这对于进一步了解玉米大斑病菌生长发育的调控机制和控制该病菌的危害将具有重要意义。
1 材料和方法
1.1 材料
1.1.1 菌株 玉米大斑病菌野生型菌株Wt01-23及其Stste12基因RNAi突变体菌株StRNAi9-10由唐山师范学院植物病理学实验室保存。
1.1.2 试剂 UNIQ-10 柱式 Trizol总 RNA 抽提试剂盒购于Invitrogen公司;反转录酶Revest Trascriptase M-MLV和rTaq DNA聚合酶购自Takara公司。用于试验的引物β-tubulin-L(5′-AACATGCGTGAGATTGTAAGT-3′)、β-tubulin-R(5′-TCTGGATGTTGTTGGGAATCC -3′)及Stste12基因半定量扩增的引物RTste12-F(5′-GTAGAGACGTAGCCCGTCATCTGG-3′)、RTste12-R(5′-CTCTACCAGATTTTGCGTGGGCTGA-3′),由上海生工生物工程技术服务有限公司合成。DEPC、琼脂糖、无水乙醇、异丙醇、葡萄糖、Tris、冰醋酸、EDTA和琼脂粉等试剂均为国产化学纯。
1.2 方法
1.2.1 菌株的热激处理 首先以PDA培养基活化玉米大斑病菌菌株Wt01-23和StRNAi9-10,然后用打孔器取菌盘(直径6 mm)接种至PDA培养基上培养2 d,之后对Wt01-23和StRNAi9-10进行45 ℃热激15 min的处理;每隔24 h热激处理1次,直至菌株满皿;每个处理3皿,以25 ℃培养的菌株作为对照。
1.2.2 菌落生长速度的测定 采用十字交叉法测量,每隔24 h测定菌落直径,直至菌落满皿。以3次重复试验的平均值为每次测量的菌落直径,采用SPSS方差分析软件对菌落生长速度进行差异显著性分析[13]。
1.2.3 菌丝和菌落的形态观察 热激处理后观察、记录对照和热处理菌株菌丝和菌落形态变化,并进行分析。
1.2.4 分生孢子计数 分生孢子的计数按如下方法进行:待玉米大斑病菌长满培养皿后,向其中滴加适量蒸馏水,然后用毛笔刮下菌丝及分生孢子并制成菌液,过滤后弃去菌丝,5 000 r/min离心10 min,弃去上清后加入0.5 mL蒸馏水,然后用血球计数板对分生孢子进行观察计数,结果用SPSS软件进行差异显著水平分析。
1.2.5 热激处理对Stste12基因表达的影响测定
1.2.5.1 玉米大斑病菌不同温度下的热激处理 Wt01-23和StRNAi9-10菌株的处理参照1.2.1,将每次热激的温度设定为25 ℃、30 ℃、35 ℃、40 ℃、45 ℃。
1.2.5.2 玉米大斑病菌总RNA的提取及第一链cDNA合成 按照 UNIQ-10 柱式 Trizol总RNA抽提试剂盒说明书提取玉米大斑病菌总RNA,按照张鑫等[14]的方法利用Oligo(dT)18合成第一链cDNA。
1.2.5.3Stste12基因表达的半定量分析 分别以Wt01-23和StRNAi9-10热激处理后的第一链 cDNA 为模板,按下列条件进行 PCR 扩增。25 μL 扩增体系中含有10 μmol/L的β-tubulin-R和β-tubulin-F(或 RTste12-F和 RTste12-R)各1 μL、dNTP Mix(各 2.5 mmol/L) 2 μL、10×PCR Buffer 2.5 μL、rTaq DNA 聚合酶(5 U/μL)0.25 μL、cDNA 20 ng,加入ddH2O 至25 μL;经过94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s,计 30个循环的反应。取3 μL PCR 扩增产物在1.5%琼脂糖凝胶上以3 V/cm进行电泳检测。利用 Quantity One(Bio-Rad)分析扩增条带(内标)的亮度值,以内标亮度值确定cDNA的模板量,分析热激条件下Stste12基因表达量的变化。
2 结果与分析
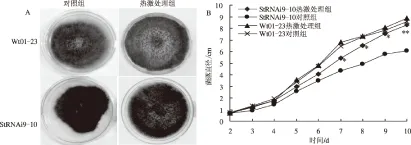
2.1 热激对Wt01-23和StRNAi9-10菌落形态和生长速度的影响
热激处理后,Wt01-23菌株的菌落形态呈灰色、规则圆形,中心部分菌丝成簇生长,靠近边缘的菌丝蓬松,与对照组的菌落形态无显著差异;而热激处理后的StRNAi9-10菌株菌落颜色、形态及菌丝生长形态与Wt01-23菌株相近,且靠近边缘的菌丝蓬松,与该菌株对照组菌落不规则的生长形态差异明显(图1A)。通过比较2种菌株热激处理组和对照组的生长速度可以发现,热激处理对Wt01-23无显著影响;而StRNAi9-10菌株在热激处理后,生长速度从第3天开始高于对照组,第7天起StRNAi9-10菌株的生长速度显著高于对照组,接近Wt01-23的生长速度(图1B)。试验结果表明,热激处理显著提高了StRNAi9-10菌株的生长速度,恢复了该菌株的形态和发育,而对野生型菌株Wt01-23无显著影响。
2.2 热激对Wt01-23和StRNAi9-10菌丝形态的影响
热激处理后,野生型菌株Wt01-23对照组和处理组菌丝均为灰绿色、表面平滑、菌隔清晰明显;突变体StRNAi9-10对照组和处理组菌丝均为灰褐色、表面平滑、菌隔清晰明显(图2)。说明热激对Wt01-23和StRNAi9-10菌株的菌丝形态没有产生显著影响。
*表示与对照组相比P<0.05,**表示P<0.01

图2 热激处理后玉米大斑病菌Wt01-23和StRNAi9-10的菌丝形态
2.3 热激对Wt01-23和StRNAi9-10分生孢子产量的影响
经过热激处理后,玉米大斑病菌Wt01-23及
StRNAi9-10的分生孢子产量均显著增加,说明二者的产孢能力显著增强。在25 ℃处理时,突变体StRNAi9-10的分生孢子产量极显著低于野生型菌株Wt01-23;但是经过热激处理后,Wt01-23和StRNAi9-10的分生孢子产量均极显著高于Wt01-23对照组,且热激处理后Wt01-23和StRNAi9-10的分生孢子产量差异不明显(图3),说明StRNAi9-10菌株的分生孢子发育能力得到了恢复,趋向于野生型Wt01-23的水平。
2.4 热激对Wt01-23和StRNAi9-10Stste12因表达量的影响
通过半定量PCR技术检测和Quantity One软件对电泳图谱进行的定量分析发现,在25 ℃、30 ℃、
35 ℃、40 ℃和45 ℃热激胁迫下,野生型菌株Wt01-23中Stste12基因的电泳条带亮度和表达量无显著差异(图4A和4B)。而随处理温度的增加,StRNAi9-10的Stste12基因条带亮度逐渐增强(图4A)。以25 ℃时Wt01-23菌株的Stste12表达量为对照进行比较发现,随着温度的增加,StRNAi9-10的Stste12基因表达量由极显著差异趋向于差异不显著(图4B),表明随温度上升Stste12基因的表达量逐渐增加,45 ℃时表达量增加最多,接近野生型Wt01-23的表达水平。试验结果表明,在热激胁迫条件下,玉米大斑病菌StRNAi9-10的菌丝细胞内基因表达会发生相应的变化,导致Stste12的表达水平显著增强,甚至接近于玉米大斑病菌野生型Wt01-23的表达水平。

**表示与Wt01-23对照组相比P<0.01
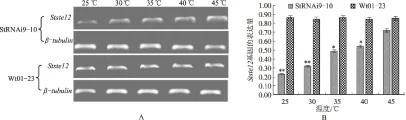
A.琼脂糖凝胶电泳检测; B.灰度分析。*表示与25 ℃处理的Wt01-23菌株相比P<0.05,**表示P<0.01
3 结论与讨论
STE12是PMK信号途径中一个重要的调控因子,在植物病原真菌的分生孢子形成、侵染结构发育及致病力形成等方面具有重要调控作用[7]。本试验发现,随着温度的增加,玉米大斑病菌野生型菌株Wt01-23的菌落形态、生长速度和菌丝形态均未受到显著影响,但分生孢子的数量显著增加,这与Milus等[11]对小麦条锈病菌的试验结果一致,说明在玉米大斑病菌中,该试验条件的热激处理,除了显著促进分生孢子形成相关基因的表达外,并未对菌丝形态建成等其他基因产生显著影响。突变体StRNAi9-10菌株随着热激温度的升高,菌落的形态、生长速度及分生孢子产量均与其对照组呈现显著差异,且Stste12基因的表达量较对照组显著增加,表明热激可以恢复Stste12基因表达。
RNAi是由双链RNA(dsRNA)介导的、由特定酶参与的特异性基因沉默现象,它在转录水平、转录后水平和翻译水平上阻断基因的表达,主要包括siRNA的形成和siRNA与沉默复合物结合2个步骤[15-16],受到多种因子的参与和调控。本试验中,随着培养温度的升高,玉米大斑病菌RNAi突变体StRNAi9-10的菌落形态发生了明显的恢复;通过半定量PCR检测发现,菌株StRNAi9-10中ste12基因的表达量随着温度的升高显著提高,这与Zhong等[12]在拟南芥中的试验结果较为相似。推测较高的温度降低了玉米大斑病菌突变体中RNAi沉默的效率,导致了Stste12基因表达显著升高,进而使Stste12基因表达量得到部分恢复,促使突变体菌株StRNAi9-10恢复野生型状态。
目前,关于高温胁迫研究主要集中在热激蛋白(heat shock protein,HSP)上[17],并明确了该蛋白的表达能够保护细胞内生物活性分子正常工作,显著提高细胞在高温胁迫下的适应性[18-19]。Mourrain等[20]和Zhong等[12]在对拟南芥的试验中发现,sgs3/sde1主要通过调控dsRNA的特异性降解起到调控沉默效应的作用,同时发现在高温环境中sgs3基因的表达会明显减弱,进而导致沉默效率显著降低。由于在玉米大斑病菌中尚未获得sgs/sde1类基因及其功能研究的结果,因此,下一步需找到玉米大斑病菌sgs/sde1相关基因,阐明玉米大斑病菌中高温胁迫影响RNAi的机制。
[1] Dong J,Fan Y,Gui X,etal.Geographic distribution and genetic analysis of physiological races ofSetosphaeriaturcicain northern China[J].American Journal of Agricultural and Biological Sciences,2008,3(1):389-398.
[2] Perkins J M,Pedersen W L.Disease development and yield losses associated with leaf northern blight on corn[J]. Plant Disease,1987,71(10):940-943.
[3] Yang S H,Sharrocks A D,Whitmarsh A J.Transcriptional regulation by the MAP kinase signaling cascades[J]. Gene,2003,320(4):3-21.
[4] Krens S F,Spaink H P,Snaar-Jagalska B E.Functions of the MAPK family in vertebrate-development[J].FEBS Lett,2006,580(21):4984-4990.
[5] Chen R E,Thorner J.Function and regulation in MAPK signaling pathways:Lessons learned from the yeastSaccharomycescerevisiae[J].Biochimica Et Biophysica Acta,2007,1773(8):1311-1340.
[6] Errede B,Ammerer G.STE12,a protein involved in cell-type-specific transcription and signal transduction in yeast,is part of protein-DNA complexes[J].Genes & Development,1989,3(9):1349-1361.
[7] Rispail N,Di Pietro A.The homeodomain transcription factor Ste12:Connecting fungal MAPK signalling to plant pathogenicity[J].Communicative & Integrative Biology,2010,3(4):327-332.
[8] 张运峰.碳源对Stste12基因调控玉米大斑病菌生长和分生孢子发育的影响[J].河南农业科学,2016,45(1):71-75.
[9] 吴敏.玉米大斑病菌MAPK级联途径中Stste12基因的克隆与功能分析[D].保定:河北农业大学,2012.
[10] Carr⊇r A,Brion J D,Alami M,etal.Regulation of the heat-shock response[J].Plant Physiology,1998,117(4):1135-1141.
[11] Milus E A,Kristensen K,Hovmoller M S.Evidence for increased aggressiveness in a recent widespread strain ofPucciniastriiformisf.sp.triticicausing stripe rust of wheat[J].Phytopathology,2009,99(1):89-94.
[12] Zhong S H,Liu J Z,Jin H,etal.Warm temperatures induce transgenerational epigenetic release of RNA silencing by inhibiting siRNA biogenesis inArabidopsis[J].PNAS,2013,110 (22):9171-9176.
[13] 王梅娟,李坡,吴敏,等.高渗胁迫对玉米大斑病菌生长发育及STK1表达的影响[J].中国农业科学,2012,45(19):3965-3970.
[14] 张鑫,曹志艳,刘士伟,等.玉米大斑病菌聚酮体合成酶基因StPKS功能分析[J].中国农业科学,2011,44(8):1603-1609.
[15] McManus M T,Sharp P A.Gene silencing in mammals by small interfering RNAs[J].Nature Reviews Genetics,2002,3(10):737-747.
[16] Nykanen A,Haley B,Zamore P D.ATP requirements and small interfering RNA structure in the RNA interference pathway[J].Cell,2001,107(3):309-321.
[17] Morishima N.Control of cell fate by Hsp70:More than an evanescent meeting[J].Journal of Biochemistry,2005,137(4):449-453.
[18] 陈亚琼,肖调江,周浙昆.热激蛋白与生物环境适应及进化的关系[J].自然科学进展,2006,16(9):1066-1073.
[19] 曹华宁,刘博,刘太国,等.小麦条锈菌hsp70基因的克隆及热胁迫下的表达特征分析[J].植物保护,2015,41(3):19-24.
[20] Mourrain P,Beclin C,Elmayan T,etal.ArabidopsisSGS2 andSGS3 genes are required for posttranscriptional gene silencing and natural virus resistance[J].Cell,2000,101(5):533-542.
Effects of Heat Shock Treatment on Development ofStste12 Silencing Mutant ofSetosphaeriaturcica
ZHANG Yunfeng
(Department of Life Science,Tangshan Normal University,Tangshan 063000,China)
In order to explore the effect of temperature rise on the growth andStste12 expression ofSetosphaeriaturcicaStste12 silencing mutants,the effects of heat shock treatment on the colony and mycelium morphology,colony growth speed,and spore formation of wild-type strain Wt01-23 andStste12 silencing mutant StRNAi9-10 were analyzed in this paper,and semi-quantitative PCR was performed to examine the effect of heat shock treatment on the expression ofStste12.The results demonstrated that heat shock treatment had no significant impact on the colony growth speed and morphology of Wt01-23,but significantly accelerated the growth of StRNAi9-10,which had similar growth speed and colony morphology to Wt01-23 under the heat shock treatment.Stste12 mRNA level in StRNAi9-10 was significantly up-regulated after heat shock treatment in a temperature-dependent manner,but not in Wt01-23.These data showed that heat shock treatment could inhibit RNAi silencing,and restore the physiological characteristics ofSetosphaeriaturcicaRNAi mutant.
heat shock;Setosphaeriaturcica; development;Stste12; semi-quantitative PCR
2016-05-15
国家自然科学基金项目(31271997);河北省自然科学基金项目(C2014105067);河北省留学人员科技活动项目(C2015005009);唐山师范学院科学研究基金项目 (2014E04,2013A03)
张运峰(1982-),男,河北石家庄人,实验师,硕士,主要从事植物病理学与分子生理学的相关研究。 E-mail:zyfikx@126.com
S435.131;Q935
A
1004-3268(2016)11-0071-05
