打破紫荆种子休眠方法研究
2016-02-06米建华孙雪霞娄秋莲符真珠
米建华,孙雪霞,娄秋莲,符真珠,张 晶
(1.郑州市紫荆山公园,河南 郑州 450002; 2.河南省农业科学院 园艺研究所,河南 郑州 450002)
打破紫荆种子休眠方法研究
米建华1,孙雪霞1,娄秋莲1,符真珠2,张 晶2
(1.郑州市紫荆山公园,河南 郑州 450002; 2.河南省农业科学院 园艺研究所,河南 郑州 450002)
比较4个紫荆品种(普通紫荆、白紫荆、加拿大紫荆及巨紫荆)在打破种皮休眠(机械损伤、浓硫酸、过氧化氢处理)和打破内休眠(0、100、200、400 mg/L GA3浸种)条件下处理24 h或48 h后种子萌发率的差异。结果表明:机械损伤和浓硫酸处理能在不伤及种胚的条件下快速有效地腐蚀紫荆种皮,从而促进种子萌发;过氧化氢处理对种皮有轻微腐蚀作用,但对打破紫荆种皮休眠无明显作用;在解除种皮休眠后,100 mg/L和200 mg/L GA3处理的种子发芽率较高,普通紫荆、加拿大紫荆发芽率达到100%,巨紫荆发芽率为70%。紫荆种子最佳萌发条件为:浓硫酸酸蚀45 min洗净后,转入200 mg/L GA3水溶液中浸泡24 h,置于25 ℃湿润滤纸上暗培养,至子叶伸展后于12 h光照/12 h黑暗条件下培养15 d后即可。此处理下,除巨紫荆发芽率和成苗率相对较低(仅为70%和40%)外,其他3个紫荆品种的发芽率和成苗率可高达100%。
紫荆种子; 解除休眠; 快速萌发
紫荆(Cercischinensis),别名满条红,为豆科(Leguminosae)紫荆属(CercisL.)的落叶乔木或灌木。单叶互生,花冠假蝶形,花两侧对称排成总状花序,先于叶开放;荚果扁带形;种子2至多颗,近圆形,扁平,无胚乳。紫荆的观赏价值体现在它的叶色、叶形、密花、荚果及优美的冠型,加上其有较强的耐阴性和一定的耐寒性,被广泛用于庭院、建筑物前及草坪边缘搭配种植,具有较好的园林应用前景[1]。紫荆种皮及花梗有解毒消肿之效[2],种皮和茎皮提取物中富含的黄酮[3],具有消炎镇痛及耐缺氧抗疲劳作用[4-5]。洋紫荆挥发油具有抗肿瘤效果[6],天然紫荆花色素可用于制取彩色包装纸[7];此外,其木材还可用于家具、建筑等[8]。
紫荆常用的繁殖方式包括播种、分株、扦插及压条等,其中以播种为主[8]。紫荆种子具有双重休眠(种皮透性差及内休眠)的特性[9],目前生产上广泛采用层积的方式进行播种前处理,但是层积处理耗时较长,一般需要80 d左右,播种育苗耗时、耗力,也不便于种子的检验。关于打破紫荆种子休眠,缩短其苗期的报道较少,目前较为有效的方法是250 mg/L GA3溶液浸泡经浓硫酸酸蚀过的紫荆种子,然后湿沙层积60 d以达到打破种子休眠的效果;巨紫荆种子在250 mg/L GA3溶液中浸泡24、48 h后层积,发芽率分别达22.5%和25.5%[9-10]。打破种子休眠促进其萌发常采用的方式有:盐胁迫[11]、低温[12-13]、干热[14]、6-BA、2,4-D[15]、GA3[16-17]、IAA[18]、硫酸[16,19]、人工破皮[17]及柠檬酸[20]处理等。本研究针对紫荆种子的特性,在变温培养条件下,将表面经硫酸酸蚀、机械损伤处理的种子,进行不同质量浓度和时间的GA3处理,以筛选较优的处理方法,为紫荆工厂化育苗高效体系的建立提供技术支持。
1 材料和方法
1.1 试验材料及试验仪器
试验用紫荆种子由郑州市紫荆山公园提供,选取普通紫荆(Cercischinensis)、巨紫荆(Cercisgigantea)、白紫荆(CercischinensisBunge f.albaHsu)及加拿大紫荆(Cerciscanadensis)4个品种的饱满纯净种子。2014年采收其成熟果实,千粒质量、纯净度如表1所示。浓硫酸由烟台市双双化工有限公司生产,GA3由上海蓝博生物科技有限公司生产,过氧化氢由天津市瑞金特化学品有限公司生产,9 cm的定量滤纸由杭州特种纸业有限公司生产。人工气候箱购自宁波莱福科技有限公司,选用直径9 cm的玻璃培养皿为种子发芽试验容器。

表1 供试紫荆种子纯净度及千粒质量
1.2 试验方法
种子发芽试验在河南省农业科学院园艺研究所园林花卉研究室实验室进行。因紫荆属种子种皮坚韧、透性不良[21],选择品种、温度、种皮休眠及内休眠4种因素进行试验设计,以常温未经处理的种子为对照。种子萌发初期均为黑暗环境条件,待种子露白后,调整为12 h光照/12 h黑暗培养。
①温度处理:选用经浓硫酸浸泡45 min、100 mg/L GA3处理24 h的4个品种紫荆种子,分别置于25 ℃恒温和20 ℃/30 ℃变温条件下培养。
②种皮处理:将加拿大紫荆种子分别用机械损伤(剪去边缘种皮)、浓硫酸(浓硫酸浸泡至部分种子出现孔纹,约45 min)和过氧化氢处理(少数种子出现膨胀为止)后,经200 mg/L GA3处理24 h,于25 ℃恒温条件下培养。
③GA3处理:在25 ℃恒温培养条件下,分别对经硫酸酸蚀过的种子进行GA3不同浸泡时间和质量浓度的处理。其中,浸泡时间的处理中,选用200 mg/L GA3分别浸泡24 h和48 h;而浸泡质量浓度上则是分别选用100、200、400 mg/L GA3处理24 h。具体试验方案见表2—5所示。
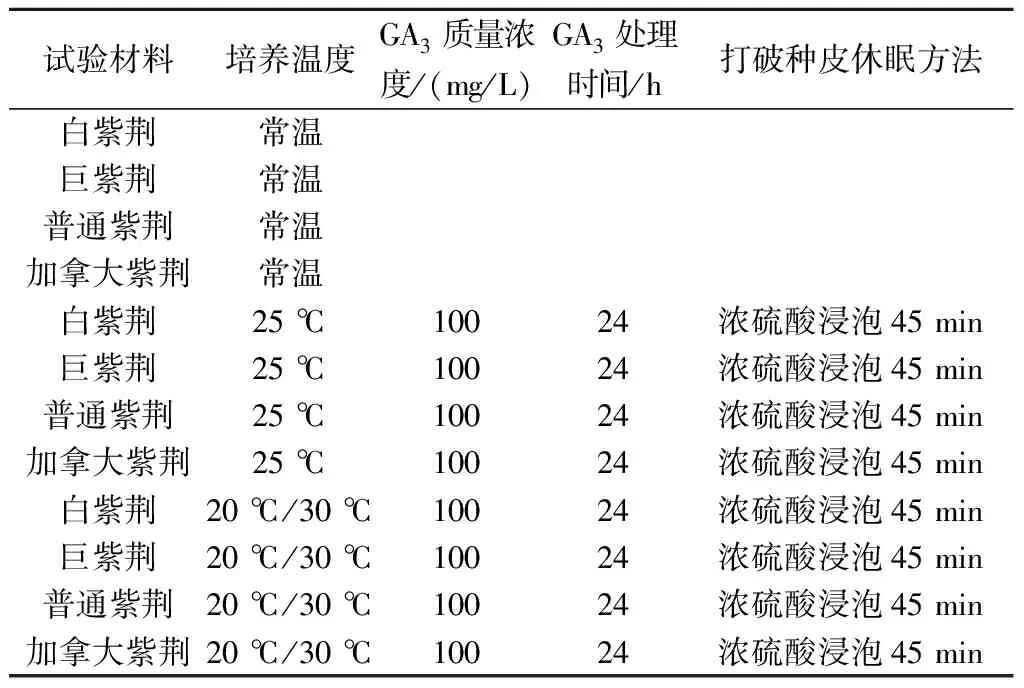
表2 温度处理试验方案

表3 种皮处理试验方案

表4 GA3浸泡时间处理试验方案
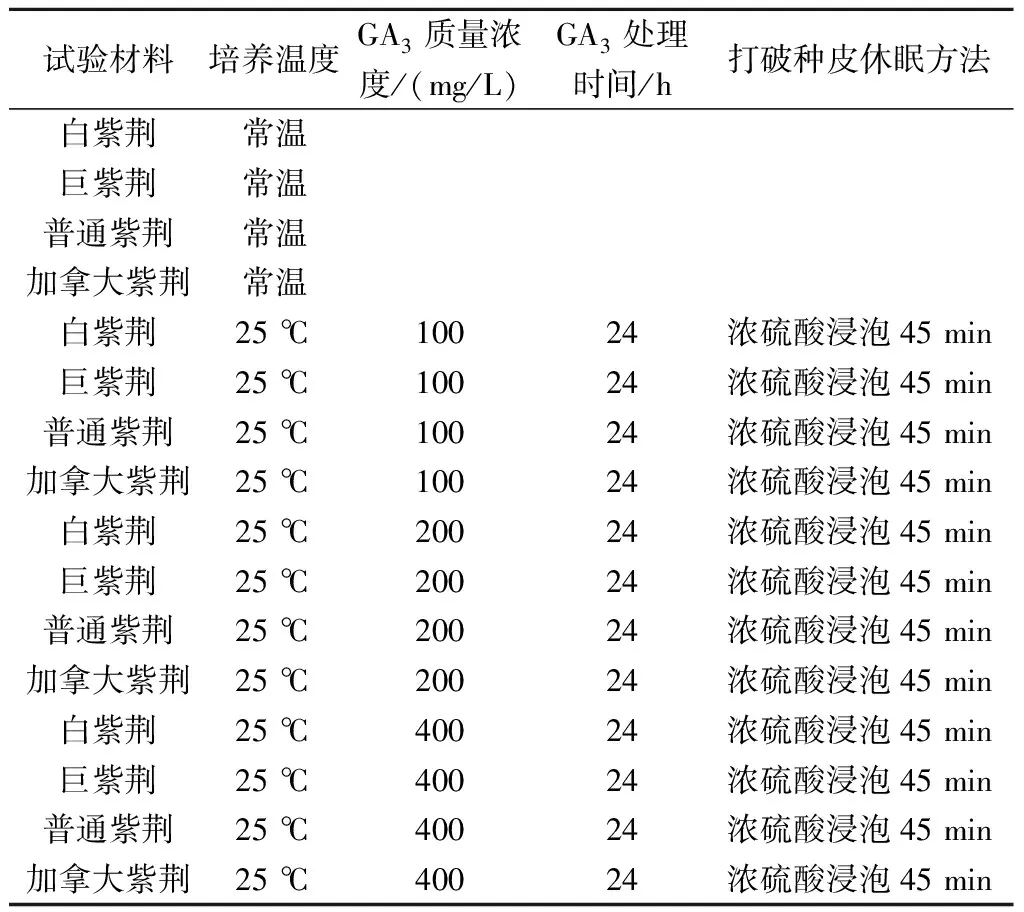
表5 GA3质量浓度处理试验方案
将处理后的种子置于内附无菌水湿润滤纸的培养皿中培养。每个处理3个重复,每个重复100粒紫荆种子,每天观察种子发芽情况,记录种子的初始发芽时间,以及7、9、11、15 d时种子发芽数。计算种子发芽率(%)、成苗率(%)、萌发速率系数。相关参数根据下面公式进行计算:
发芽率=发芽种子数/试验种子总数×100%
成苗率=子叶萌发种子数/试验种子总数×100%
萌发速率系数=∑(t×n)/∑n×100
式中:t为自试验开始时的天数;n为在t天内萌发的种子数[22]。
2 结果与分析
2.1 温度对不同品种紫荆种子萌发的影响
由图1可以看出,在其他条件一定的前提下(表2),除巨紫荆外,其余3个品种在2个温度处理条件下,种子发芽率均达到85%以上,最高达到100%,且2个温度处理差别不大,而4个品种的对照发芽率则均为0。随着子叶展出、种子成苗阶段的开始,种子成苗率远低于种子发芽率,差异最少达到50个百分点;同一品种的2个处理间种子成苗率存在明显差异,除普通紫荆外,均呈现25 ℃恒温优于20 ℃/30 ℃变温的现象。此外,温度对不同品种种子萌发的影响也存在一定差异,其中,普通紫荆、加拿大紫荆和白紫荆2种温度处理的种子发芽率均较高且相差不大,而巨紫荆2种温度处理则差异较大,种子发芽率最高才70%,25 ℃处理成苗率仅有10%,20 ℃/30 ℃变温处理条件下甚至无种子成苗。上述结果表明,在紫荆萌发过程中,温度对种子发芽的影响不明显,其主要对种子露白至子叶展出这一过程产生影响。

图1 不同温度对紫荆种子萌发的影响
2.2 不同种皮处理方式对紫荆种子萌发的影响
以加拿大紫荆为例,将经过3种方式处理后的种子,用200 mg/L GA3水溶液浸泡24 h后,置于25 ℃条件下培养15 d(表3)。试验中发现,紫荆种子在未经任何处理的条件下,不能正常萌发。通过对比3个处理结果发现,机械损伤与浓硫酸处理效果最好,种子发芽率和成苗率均高达100%;过氧化氢处理效果较差,发芽率仅为10%,无幼苗形成(图2)。进一步比较萌发速率系数(图3)可以看出,机械损伤处理明显优于浓硫酸处理。但由于紫荆种子较小、种皮较硬,普遍使用的擦伤方式对其作用不大[9],而本试验中采用的边缘种皮剪切法又过于费时。综上可知,浓硫酸处理更适合生产应用,其处理效果较佳,处理方式也较为方便。

图2 不同种皮处理方式对紫荆种子萌发的影响
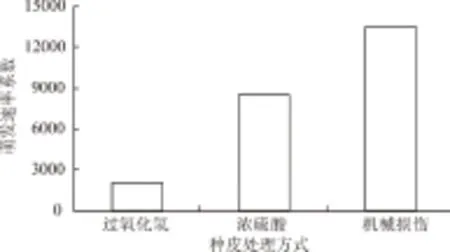
图3 不同种皮处理方式对紫荆种子萌发速率系数的影响
2.3 GA3对不同品种紫荆种子萌发的影响
紫荆种子除具有种皮休眠外,还存在内休眠[23],相关研究中,多采用GA3水溶液浸泡的方式来解除种子的内休眠[10]。在本试验中,选用GA3水溶液浸泡的方式对种子进行培养前处理,并对GA3质量浓度及处理时间进行筛选(表4、5),以期选出最佳的处理方式。试验中发现,未经GA3水溶液处理的4个品种的对照,其发芽率均为0,而经GA3水溶液处理过的种子,随着处理时间的变化其发芽率和成苗率呈现规律的变化。由图4可知,在同一质量浓度的GA3水溶液中,无论是发芽率还是成苗率,均随着浸泡时间的增长而下降,其中成苗率表现更为突出,且4个紫荆品种表现一致。这表明GA3浸泡时间过长,反而抑制种子的萌发。因此,就GA3浸泡时间而言,24 h优于48 h。此外,在种子培养过程中还发现,种子在GA3水溶液中浸泡时间越长,培养后期霉变的概率越大。综上可知,选用赤霉素浸泡24 h处理紫荆种子效果最佳。
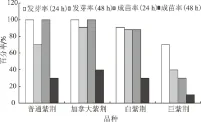
图4 不同GA3处理时间对紫荆种子萌发的影响
试验中发现,4个品种的对照发芽率均为0,而处理则以GA3200 mg/L效果最好。由图5、图6可见,GA3质量浓度为100 mg/L时,发芽率达到70%甚至以上,但成苗率却有所下降,尤以巨紫荆下降最为明显;当GA3质量浓度达到400 mg/L时,4个品种紫荆种子的发芽率,除普通紫荆和加拿大紫荆外,余下2个品种的发芽率均低于100、200 mg/L处理,而随GA3质量浓度的增高,除加拿大紫荆外,其余3个品种成苗率均在200 mg/L时达到最高。在GA3200 mg/L处理下,巨紫荆的发芽率和成苗率在4个品种中均为最低,其中成苗率仅达到40%。综上所述可知,紫荆种子在200 mg/L的GA3水溶液中浸泡24 h后再进行培养为最佳。

图5 不同质量浓度GA3对紫荆种子发芽率的影响
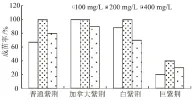
图6 不同质量浓度GA3对紫荆种子成苗率的影响
3 结论与讨论
本试验结果表明,紫荆种子最佳萌发条件为:将紫荆种子经浓硫酸酸蚀洗净后,于200 mg/L GA3水溶液中浸泡24 h,然后置于25 ℃的环境条件下进行培养,15 d后即可得到紫荆幼苗。此处理条件下,除巨紫荆外,各紫荆品种的发芽率和成苗率均达到100%,巨紫荆虽然相对较低,其发芽率和成苗率仅为70%和40%,但较相关研究[10]而言却有明显提高。对比4个品种紫荆种子的萌发结果,巨紫荆相对其他3个而言幼苗得率较低,这可能与巨紫荆种皮休眠程度较强有关[24]。有研究表明,随着种子的成熟、气孔消失,种皮表面蜡质层逐渐形成并不断加厚,阻碍种子与外界环境的水汽交换,也利于提高种子对外界不良环境的抵御能力[25]。紫荆休眠主要是因为种皮存在机械障碍以及胚乳中含有萌发抑制物所致[26-27]。Jones等[28]在研究加拿大紫荆种子休眠时发现,该种子种皮和胚乳的特殊结构都可能是导致其休眠的主要原因。扫描电镜观察发现,随着紫荆种子的逐渐成熟,种皮表面气孔消失,蜡质开始形成并逐渐加厚,种孔和种脐也逐渐开裂,种子发育成熟时,种子中间部位的种皮由外到内依次为:角质层、栅栏层和薄壁细胞层,角质层主要由蜡质及其他覆盖物组成,栅栏层则由单层紧密排列的长柱状厚壁的大石细胞构成,角质层和栅栏层的这种结构可能影响该种子种皮透性进而引起种皮休眠[29]。因此,解除紫荆种皮的这种特性对促进种子萌发起着重要作用,而不同品种打破休眠差异的具体原因尚需进一步试验分析来验证。
紫荆种子自然条件下难萌发,迄今为止紫荆种子萌发在生产上虽然间或搭配浓硫酸酸蚀或GA3浸种的方法,但仍以种子层积的方式为主。虽然试验方法不断改进,但层积促进紫荆种子萌发的时间依然较长,需30 d以上,生产应用不够简便[10]。本试验对处理后的种子不进行层积处理,而选用湿润滤纸为基质进行种子萌发培养,4个紫荆品种均得到较高的萌发率,这说明紫荆种子萌发过程中,层积处理不是必需的。试验结果显示,采用本试验的方法能大量快速地处理待萌发的紫荆种子,为生产应用提供高效的技术支持。
[1] 李仕裕,木楠,于海玲,等.广西紫荆的园林应用初探[J].黑龙江农业科学,2015(4):87-92.
[2] 张颖,张立木,李同德,等.紫荆叶与紫荆皮消炎镇痛作用比较[J].中国医院药学杂志,2011,31(1):45-47.
[3] 孙秀青.紫荆果总黄酮清除自由基作用[J].研究食品研究与开发,2015(5):70-74.
[4] 张颖,张立木,李同德,等.紫荆叶对模型小鼠的消炎镇痛及耐缺氧抗疲劳作用研究[J].中国药房,2009(36):2817-2818.
[5] 王金亭,吴广庆.杨敏一.紫荆花红色素对模型动物血糖和血脂的影响研究[J].食品工业科技,2013(13):330-332.
[6] 王燕,陈光英,陈文豪,等.洋紫荆挥发油气相色谱-质谱联用分析及抗肿瘤活性研究[J].时珍国医医药,2013(8):1830-1832.
[7] 郑荣辉,骆雪萍,钟其景,等.天然紫荆花色素制取彩色包装纸的研究[J].时珍国医国药,2005(2):37-39.
[8] 陈有民.园林树木学[M].北京:中国林业出版社,1990:464.
[9] 孙秀琴,安蒲瑷,李庆梅.紫荆种子休眠解除及促进萌发的研究[J].林业科学研究,1998,11(4):407-411.
[10] 卢芳,周瑞玲,蔡枫.GA3处理与层积时间对巨紫荆种子萌发的影响[J].安徽农业科学,2007,35(21):6419-6420.
[11] 乔永旭,张永平.黄顶菊种子的萌芽试验[J].吉林农业科学,2015,40(1):86-90,94.
[12] 邓天福,王霞.不同植物生长调节剂和温度处理对苘麻种子萌发的影响[J].河南科技学院学报(自然科学版),2015,41(1):20-24.
[13] 王艳梅,王海洋,代莉,等.不同低温处理对12个种源山桐子种子休眠解除的影响[J].山东农业大学学报(自然科学版),2015,46(1):51-56.
[14] 黄树苹,徐长城,谈杰,等.不同处理对鄂丝瓜 1 号种子萌发特性的影响[J].安徽农业科学,2015,43(2):25-27.
[15] 顾地周,禚畔全,张力凡,等.激素处理和变温层积对小花木兰种子形态后熟的影响[J].植物研究,2015,35(1):34-38.
[16] 罗登攀,刘道凤,马婧,等.蜡梅种子休眠原因浅析及赤霉素对种子萌发的影响[J].北方园艺,2015(1):83-86.
[17] 彭妮,周龙,王超,等.天山樱桃种子萌发特性研究[J].经济林研究,2015,33(3):145-149.
[18] 王英超,窦晓青,金红,等.提高紫锥菊种子发芽率方法的研究[J].天津农学院学报,2015,22(3):40-43.
[19] 贾军,韩丽君,郝向春,等.野皂荚种子催芽技术研究[J].山西林业科技,2015,44(3):15,43.
[20] 宋超,王跃华,赵钢,等.不同酸处理对苦荞种子萌发和幼苗生长的影响[J].种子,2015,33(8):79-82.
[21] 张志良.植物生理学实验指导[M].北京:高等教育出版社,1990.
[22] Bongers F P E,Popma J.Leaf dynamics of seedlings of rain forest species in relation to canopy gaps[J].Oecologia,1990,82:122-127.
[23] 美国农业部.美国木本植物种子手册[M].李霆,陈幼生,颜启传,等译.北京:中国林业出版社,1984:208-209.
[24] 廖卓毅,钱存梦,马秋月,等.乌桕种子成熟过程中种皮和胚乳超微结构观察[J].南京林业大学学报,2014,38(6):44-49.
[25] Bewley J D,Black M.Seeds:Physiology of development and germination[M].2nd edition.New York:Plenum Press,1994:36-107.
[26] Geneve R L.Seed dormancy in eastern redbud(Cerciscanadensis)[J].Journal of the American Society for Horticultural Science,1991,116(1):85-88.
[27] Li S X,Kong F M,Mao Y,etal.Methods for breaking the dormancy of eastern redbud(Cerciscanadensis) seeds[J].Seed Science and Technology,2013,41(1):27-35.
[28] Jones R O,Geneve R L.Seedcoat structure related to germination in eastern Redbud(CerciscanadensisL.)[J].America Society for Horticultural Science,1995,120(1):123-127.
[29] 周健,苏友谊,代松,等.紫荆种子成熟过程中种皮和胚乳超微结构观察[J].南京林业大学学报(自然科学版),2016,40:[2015-09-30].http://www.cnki.net/kcms/detail/32.1161.S.20150930.1510.002.html
Research on Method of Breaking Seed Dormancy inCercischinensis
MI Jianhua1,SUN Xuexia1,LOU Qiulian1,FU Zhenzhu2,ZHANG Jing2
(1.Zijingshan Park of Zhengzhou,Zhengzhou 450002,China; 2.Horticulture Research Institute,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
This study compared the difference in seed germination rate of four varieties ofCercischinensis(ordinaryCercischinensis,whiteCercischinensis,CanadianCercischinensisand giantCercischinensis),by breaking seed coat dormancy(mechanical damage,sulfuric acid or hydrogen peroxide treatment) and breaking endo-dormancy(seed soaking in 0,100,200,400 mg/L GA3) for 24 h or 48 h.The result showed that the treatments of mechanical damage and concentrated sulfuric acid could corrodeCercischinensisseed coat quickly and efficiently,and did not hurt embryo,thereby promoting seed germination.The treatment of hydrogen peroxide could corrode seed coat slightly,but had no obvious effect in breaking seed coat dormancy.After breaking the seed dormancy,the treatments of 100 mg/L GA3and 200 mg/L GA3had higher seed germination rate.The germination rates of ordinary and CanadianCercischinensisboth reached 100%,which of giantCercischinensiswas 70%.The best germination conditions ofCercischinensisseeds were that firstly pickling for 45 min by the concentrated sulfuric acid followed by washing,secondly soaking in 200 mg/L GA3for 24 h,thirdly cultivating on wet filter paper at 25 ℃ in the dark,and last cultivating under the condition of 12 h light/12 h dark for 15 d after cotyledon stretching.The germination rate and seedling rate of the giantCercischinensiswere relatively low(only 70% and 40%),but the germination rate and seedling rate of otherCercischinensiscould be as high as 100% after treated.
seeds ofCercischinensis; breaking dormancy; rapid germination
2016-07-21
米建华(1970-),女,河南民权人,高级工程师,本科,主要从事植物栽培研究及新品种引进工作。 E-mail:mijianhua1997@163.com
S793.7
A
1004-3268(2016)11-0100-05
