探究规律培养能力
——金属与酸反应的规律探究
2016-02-06向庆元
□向庆元
探究规律培养能力
——金属与酸反应的规律探究
□向庆元

近年来,涉及有关金属与酸反应的中考题,侧重于考查金属的活动性、金属的相对原子质量、氢气的质量(或体积)等数量关系以及金属中杂质的判断等问题,有时还与图象、天平平衡等问题相结合.下面分类举例说明.
类型一、质量比较型
例1Wg铁与足量的稀硫酸充分反应产生ag氢气,Wg锌与足量的稀盐酸充分反应产生bg氢气,则a与b的关系是().
A.a>bB.a<b
C.a=bD.无法比较
解析:相同质量的铁和锌与足量的稀酸反应时,金属完全反应且反应后它们的化合价相同,均为+2价.生成氢气的质量与金属的相对原子质量有关,金属的相对原子质量越大,生成的氢气质量越小.铁的相对原子质量小于锌,故选A.
【针对练习】将一定质量的镁和锌放入相同质量相同浓度的稀硫酸中,充分反应后金属均有剩余.则产生氢气的质量().
A.镁产生氢气多
B.锌产生氢气多
C.两种金属产生氢气一样多
D.无法判断
答案:C
规律技巧:涉及金属与酸反应的量有:金属的质量;金属元素在反应后显示的化合价;金属的相对原子质量;金属的活动性;产生氢气的量;产生氢气的时间;酸的量.这些量之间存在如下关系:(1)当金属的化合价相同时,对于相同质量的金属与足量的稀酸反应,金属的相对原子质量越大,生成的氢气越少;(2)等质量的同种金属分别与不同的酸反应(酸足量),产生氢气质量相等.
类型二、成分判断型
例2某校研究性学习小组的同学为了对Cu-Zn合金、Fe-Cu合金、Fe-Zn合金、Fe-Al合金进行研究,他们取其中一种合金的粉末5.6g,与足量的稀硫酸充分反应,经测定,产生了0.38g气体.则该合金可能是().
A.Cu-Zn合金
B.Fe-Cu合金
C.Fe-Zn合金
D.Fe-Al合金
解析:根据金属活动性顺序,Cu与稀硫酸不反应,Zn、Fe、Al都能与稀硫酸反应生成氢气.分别计算出5.6gZn、Fe、Al与足量的稀硫酸充分反应产生氢气质量为0.17g,0.2g,0.62g,经分析可以得出合金与酸反应后所得氢气质量的取值范围,进而得解.A.5.6gCu-Zn合金与足量的稀硫酸充分反应,产生氢气的质量只能小于0.17g,故A错误;B. 5.6gFe-Cu合金与足量的稀硫酸充分反应,产生氢气的质量只能小于0.2g,故B错误;C.5.6gFe-Zn合金与足量的稀硫酸充分反应,产生氢气的质量只能大于0.17g小于0.2g,故C错误;D.5.6gFe-Al合金与足量的稀硫酸充分反应,产生氢气的质量只能大于0.2g小于0.62g,0.38g在此范围内,故D符合题意.故选D.
【针对练习】某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是().
A.ZnB.Cu
C.MgD.Ag
答案:C
规律技巧:根据金属与酸反应所得氢气质量判断金属的组成,可以先将不纯的金属样品看作“纯金属”,计算出产生氢气的理论值M,将实际产生氢气的质量M′和M相比较.(1)M′>M,所含杂质和酸能反应放出氢气,且该金属与氢气的质量比要比主要成分金属与氢气的质量比偏小;(2)M′<M,所含杂质有三种可能:和酸不能反应;和酸反应不产生氢气;和酸反应放出氢气,但质量比偏大;(3)M′=M,所含杂质至少有两种,兼有(1)(2)两种情况.
类型三、天平平衡型
例3在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入完全相同的足量稀盐酸,然后分别向左右两烧杯中加入质量相等的铁和金属A,此时,两烧杯中都有气体产生,反应过程中天平指针慢慢向左偏转(如图1);指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入的金属A可能是().

图1

图2
A.ZnB.Mg C.CuD.Al
解析:根据质量相等的铁和金属A加入完全相同的足量稀盐酸,反应过程中天平指针慢慢向左偏转,可判断金属A反应与盐酸反应放出氢气速率大于金属铁即金属A的活动性比铁强;根据金属活动性顺序镁>铝>锌>铁>铜,可知锌、镁、铝都符合这一要求.反应结束后,天平指针指向右端,可判断等质量金属A完全反应放出氢气质量小于金属铁,4种等质量金属完全反应放出氢气的质量由多到少的顺序为铝>镁>铁>锌,则只有金属锌符合这一要求.故选A.
【针对练习】在托盘天平两端各放一只烧杯,调节至平衡.在两只烧杯里各加入等质量、等质量分数的稀盐酸,然后向左右两烧杯中分别放入质量相等的镁和铝,待充分反应后,镁有剩余,则还可以观察到的现象是().
①天平保持平衡;②铝也有剩余;③天平指针偏向放镁的一方;④天平指针偏向放铝的一方.
A.只有①B.①和②C.②和④D.只有③
答案:B
规律技巧:本题可利用类型一的方法判断产生氢气多少.根据“天平两端净增质量相等,天平才能保持平衡”,否则,天平指针最终将偏向净增质量较多的一端.
类型四、图象分析型
例4两个烧杯中装有等质量的金属锌和镁,然后分别逐渐加入同浓度的稀硫酸,产生氢气的质量与加入硫酸的质量关系如图3所示.下列说法正确的是().
A.该图反映出镁比锌的金属活动性强
B.a点时,两个烧杯中的酸都恰好完全反应
C.b点时,两个烧杯中产生氢气的质量相等
D.c点时,两个烧杯中都有金属剩余
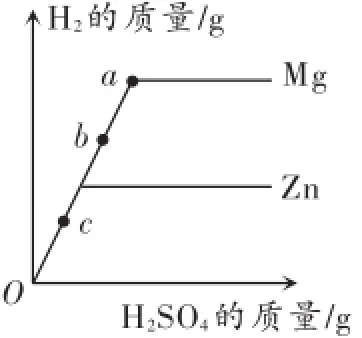
图3
解析:根据镁和锌金属活动性比氢强,均能与稀硫酸反应,等质量的金属锌和镁,分别逐渐加入同浓度的稀硫酸,由生成氢气的质量与加入硫酸的质量关系图,最终镁产生的氢气质量多做出判断.A.由产生氢气的质量与加入硫酸的质量关系图,镁产生的氢气质量多,但无法得出镁和锌的金属活动性关系,故该说法错误;B.a点时,镁和稀硫酸恰好完全反应,锌早已完全反应,故该说法错误;C.b点时,镁产生的氢气多,锌产生的氢气少,故该说法错误;D.c点时,镁和锌均没有完全反应,两个烧杯中都有金属剩余,故该说法正确.故答案为D.
【针对练习】将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图4所示,下列说法错误的是().
A.反应结束后镁一定有剩余
B.反应消耗盐酸的总质量一定相等
C.0-t1时段,产生氢气的质量镁比铁大
D.0-t2时段,参加反应的镁的质量与铁相等

图4
答案:D
规律技巧:分析图象时要做到“五看”,即看坐标、看比例、看起点、看终点、看转折点,将图象表示意义与化学知识结合起来,从而理解图象题的真正意义.一般的判断规律有:(1)金属越活泼,图示反应的曲线越陡;(2)当金属的化合价相同时,金属的相对原子质量越小,与酸反应产生的氢气越多,曲线的拐点越高.可简单概括为:越陡越活,越高越小;(3)不等价金属与酸完全反应用金属和氢气质量比来判断氢气的多少(质量比越大,生成氢气越少,反之生成氢气越多).
总之,我们通过探究得出解决问题的一般规律,不仅可以帮助我们快速解答问题,更重要的是可以使我们各方面的能力得到提高.
