硫氢化钠致大鼠肺损伤现象的观察及对活性氧的影响
2016-02-06胡学远范宏刚
张 帅 , 李 蓓 , 胡学远 , 范宏刚
(东北农业大学动物医学学院, 黑龙江哈尔滨150030)
硫氢化钠致大鼠肺损伤现象的观察及对活性氧的影响
张 帅 , 李 蓓 , 胡学远 , 范宏刚
(东北农业大学动物医学学院, 黑龙江哈尔滨150030)
为了研究常用剂量的硫氢化钠(NaHS)致大鼠肺脏损伤程度以及与对活性氧(ROS)的影响,将96只SD大鼠随机分为4组。各组大鼠分别腹腔注射生理盐水、1 mg/kg体重NaHS、3 mg/kg体重NaHS、5 mg/kg体重NaHS后,于2、6、12 h和24 h 4个时间点分批处死,各组每个时间点处死6只大鼠。结果显示,3个剂量的试验组肺脏中的ROS含量均有升高,其中3 mg/kg体重和5 mg/kg体重NaHS能够引起严重的肺损伤,1 mg/kg体重NaHS对肺的影响较小。本试验表明NaHS所致的肺脏损伤与ROS的产生有关,NaHS干预肺脏相关的试验的安全剂量应低于1 mg/kg体重。
硫氢化钠 ; 肺 ; 活性氧
硫化氢(H2S)已成为继NO和CO之后的第3类气体信号分子,其在机体内可以参与多种生理过程[1]。研究证实,H2S在抗氧化应激[2]、清除自由基及抑制细胞凋亡等方面具有一定的功效[3]。硫氢化钠(NaHS)作为一种外源性H2S的供体已经广泛应用于相关研究当中。在机体内,NaHS与H2S可以相互转化,两者以一种动态平衡状态存在。NaHS能够解离为Na+和HS-,HS-又与H+结合产生H2S[4]。但究其本质,H2S仍是一种有毒的气体。在机体内高浓度的H2S能够抑制细胞色素氧化酶活性,通过与细胞色素C氧化酶中的Fe3+结合,阻碍其还原为含Fe2+的还原型细胞色素C氧化酶,从而阻断呼吸链的电子传递和分子氧的利用,提高线粒体中活性氧(ROS)助氧化剂的水平,进而引起脑、肺、心、肝等重要脏器的代谢障碍及病理性损伤。因此,NaHS的毒性作用可能与ROS的产生水平有关。
肺脏因其特殊的肺泡结构和气体交换功能,使之易于受到ROS的氧化应激的损伤[5-6]。然而,关于ROS在NaHS致大鼠肺脏中的毒性作用,国内外未见报道。本文就试验常用剂量的NaHS致大鼠肺脏损伤程度以及与对ROS的影响进行研究,以期为临床及肺脏相关试验研究筛选一个相对安全的NaHS剂量范围。
1 材料与方法
1.1 试验模型的建立 选择由哈尔滨医科大学实验动物中心提供的健康SD大鼠96只,体重(225±25)g,试验前适应性饲养7 d,自由饮水和采食,保持良好的饲养环境。96只大鼠随机分为4组,每组24只,并分别进行以下处理:对照组(等体积的生理盐水,腹腔注射)、NaHS I组(NaHS 1 mg/kg体重,腹腔注射)、NaHS II组(NaHS 3 mg/kg体重,腹腔注射)、NaHS III组(NaHS 5 mg/kg体重,腹腔注射),各组大鼠分别于注射NaHS后2、6、12 h和24 h四个时间点颈椎脱臼分批处死,每个时间点处死6只大鼠,冰上取肺脏组织备用。
1.2 试验方法 (1)用购自南京建成生物工程研究所的ROS试剂盒测定大鼠肺脏内ROS浓度;(2)大鼠肺脏组织按常规切片及H.E.染色步骤处理;(3)取新鲜大鼠肺脏,表面吸干水分后称重(湿重,W),置于烤箱中烘烤至恒重(干重,D),测定大鼠肺脏的干湿重比(W/D):肺组织湿干重比(W/D)=湿重(W)/干重(D)。
2 结果与分析
2.1 肺脏组织干湿重比(W/D)测定结果 从图1中可以看出,同一时间点各组间比较,在2 h时,NaHS II组和NaHS III组的W/D值与对照组相比,差异极显著(P<0.01);在6 h时,NaHS II组的W/D值最低,明显低于对照组和NaHS I组,且差异极显著(P<0.01);在12 h时,NaHS III组的W/D值最低,明显低于其他三组,且差异极显著(P<0.01);在24 h时,NaHS II组和NaHS III组与对照组相比,W/D值较低,且差异极显著(P<0.01),而NaHS I组的W/D值基本与对照组相同,差异不显著(P>0.05),无统计学意义。
2.2 肺脏组织病理学变化结果 同一时间点各组间相比,对照组(见中插彩版图2)大鼠的肺泡结构完整、清晰,肺泡间隔没有肿胀现象;NaHS I组(见中插彩版图3)大鼠的肺泡结构略有破坏,肺泡腔内可观察到少量渗出物,并有炎性细胞浸润,肺泡间隔与对照组相比有一定的肿胀;NaHS II组(见中插彩版图4)以及NaHS III组(见中插彩版图5)大鼠的肺泡结构明显破坏,肺泡间隔与对照组和NaHS I组相比明显增厚,并且有大量的炎性细胞浸润及红细胞渗出。并且,在NaHS II组和NaHS III组的大鼠肺脏组织中还可观察到细支气管的黏膜皱襞破损。相比之下,NaHS III组肺脏病变程度较NaHS II组的更加严重。2.3 ROS浓度测定结果 同一时间点各组间比较,在2 h时,NaHS I组的ROS含量与对照组相比,差异显著(P<0.05),NaHS II组和NaHS III组的ROS含量与对照组相比,差异极显著(P<0.01);在6 h时,NaHS I组和NaHS III组的ROS含量与对照组相比,差异极显著(P<0.01),NaHS II组的ROS含量与对照组相比,差异显著(P<0.05);在12 h,NaHS I组ROS含量最高,差异极显著(P<0.01),NaHS II组和对照组相比,差异不显著(P>0.05),无统计学意义;在24 h,NaHS III组的ROS含量明显高于其他3组,差异极显著(P<0.01),NaHS I组ROS含量基本恢复到正常水平,与对照组差异(P>0.05)不显著,无统计学意义。
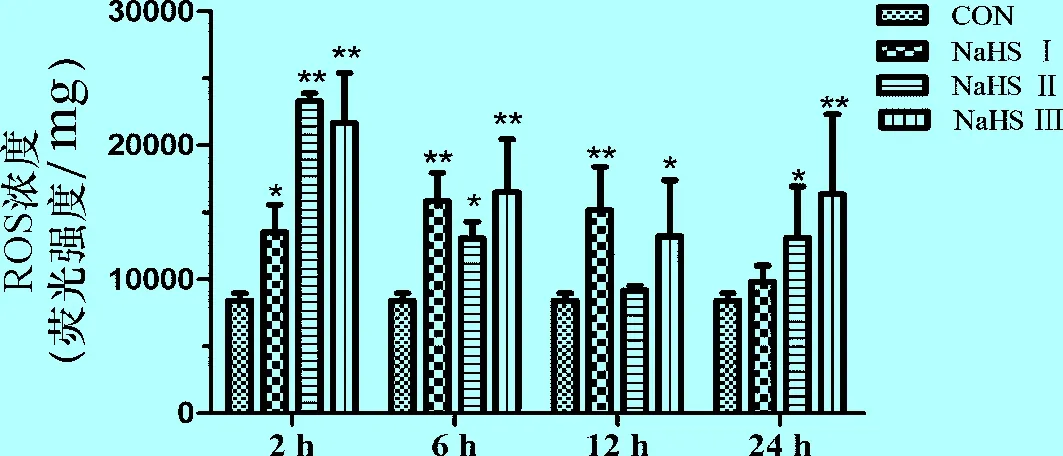
图6 肺脏组织活性氧(ROS)浓度变化
3 讨论
从肺脏病理切片结果来看,NaHS II组和NaHS III组的病理变化明显,这与肺脏干湿重比结果相符,说明肺脏的病理变化与肺水肿有一定相关性。NaHS II组,在12时和24时,能看到炎性细胞浸润和红细胞渗出,而且肺泡结构破坏,肺泡壁肿胀,在3 mg/kg体重的注射剂量下,大鼠肺脏的W/D值与对照组相比存在显著差异。NaHS III组的肺脏组织切片在各个时间点均表现出严重的病变,出现细支气管黏膜皱襞破裂,肺泡壁肿胀甚至破裂,炎性细胞浸润,血管肿胀等病理变化,说明5 mg/kg体重的NaHS对大鼠的肺脏存在严重的损伤作用,而且NaHS III组的W/D值与对照组相比存在显著差异,均低于对照组的W/D值,说明NaHS以3 mg/kg体重和5 mg/kg体重的浓度注入机体后,不仅会引起肺水肿,还会引起肺炎的相关病理变化。张俊等通过肺脏干湿比和肺脏病理组织切片来进行肺损伤的程度评定[7],所以本试验组选用这两个指标来判定NaHS对肺脏是否造成损伤。综合以上两个试验,可以得出,不同浓度的NaHS会造成不同程度的肺损伤。
从ROS浓度的结果中可以看出, NaHS III组肺脏组织中的ROS含量基本都维持在一个较高水平,这与肺脏干湿比结果和肺脏病理切片结果基本保持一致,说明在5 mg/kg体重的注射剂量下,NaHS III组能使ROS的含量升高。此外,研究发现体内ROS升高与细胞色素氧化酶的活性受到抑制有关[8]。有学者认为,细胞色素氧化酶活性能够因为缺氧及代谢障碍而降低,导致线粒体呼吸链中还原性中间体积聚在电子传递链中上游,从而引起整条电子传递链中缺失还原性中间体电子[9],进而导致细胞内ROS升高。而大量的ROS可引起细胞毒性作用,从而造成机体产生氧化应激反应。所以,高剂量NaHS组的ROS水平高,可能是由于其造成呼吸链的损伤所导致[8]。而需氧量高的组织如心脏及含氧量高的组织如肺脏,对H2S影响氧化代谢的敏感性更高[10]。当细胞色素氧化酶活性降低时,细胞活性氧(ROS)等助氧化剂生成增多,对于肺脏这种含氧量高的组织来说,ROS可以导致非常严重的肺损伤。但是,NaHS II组和NaHS III组的ROS水平在2、6、12时呈现出逐渐下降的趋势,在24时却呈现出上升趋势,这可能是由于在2 h至12 h期间,H2S逐渐被机体所代谢,因此对细胞色素氧化酶的抑制作用逐渐减弱。但是随着时间的推移,H2S对线粒体的损伤逐渐加重,所以使ROS的水平在24 h时呈现一个升高的趋势。在NaHS I组,虽然能观察到ROS水平有一定程度的升高,但是肺脏干湿比和病理切片结果都显示肺脏组织没有非常明显的损伤。这可能是由于NaHS注入机体后,与细胞色素氧化酶中的Fe3+结合,有效的抑制线粒体呼吸,导致ROS水平升高。但所生成的ROS浓度较低并没有造成严重的肺损伤,机体完全可以代偿,肺脏组织没有明显病变。
综合本试验所有结果可以得出,3 mg/kg体重NaHS和5 mg/kg体重NaHS腹腔注射能够对大鼠肺脏产生明显的损伤作用,并且肺脏损伤程度与ROS浓度存在一定的相关性,而1 mg/kg体重组对大鼠的肺脏没有明显的损伤作用。因此,本试验组认为NaHS所致的肺脏损伤与ROS的产生有关。NaHS干预肺脏相关的试验的安全剂量应低于1 mg/kg体重。
4 结论
3 mg/kg体重NaHS和5 mg/kg体重NaHS腹腔注射能够引起明显的肺脏损伤,并且肺损伤程度与ROS浓度存在一定的相关性,而1 mg/kg体重NaHS对大鼠肺脏没有造成明显损伤。因此,推荐NaHS干预肺脏相关的试验的安全剂量应低于1 mg/kg体重。
[1] Kilburn K H.Neurobehavioral impairment and seizures from formaldehyde [J].Archives of Environmental Health,1994,49(1):37-44.
[2] Esechie A,Kiss L,Olah G,etal.Protective effect of hydrogen sulfide in a murine model of acute lung injury induced by combined burn and smoke inhalation [J].Clinical Science,2008,115(3):91-97.
[3] 杜津.硫化氢后处理对大鼠肝缺血再灌注损伤的保护作用 [D].天津:天津医科大学,2012.
[4] Caro A A,Thompson S,Tackett J.Increased oxidative stress and cytotoxicity by hydrogen sulfide in HepG2 cells overexpressing cytochrome P450 2E1 [J].Cell Biology and Toxicol,2011,27(6):439-453.
[5] Bast A,Haenen G R,Doelman C J.Oxidants and antioxidants:state of the art [J].The American Journal of Medicine,1991,91(3C):2S-13S.
[6] Repine J E,Bast A,Lankhorst I.Oxidative stress in chronic obstructive pulmonary disease.Oxidative Stress Study Group [J].American Journal of Respiratory and Critical Care Medicine,1997,156(2 Pt 1):341-357.
[7] 张俊.自噬在肺缺血再灌注损伤中的作用及其机制研究 [D].武汉:华中科技大学,2013.
[8] Fontanesi F,Soto I C,Horn D,etal.Assembly of mitochondrial cytochrome c-oxidase,a complicated and highly regulated cellular process [J].American Journal of Physiology Cell Physiology,2006,291(6):1129-1147.
[9] Cooper C E,Davies N A.Effects of nitric oxide and peroxynitrite on the cytochrome oxidase K(m) for oxygen:implications for mitochondrial pathology [J].Biochimica Et Biophysica Acta,2000,1459(2-3):390-396.
[10] Guo W,Kan J T,Cheng Z Y,etal.Hydrogen sulfide as an endogenous modulator in mitochondria and mitochondria dysfunction [J].Oxidative Medicine and Cellular Longevity,2012,2012(6):878052.
Observation of lung injury induced by sodium hydrogen sulfide in rats and its effect on the reactive oxygen species
ZHANG Shuai , LI Bei , HU Xue-yuan , FAN Hong-gang
(College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
To study the effect of sodium hydrogen (NaHS) on lung injury and reactive oxygen species (ROS),96 SD rats were randomly divided into 4 groups.Rats in 4 groups were given intraperitoneal injection by normal saline,1mg/kg,3mg/kg,and 5mg/kg NaHS respectively.Rats in each group were sacrificed at 2 h,6 h,12 h and 24 h and 6 rats in each group were executed at each time point.The results showed that 1mg/kg,3mg/kg,and 5mg/kg NaHS increase the production of ROS in the lung.NaHS at 5mg/kg and 3mg/kg caused severe lung injury.However,1mg/kg NaHS had little effect on the lung.The study shows that lung injury caused by NaHS is related to the production of ROS,and the safe dose of NaHS in the lung should be less than 1mg/kg.
Sodium hydrogen sulfide; lung; Reactive Oxygen Species
FAN Hong-gang
2016-05-26
黑龙江省博士后科研启动金项目(LBH-Q14018);东农学者计划“学术骨干”项目(15XG18)
张帅(1990-),男,硕士生,从事动物麻醉与镇痛工作,E-mail:835365791@qq.com
范宏刚,E-mail:fanhonggang2002@163.com
S857.1
A
0529-6005(2016)12-0084-03
