基于MPA包覆的Mn掺杂ZnS量子点/米托蒽醌复合体系对DNA的检测
2016-02-05司芳瑞苗艳明杨茂青闫桂琴
司芳瑞, 苗艳明, 杨茂青, 闫桂琴
(山西师范大学 生命科学院, 山西 临汾 041000)
基于MPA包覆的Mn掺杂ZnS量子点/米托蒽醌复合体系对DNA的检测
司芳瑞, 苗艳明*, 杨茂青, 闫桂琴*
(山西师范大学 生命科学院, 山西 临汾 041000)
利用3-羟基丙酸(MPA)包覆的Mn掺杂ZnS量子点与盐酸米托蒽醌(MTX)构建了一种可简单测定DNA的磷光复合体系。该体系以MTX作为良好的电子受体,通过光诱导电子转移(PIET)原理猝灭Mn掺杂ZnS量子点的室温磷光(RTP)。当体系中加入DNA后,DNA通过静电和嵌插作用与MTX结合,形成更稳定的复合物,并使MTX从Mn掺杂ZnS量子点表面脱离,Mn掺杂ZnS量子点的RTP恢复,从而实现了对DNA的痕量检测。该体系检测DNA的线性范围为0.1~20 mg·L-1,检出限为0.07 mg·L-1。该方法可有效避免其他共存物质的干扰并可应用于实际生物样品中DNA含量的快捷测定。
量子点; 室温磷光; 检测; DNA; 盐酸米托蒽醌
1 引 言
量子点又称为半导体纳米晶体,因其优良的光学性能和电学性质而被广泛应用于生物、食品、医学等研究领域[1-5]。相较于传统的有机染料,量子点具有激发和发射光谱窄而对称、光稳定性好、发光效率高等优点[6-7],更适合于各种生物分子的光学检测。在以往的研究中,大量的分析主要集中于量子点的荧光性质,而对量子点的磷光性质关注较少。近年来,量子点的室温磷光 (RTP) 性质在分析化学领域引起许多学者的关注[8-18]。磷光源于三线态,寿命较荧光更长,从而可以更有效地避免生物体液中背景荧光和散射光的干扰[19]。磷光较荧光更为少见,因此可增强检测过程的选择性[20-21]。此外,采用室温磷光分析检测无需除氧剂和诱导剂的使用,可有效地简化分析程序。磷光量子点更优越的性能赋予了其在复杂化学和生物基质检测中更多的优势及应用前景。
脱氧核糖核酸(DNA)是生命体的基本遗传物质,也是生物遗传信息的主要载体,在生物的许多生命活动中均发挥着重要作用[22]。鉴于DNA重要的作用和功能,DNA的定量分析与特异性识别已成为基因组学、病毒学、分子生物学等领域研究的焦点之一[23]。目前关于DNA检测的方法虽已广见报道[24-26],然而实现DNA灵敏检测依然是众多研究者致力的方向。筛选和构建DNA有效识别体是实现DNA简单、灵敏检测的有效手段。
盐酸米托蒽醌(Mitoxantrone,MTX)作为一种典型蒽环类抗癌药物,对人类的多种恶性肿瘤疾病有较好的临床效果[27]。MTX可有效嵌入DNA分子结构中并与碱基对结合形成交叉键联[28-29],从而抑制癌细胞DNA的构建并导致癌细胞死亡,因此MTX本身可作为DNA的一种特异性识别体。
本研究基于Mn掺杂ZnS量子点优越的室温磷光性能及MTX对DNA的特异识别功能构建了一种简单检测DNA的RTP探针,能够有效避免来自生物体液中背景荧光和散射光的干扰,无需化学修饰和固定化过程,并可用于实际样品的分析。
2 实 验
图1所示为Mn掺杂ZnS量子点/盐酸米托蒽醌纳米复合物对DNA的检测原理图。MTX作为猝灭剂通过PIET过程猝灭Mn掺杂ZnS量子点的RTP。当体系中加入DNA后,DNA能通过嵌插和静电作用竞争结合MTX,并使MTX从Mn掺杂ZnS量子点表面脱离,Mn掺杂ZnS量子点的RTP恢复。

图1 (a) Mn掺杂ZnS量子点/盐酸米托蒽醌纳米复合物对DNA的检测原理图;(b) MPA包覆的Mn掺杂ZnS量子点的结构;(c) 盐酸米托蒽醌的结构。
Fig.1 (a) Schematic illustration of Mn-doped ZnS QDs/MTX nanohybrids for DNA detection. (b) Structure of MPA-capped ZnS∶Mn QDs. (c) Structure of MTX.
2.1 材料与仪器
3-羟基丙酸(3-mercaptopropionic acid,MPA)、乙酸锌(Zn(Ac)2·2H2O)、乙酸锰(Mn(Ac)2·2H2O)和硫化钠(Na2S·9H2O)分别购于百灵威科技有限公司、天津市科密欧化学试剂有限公司;鲑鱼精子DNA(hsDNA)购于Sigma公司(美国);盐酸米托蒽醌(Mitoxantrone Hcl,MTX)购于中国医药集团;其他所用试剂均为分析纯。实验所用高纯水(18.2 MΩ/cm)采用WaterPro纯化水系统(Labconco公司,美国)制备。
2.2 仪器
量子点的外观形貌通过JEM-2100透射电子显微镜(日本电子,日本)表征,Mn掺杂ZnS量子点/MTX纳米复合物的形态通过JSM-7500F扫描电子显微镜(日本电子,日本)表征。pH值由pH计(上海雷磁,中国)测定。磷光光谱采用Cary Eclipse 荧光分光光度计(瓦连有限公司,美国)进行测定。共振光散射(Resonance light scattering,RLS)信号在Cary Eclipse荧光分光光度计(瓦连有限公司,美国)上测定,(Δλ=0),扫描波长为200~700 nm。紫外吸收光谱通过UV-29100 UV/Vis(日本岛津,日本)紫外分光光度计进行测定。
2.3 Mn掺杂ZnS量子点的合成
MPA包覆的Mn掺杂ZnS量子点参照文献[30-31]制备:室温下于100 mL三口烧瓶中,依次加入0.04 mol·L-1的MPA的水溶液50 mL、0.1 mol·L-1的Zn(Ac)2水溶液5 mL、0.01 mol·L-1的Mn(Ac)2水溶液2 mL。用1 mol/L的NaOH溶液调节上述混合溶液的pH值至11.0。在氩气氛围中磁力搅拌反应30 min后,向溶液中加入0.1 mol·L-1的硫化钠溶液5 mL,继续于氩气保护下搅拌反应20 min,再于空气氛围中50 ℃陈化2 h。冷却后,加入等体积无水乙醇,醇析、离心,沉淀于室温下真空干燥24 h,即得预制备的量子点。
2.4 室温磷光检测
首先配制0.1 mmol·L-1的MTX水溶液和2 mg·mL-1的MPA包裹的Mn掺杂ZnS量子点水溶液。在一系列10 mL的比色管中,依次加入250 μL的磷酸盐缓冲液(PBS,pH 7.4,20 mmol·L-1)、50 μL的量子点溶液和不同体积的MTX溶液,用高纯水定容至5 mL,摇匀,静置5 min后进行磷光光谱分析。激发波长为295 nm,扫描范围为500~700 nm。
检测DNA时,首先将DNA与PBS溶液(20 mmol·L-1,pH=7.4)混合溶解并制备100 mg·L-1的DNA母液。然后,将50 μL的MPA包覆的Mn掺杂ZnS量子点、4.0 μmol·L-1的MTX溶液以及不同浓度的DNA溶液加入到系列比色管中,摇匀,静置5 min后进行磷光光谱分析,检测条件同上。
2.5 实际样品的制备
血清和尿液样品均源于健康志愿者,使用前稀释100倍,无需其他复杂的预处理。
3 结果与讨论
3.1 MPA包裹的ZnS∶Mn量子点的表征
图2(a)为MPA包裹的ZnS∶Mn量子点样品的透射电镜照片,从中可以看出,所合成的量子点尺寸较为均一,粒径约为3.5 nm。图2(b)为MPA包裹的ZnS∶Mn量子点样品的X射线衍射图谱,谱中呈现3个明显的衍射峰,分别对应于立方型闪锌矿结构的(110)、(220)和(311)晶面,说明所合成的ZnS∶Mn量子点具有典型立方型结构。图2(c)为MPA包裹的ZnS∶Mn量子点样品的激发和发射光谱。 合成的量子点的最强激发峰位于295 nm处,而最强发射峰位于590 nm处。590 nm处的发射峰为Mn2+∶4Tl-6Al的跃迁产生[30]。
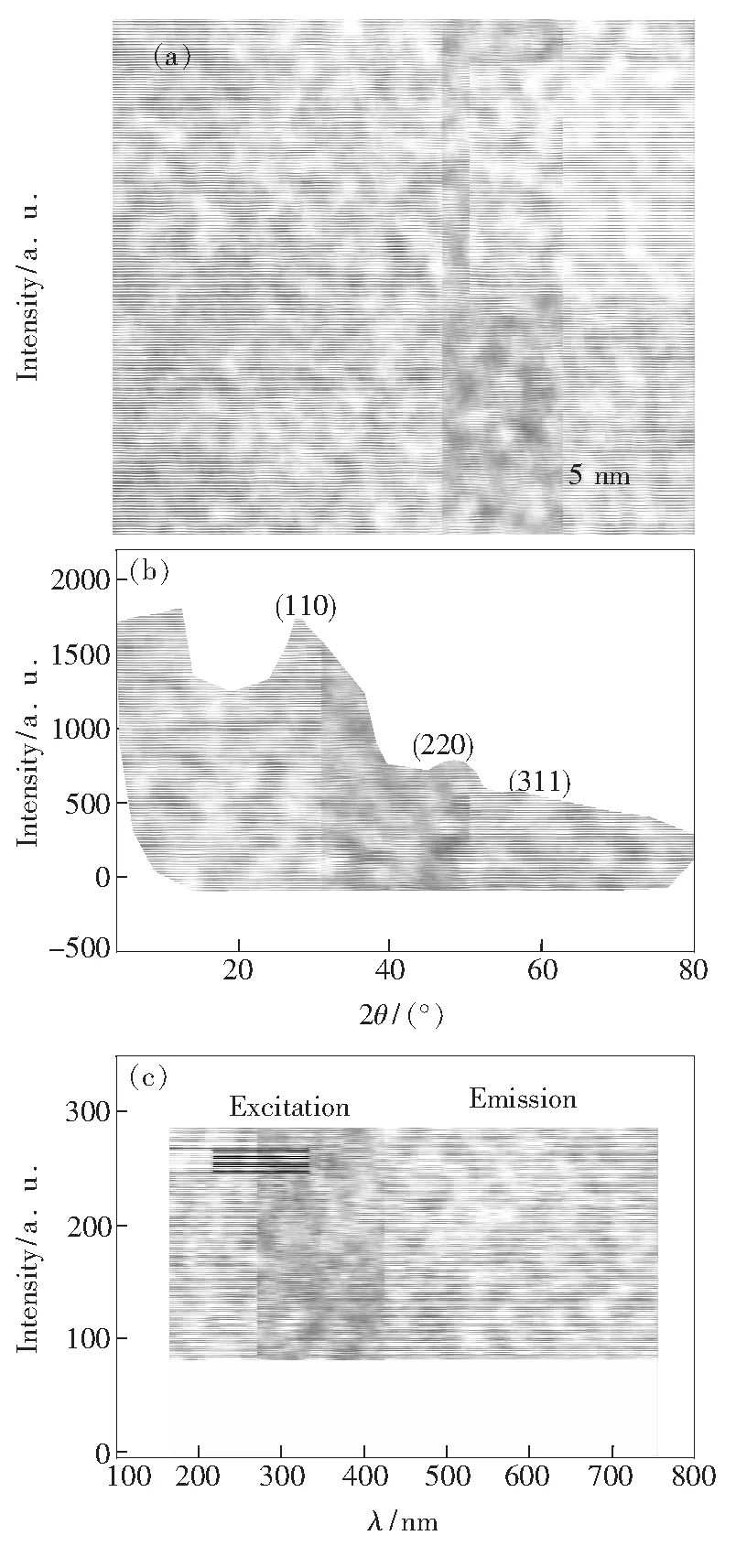
图2 MPA包裹的ZnS∶Mn量子点样品的透射电镜照片(a)、X-射线衍射图谱(b)以及激发和发射光谱(c)。
Fig.2 TEM image (a), XRD patterns (b), and excitation and emission spectra (c) of MPA-capped ZnS∶Mn QDs, respectively.
3.2 ZnS∶Mn量子点/MTX纳米复合体系的形成
为考察利用MPA包覆的ZnS∶Mn量子点与MTX构建复合体系的可行性,我们首先分析了MTX对 ZnS∶Mn量子点室温磷光强度的影响。 如图3所示,MPA包覆的ZnS∶Mn量子点溶液中加入MTX后,体系RTP发生明显猝灭,且RTP猝灭强度与MTX呈现明显的剂量效应关系(图3内嵌图)。在MTX浓度达到6 μmol·L-1后,ZnS∶Mn量子点的RTP强度不再明显变化。
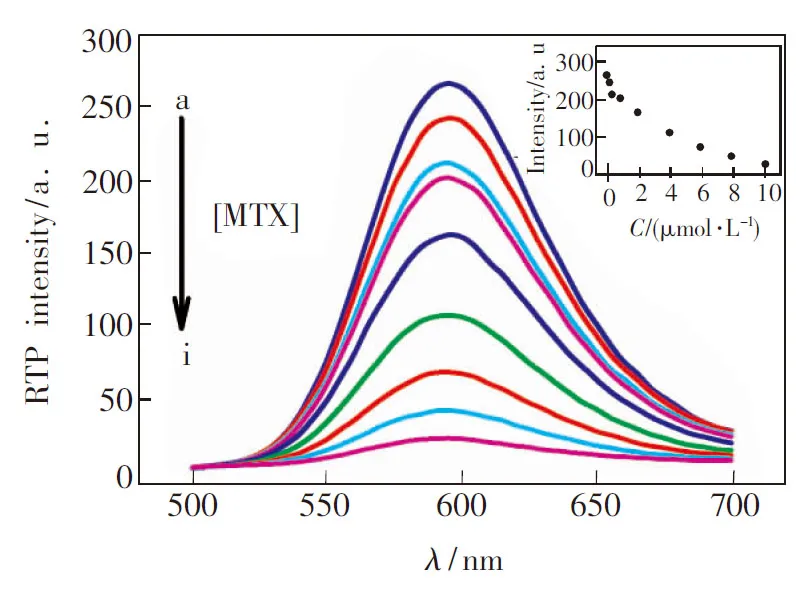
图3 MTX对MPA包覆的ZnS∶Mn量子点室温磷光发射光谱的影响,内嵌图为MPA包覆的ZnS∶Mn量子点的RTP强度随浓度的变化曲线。 MPA包覆的ZnS∶Mn量子点的浓度为20 mg·L-1,MTX浓度(a~i)依次为0,0.2,0.4,0.8,2,4,6,8,10 μmol·L-1。
Fig.3 RTP emission spectra of MPA-capped ZnS∶Mn QDs in the presence of different concentrations of MTX. The inset shows the change of RTP intensity with the increase of the concentration of MTX. The concentration of MPA-capped ZnS∶Mn QDs is 20 mg·L-1. The concentration of MTX (from a to i) is 0, 0.2, 0.4, 0.8, 2, 4, 6, 8, 10 μmol·L-1.
ZnS∶Mn量子点经MPA包覆后在水溶液中呈明显的负电性,而MTX在弱碱性溶液中带正电,因此,二者易通过静电作用而相互结合,形成ZnS∶Mn量子点/MTX纳米复合物。 MTX是一种良好的电子受体,能通过PIET过程猝灭ZnS∶Mn量子点的RTP。
3.3 ZnS∶Mn量子点/MTX复合体系的稳定性
基于以上结果,我们进一步对影响体系稳定性的因素进行了优化。通过溶液pH值对体系稳定性的影响发现(图4(a)):溶液pH值在4.5~9.5范围内变化时,ZnS∶Mn量子点/MTX复合体系的RTP强度随着溶液pH值的增大而增大。溶液pH值在6.0~7.5之间时,体系RTP强度相对保持稳定。考虑到体系用于生物体液分析的便捷性,我们选择pH=7.4为最佳的pH条件。通过反应时间对体系稳定性的影响发现(图4(b)):量子点溶液中加入MTX后,在后续的40 min基本无明显变化。就盐浓度对体系的稳定性影响而言(图4(c)),NaCl浓度在0~0.05 mol·L-1范围内时,体系RTP的强度基本保持稳定。
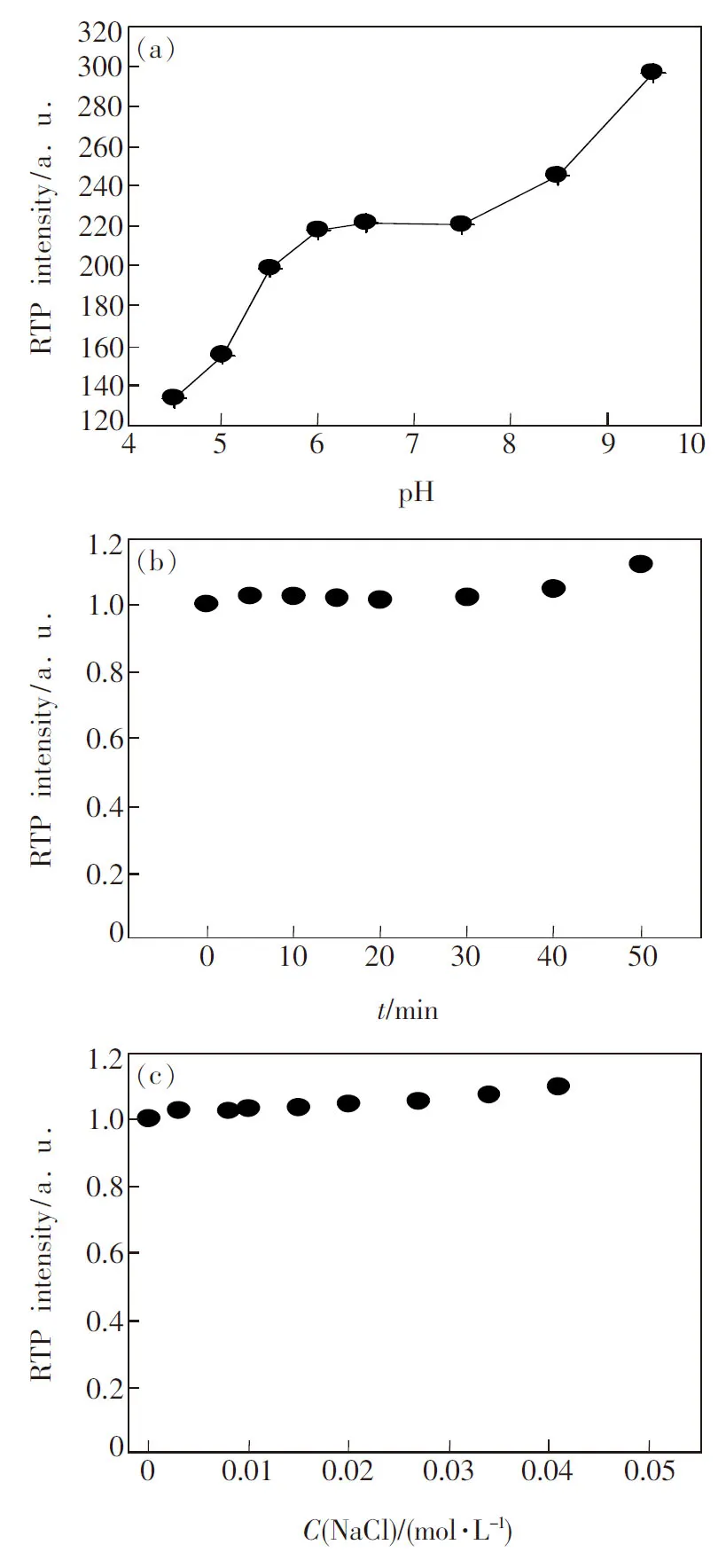
图4 pH值(a)、时间(b)和离子浓度(c)对ZnS∶Mn量子点/MTX纳米复合材料RTP强度的影响。
Fig.4 Effect of pH value(a), reaction time(b), and NaCl concentration(c) on the RTP intensity of MPA-capped ZnS∶Mn QDs/MTX composite system, respectively.
3.4 基于ZnS∶Mn量子点/MTX复合体系的DNA检测探针
图5(a)为向MPA包覆的ZnS∶Mn量子点/MTX复合体系中加入不同浓度的DNA后的发射光谱。 体系的RTP强度随DNA浓度的增加而逐渐恢复,表明Mn掺杂ZnS量子点/MTX复合体系可以作为测定DNA的RTP探针。但在单纯的MPA包覆的Mn掺杂ZnS量子点溶液中加入不同浓度( 0~20 mg·L-1)的DNA, ZnS∶Mn量子点的RTP强度基本保持不变(图5(b)),说明MPA包覆的ZnS∶Mn量子点不与DNA发生作用。MTX作为一种抗癌药物可与DNA发生有效的相互作用。通过共振光散射(RLS)分析证实,单纯的DNA与MTX的RLS均较弱,但二者混合后(图5(c)),保持MTX浓度不变,体系的RLS强度随着DNA浓度的增加而增大,表明二者的相互作用可形成更大的散射粒子。图5(d)为样品的紫外-可见吸收光谱。当ZnS∶Mn量子点中加入MTX后,其紫外吸收增强并出现红移现象。当ZnS∶Mn量子点/MTX纳米复合材料中加入DNA后,其紫外吸收进一步增强并红移。DNA加入后,能在ZnS∶Mn量子点/MTX纳米复合材料表面竞争结合MTX,使得MTX从量子点表面脱附后与DNA结合,通过嵌入作用形成了DNA和MTX的新复合物,从而致使紫外吸收光谱有较大变化。由以上结果可知,MTX与Mn掺杂ZnS量子点之间、DNA与Mn掺杂ZnS量子点/MTX纳米复合材料之间都存在着相互作用。

图5 (a) MPA包覆的ZnS∶Mn量子点/MTX复合体系中加入不同浓度的DNA后的发射光谱;(b) 纯MPA包覆的ZnS∶Mn量子点溶液中加入不同浓度的DNA后的RTP强度;(c) MPA包覆的ZnS∶Mn量子点/MTX复合体系中加入不同浓度的DNA后的共振光散射光谱;(d) 样品的紫外-可见吸收光谱。
Fig.5 (a) DNA concentration-dependent RTP emission of MPA-capped ZnS∶Mn QDs/MTX hybrids. The concentration of DNA(from a to h) is 0.4, 1, 2, 4, 8, 12, 16, 20 mg·L-1. (b) RTP intensity of pure MPA-capped ZnS∶Mn QDsvs. the concentration of DNA. (c) DNA concentration dependent RLS of MTX. The concentration of DNA is 0(a), 1(b), 2(c) mg·L-1. (d) UV-Vis absorption spectra of MTX(a), MPA-capped ZnS∶Mn QDs (b), MPA-capped ZnS∶Mn QDs/MTX nanohybrids(c), and MPA-capped ZnS∶Mn QDs/MTX + DNA(d), respectively.
3.5 MTX与DNA的作用机理
图6(a)为MTX和DNA结合后的吸收光谱,由图可知,随着DNA浓度的加大,MTX在245 nm处的紫外吸收峰逐渐降低,同时有红移现象产生[32]。由于醌类药物吸收光谱红移现象的产生是醌类药物结合插入到DNA的重要依据,因此以上结果表明MTX的醌环平面插入到了DNA结构的碱基对之间,进而结合在一起。

图6 (a) MTX 与 DNA相互作用的紫外-可见吸收光谱;(b) MTX 与 DNA相互作用的荧光光谱。
Fig.6 (a) Absorption spectra of MTX in the presence of various concentrations of DNA. The concentration of DNA (from a to d): 0, 1, 10, 20 mg·L-1. (b)Fluorescence spectra of MTX in the presence of various concentrations of DNA. The concentration of DNA (from a to h): 0, 1, 2, 4, 8, 10, 12, 20 mg·L-1.
MTX自身带有较强的荧光,如图6(b)所示,随着DNA浓度的加大,MTX的荧光强度呈下降趋势,这种现象可能是由于MTX的醌环平面插入到DNA结构的碱基对之间形成氢键所致[33]。
研究MTX和DNA作用机制的重要依据是二者相互作用后引起DNA结构的变化。以上结果表明:MTX与DNA之间作用既存在静电作用,又存在作用很强的插入作用,但ZnS∶Mn量子点是依靠静电作用和MTX吸附在一起,因此,ZnS∶Mn量子点和MTX之间的作用力小于MTX和DNA之间的作用力,致使DNA能使MTX从Mn掺杂ZnS量子点/MTX纳米复合材料表面脱附,并使 Mn掺杂ZnS量子点的RTP恢复。
3.6 Mn掺杂ZnS量子点/MTX复合体系对DNA的检测
在最佳实验条件下,我们进一步建立了DNA浓度与Mn掺杂ZnS量子点/MTX复合体系RTP强度之间的线性响应关系,如图7所示。当DNA浓度在0.1~20 mg·L-1范围内时,DNA浓度与复合体系MPA包覆的ZnS∶Mn量子点的RTP强度的改变(ΔIRTP)之间呈良好的线性响应关系,线性方程为ΔIRTP=8.3019C(DNA)-0.6492 (R= 0.993),该方法的检出限(3σ)为0.07 mg·L-1,不含DNA和含0.5 mg·L-1DNA体系的RTP强度差值连续11次平行测定的相对标准偏差为3.8%。
该方法可以避免检测时自体荧光和散射光的干扰,同时不需要加入任何除氧剂和诱导剂,避免了复杂的样品预处理过程,所以ZnS∶Mn量子点/MTX纳米复合物对DNA的检测体系具有更强的优越性。
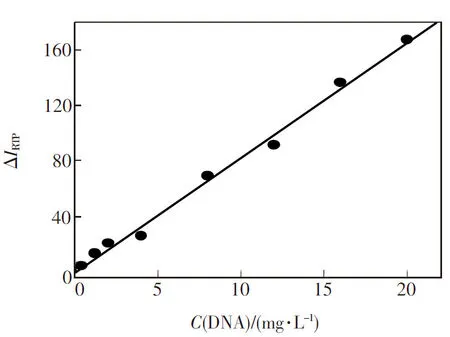
图7 ZnS∶Mn量子点/MTX复合体系测定DNA的标准曲线
Fig.7 Plots of ΔIRTPas a function of DNA concentration. Buffer: 20 mmol·L-1PBS (pH=7.4); MPA-capped ZnS∶Mn QDs: 20 mg·L-1. MTX: 4 μmol·L-1.
3.7 Mn掺杂ZnS量子点/MTX复合体系的选择性
生物体液中一些常见离子和生物分子对检测体系的干扰考察显示(表1):在DNA浓度为5 mg·L-1的条件下,0.5倍的Ca2+、50倍的K+、80倍的Na+、0.6倍的Mg2+、10倍的HAS、15倍的葡萄糖、15倍的L-组氨酸(L-His)、15倍的L-甘氨酸(L-Gly)、8倍的L-半胱氨酸(L-Cys)对DNA的检测无明显干扰,但高浓度Na+会对检测体系有一定干扰。由于该体系测定DNA的检出限仅为0.07 mg·L-1,远远低于生物样品中的DNA的含量,所以生物样品稀释后仍然可以测定出DNA,Na+及其他潜在因素的干扰可以通过对生物样品的稀释而规避。
表1 生物体液中常见物质对DNA 检测的干扰
Tab.1 Effect of co-existing substances on the RTP intensity of 5 mg·L-1DNA

Co-existingsubstancesC(co-existingsubstance)/C(DNA)ΔIRTP/%Ca2+0.5-2.8K+50-3.6Na+80+4.5Mg2+0.6+3.4HSA10+2.9Glucose15-2.1L-His15+3.8L-Gly15+1.6L-Cys8+4.8
3.8 实际样品分析
为进一步验证MPA包覆的Mn掺杂ZnS量子点/MTX用于实际样品中DNA痕量测定的可行性,我们进行了人血清和尿液中加标回收实验,结果如表2所示,加标回收率在96%~107% 之间。因此,所建立的体系在实际样品的检测中具有实用性。
表2 加标回收实验结果
Tab.2 Recovery for the detection of DNA in real samples (Means±s,n=3)
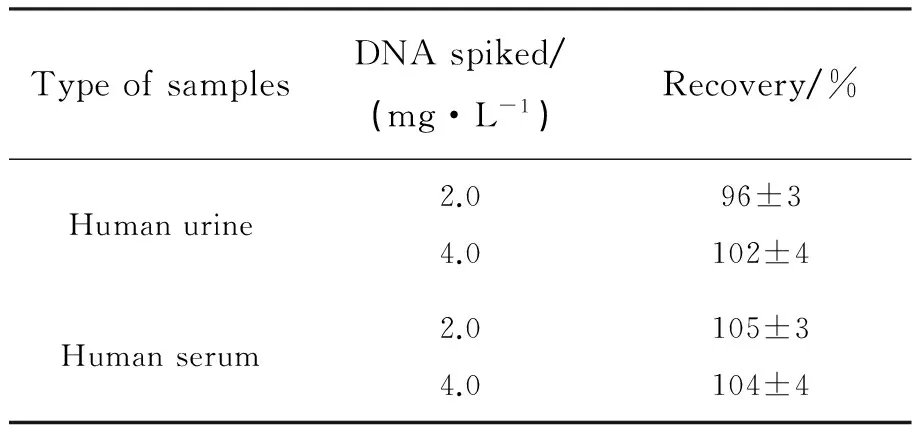
TypeofsamplesDNAspiked/(mg·L-1)Recovery/%Humanurine2.04.096±3102±4Humanserum2.04.0105±3104±4
4 结 论
基于PIET机理,通过MPA包覆的Mn掺杂ZnS量子点与MTX构建了一种痕量检测DNA的RTP复合体系。在该体系中,MTX可通过静电作用与MPA包覆的Mn掺杂ZnS量子点形成复合物,并通过PIET作用猝灭Mn掺杂ZnS量子点的RTP。该体系加入DNA后,由于DNA可与MTX形成更稳定复合物,使MTX从Mn掺杂ZnS量子点脱离,MTX与Mn掺杂ZnS量之间的PIET过程受阻,所以Mn掺杂ZnS量子点的RTP恢复。该方法检测DNA的线性范围为0.1~20 mg·L-1,最低检出限为0.07 mg·L-1,并可用于生物体液中DNA的检测。该方法一方面是以磷光量子点作为光学基质,可有效避免生物体液中背景荧光和散射光的干扰,同时不需要加入任何除氧剂和诱导剂,避免了复杂的样品预处理过程;另一方面以MTX作为DNA的特异识别体,有效地增加了检测过程的选择性。
[1] HUANG H, ZHU J. DNA aptamer-based QDs electrochemiluminescence biosensor for the detection of thrombin [J].Biosens.Bioelectron., 2009, 25(4):927-930.
[2] SONG Y, LI Y, LIU Z P,etal.. A novel ultrasensitive carboxymethyl chitosan-quantum dot-based fluorescence “turn on-off” nanosensor for lysozyme detection [J].Biosens.Bioelectron., 2014, 61:9-13.
[3] HAO Y, LIN L, LONG Y,etal.. Sensitive photoluminescent detection of Cu2+in real samples using CdS quantum dots in combination with a Cu2+-reducing reaction [J].Biosens.Bioelectron., 2012, 41(6):723-729.
[4] GILL R, ZAYATS M, WILLNER I. Semiconductor quantum dots for bioanalysis [J].Angew.Chem.Int.Ed.Engl., 2008, 47(40):7602-7625.
[5] MICHALET X, PINAUD F F, BENTOLILA L A.etal.. Quantum dots for live cells,invivoimaging, and diagnostics [J].Science, 2005, 307(5709):538-544.
[6] ZRAZHEVSKIY P, SENA M, GAO X. Designing multifunctional quantum dots for bioimaging, detection, and drug delivery [J].Chem.Soc.Rev., 2010, 39(11):4326-4354.
[7] SMITH A M, NIE S. Semiconductor nanocrystals: structure, properties, and band gap engineering [J].AccChem.Res., 2010, 43:190-200.
[8] WANG H F, WU Y Y, YAN X P. Room-temperature phosphorescent discrimination of catechol from resorcinol and hydroquinone based on sodium tripolyphosphate capped Mn-doped ZnS quantum dots [J].Anal.Chem., 2012, 85(3):1920-1925.
[9] LEI T, CONG H, PENG R,etal.. Development of hybrid organic-inorganic surface imprinted Mn-doped ZnS QDs and their application as a sensing material for target proteins [J].Biosens.Bioelectron., 2014, 61(6):506-511.
[10] SOTELO-GONZALEZ E, COSTA-FERNANDEZ J M, SANZ-MEDEl A. Mn-doped ZnS quantum dots for the determination of acetone by phosphorescence attenuation [J].Anal.Chim.Acta, 2012, 712(2):120-126.
[11] WANG Y, ZOU W. 3-Aminopropyltriethoxysilane-functionalized manganese doped ZnS quantum dots for room-temperature phosphorescence sensing ultratrace 2,4,6-trinitrotoluene in aqueous solution [J].Talanta, 2011, 85(1):469-475.
[12] MIAO Y, ZHANG Z, YAN G,etal.. Self-assembly of manganese doped zinc sulfide quantum dots/CTAB nanohybrids for detection of rutin [J].Biosens.Bioelectron., 2013, 52(2):271-276.
[13] MIAO Y, ZHANG Z, YAN G,etal.. Phosphorescent quantum dots/doxorubicin nanohybrids based on photoinduced electron transfer for detection of DNA [J].Biosens.Bioelectron., 2014, 59(13):300-306.
[14] FENG Y, LIU L, HU S,etal.. Efficient fluorescence energy transfer system between fluorescein isothiocyanate and CdTe quantum dots for the detection of silver ions [J].J.Lumin., 2015, DOI: 10.1002/bio.2967.
[15] WANG X, SHENG P, ZHOU L,etal.. Fluorescence immunoassay of octachlorostyrene based on Förster resonance energy transfer between CdTe quantum dots and rhodamine B.[J].Biosens.Bioelectron., 2014, 60:52-56.
[16] TANG G, DU L, SU X. Detection of melamine based on the fluorescence resonance energy transfer between CdTe QDs and Rhodamine B [J].FoodChem., 2013, 141(4):4060-4065.
[17] STANISAVLJEVIC M, KRIZKOVA S, VACULOVICOVA M,etal.. Quantum dots-fluorescence resonance energy transfer-based nanosensors and their application [J].Biosens.Bioelectron., 2015, 74:562-574.
[18] WANG B, WANG Q, MA M,etal.. The inhibition of fluorescence resonance energy transfer between multicolor quantum dots for rapid and sensitive detection of Staphylococcus aureus [J].Spectrochim.ActaPart A, 2015, 135:428-434.
[19] HE Y, WANG H F, YAN X P. Self-assembly of Mn-doped ZnS quantum dots/octa(3-aminopropyl) octasilsequioxane octahydrochloride nanohybrids for optosensing DNA [J].Chemistry, 2009, 15(22):5436-5440.
[20] WANG H F, HE Y, JI T R,etal.. Surface molecular imprinting on Mn-doped ZnS quantum dots for room-temperature phosphorescence optosensing of pentachlorophenol in water [J].Anal.Chem., 2009, 81(4):1615-1621.
[21] TRAVIESA-ALVAREZ J M, SANCHEZ-BARRAGAN I, COSTA-FERNANDEZ J M,etal.. Room temperature phosphorescence optosensing of benzo[a]pyrene in water using halogenated molecularly imprinted polymers [J].Analyst, 2007, 132(3):218-223.
[22] ROSI N L, GILJOHANN D A, C SHAD T,etal.. Oligonucleotide-modified gold nanoparticles for intracellular gene regulation [J].Science, 2006, 312(5776):1027-1030.

[24] LI Y, CHEN J, ZHU C,etal.. Preparation and application of cysteine-capped ZnS nanoparticles as fluorescence probe in the determination of nucleic acids [J].Spectrochim.ActaPart A , 2004, 60(8-9):1719-1724.
[25] SUN W, LI Y, GAO H,etal.. Direct electrochemistry of double stranded DNA on ionic liquid modified carbon paste electrode [J].MicrochimicaActa, 2009, 165(3-4):313-317.
[26] LIU J, XIN W, LUN W. A novel spectrofluorimetric method for the determination of DNA [J].Spectrochim.ActaPart A, 2006, 63(1):32-35.
[27] VELASQUEZ W S, DANIKA L, GROGAN T M,etal.. Combination of fludarabine and mitoxantrone in untreated stages III and IV low-grade lymphoma: S9501 [J].J.Clinic.Oncol., 2003, 21(10):1996-2010.
[28] AGARWAL S, JANGIR D K, MEHROTRA R. Spectroscopic studies of the effects of anticancer drug mitoxantrone interaction with calf-thymus DNA [J].J.Photochem.Photobiol. B, 2013, 120(5):177-182.
[29] SHENKENBERG T D, HOFF D D V. Mitoxantrone: a new anticancer drug with significant clinical activity [J].Ann.Intern.Med., 1986, 105(1):67-81.
[30] ZHUANG J, ZHANG X, WANG G,etal.. Synthesis of water-soluble ZnS∶Mn2+nanocrystals by using mercaptopropionic acid as stabilizer [J].J.Mater.Chem., 2003, 13(7):1853-1857.
[31] PENG W, YU H, HE-FANG W,etal.. Conjugation of glucose oxidase onto Mn-doped ZnS quantum dots for phosphorescent sensing of glucose in biological fluids [J].Anal.Chem., 2010, 82(4):1427-1433.
[32] KAPUSCINSKI J, DARZYNKIEWICZ Z, TRAGANOS F,etal.. Interactions of a new antitumor agent, 1,4-dihydroxy-5,8-bis[[2-[(2-hydroxyethyl)amino]-ethyl]amino]-9,10-anthracenedione, with nucleic acids [J].Biochem.Pharmacol., 1981, 30(3):231-240.
[33] CHAIRES J B, DATTAGUPTA N, CROTHERS D M. Studies on interaction of anthracycline antibiotics and deoxyribonucleic acid: Equilibrium binding studies on the interaction of daunomycin with deoxyribonucleic acid [J].Biochemistry, 1982, 17:3933-3940.

司芳瑞(1988-),女,山西临汾人,硕士研究生,2011年于山西师范大学获得学士学位,主要从事分子化学的研究。
E-mail: 137997253@qq.com

苗艳明(1982-),男,山西长治人,博士,2015年于山西师范大学获得博士学位,主要从事生态学及分子化学等方面的研究。
E-mail: mym8207@126.com

闫桂琴(1956-),女,山西临猗人,教授,博士生导师,2001年于西北大学获得博士学位,主要从事植物分子生物学及生物分子化学等方面的研究。
E-mail: gqyan2012@126.com
Detection of DNA Based on Manganese-doped ZnS Quantum Dots/MTX Composite System
SI Fang-rui, MIAO Yan-ming*, YANG Mao-qing, YAN Gui-qin*
(ColledgeofLifeScience,ShanxiNormalUniversity,Linfen041000,China)*CorrespondingAuthors,E-mail:mym8207@126.com;gqyan2012@126.com
A simple phosphorescent compound system for DNA detection was established by utilizing Mn (covered with 3-hydracrylicacid (MPA)) doped with ZnS quantum dots and mitoxantrone. By taking MTX as good electron acceptor, the room temperature phosphorescence (RTP) of Mn-doped ZnS quantum dots were quenched through photoinduced electron transfer principle. After the addition of DNA in system, DNA and MTX were combined through static electricity and intercalation, and a more stable compound was formed as well, which enable MTX removing from the surface of Mn-doped ZnS quantum dots and achieving RTP recovery of Mn-doped ZnS quantum dots. Thus, the trace detection of DNA was realized. The linear scope of this system for DNA detection and the detection limit is 0.1-20 mg·L-1and 0.07 mg·L-1, respectively. This method can effectively avoid the interference from other coexisting substances, which can be used in rapid detection of DNA content in practical biological sample.
quantum dots; phosphorescence; detection; DNA; mitoxantrone
1000-7032(2016)01-0013-09
2015-10-11;
2015-11-13
O482.31
A
10.3788/fgxb20163701.0013
