关于粒细胞集落刺激因子治疗肝衰竭的临床与机制研究
2016-02-05胡瑾华
胡瑾华
关于粒细胞集落刺激因子治疗肝衰竭的临床与机制研究
胡瑾华
肝衰竭的临床内科救治缺乏特效用药,近期报道称粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)能有效治疗酒精性肝炎和乙型肝炎(乙肝)肝衰竭,提高患者生存率。相关治疗机制研究显示G-CSF能动员骨髓造血干细胞(hematopoietic stem cells, HSCs)。其中,HSCs一方面直接分化为肝细胞;另一方面HSCs可能通过旁分泌方式改变肝脏微环境,强化内源性肝卵圆细胞反应性增生,启动内源性修复程序参与肝组织修复。G-CSF还可能通过抑制肝细胞凋亡/坏死及免疫调节,起到保护肝脏的作用。有必要开展多中心随机对照研究观察G-CSF治疗肝衰竭疗效及安全性的临床试验,为G-CSF推广应用提供高级别的循证医学依据。
肝功能衰竭;粒细胞集落刺激因子;细胞凋亡;免疫调节;治疗; 临床研究
肝衰竭是我国临床常见的严重肝病症候群,肝细胞大面积凋亡/坏死是肝衰竭共同的病理特征。该病因缺乏特效治疗方法,病死率极高。肝移植仍是目前肝衰竭最有效的治疗手段,但肝源短缺,费用昂贵,大部分患者仍得不到有效的救治,因此寻找有效的内科治疗措施仍然是必要和紧迫的。近年来,有关粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)动物实验及治疗肝衰竭临床应用的报道越来越多地受到关注,并成为肝衰竭临床及相关基础研究的热点之一[1-3]。本文对G-CSF的临床及基础研究综述如下。
1 G-CSF对肝衰竭动物模型以及肝衰竭患者的疗效
1.1 G-CSF治疗肝衰竭动物模型 G-CSF是一种具有广泛生物学效应的造血源性生长因子。国内外多个研究小组通过部分肝切除、硫代乙酰胺(thioacetamide, TAA)、四氯化碳等因素所致的小鼠肝衰竭模型动物实验研究发现:G-CSF可以促进肝细胞再生,改善肝组织病变和提高肝衰竭模型动物生存率[1-2]。采用脂多糖(lipopolysaccharide, LPS)/半乳糖胺(LPS/D-GalN)所致的肝衰竭小鼠模型进行实验,观察到G-CSF治疗组模型小鼠24 h生存率由15%提高到40%,血清ALT水平降低和肝组织损伤减轻。
1.2 G-CSF对肝衰竭患者的治疗 2003年以来的多篇个案报道叙述了G-CSF被尝试用于临床治疗肝硬化失代偿及慢性肝衰竭患者,治疗结果显示安全有效,但并未引起重视[5-7]。2012年Garg等[3]报道,临床随机对照应用G-CSF治疗酒精性慢加急性肝衰竭为主的一组患者,获得显著疗效。我们课题组在“G-CSF治疗乙型肝炎(乙肝)慢加急性肝衰竭临床试验研究”中,临床初步观察结果显示G-CSF能显著提高中晚期乙肝肝衰竭患者的生存率[4]。2014年亚太肝病研究协会发布的《慢加急性肝衰竭共识》中指出:G-CSF治疗慢加急性肝衰竭是一项具有前景的治疗方法[8]。以此为标志,关于G-CSF治疗肝衰竭的临床疗效及安全性受到了高度认可。2014年Singh 等[9]报道,应用G-CSF治疗重症酒精性肝炎疗效显著。2015年Chavez-Tapia等[10]所做的Meta分析表明应用G-CSF能够提高慢加急性肝衰竭患者的短期生存率。
2 G-CSF治疗肝衰竭作用机制
G-CSF作为一种临床常用药,长期用于治疗粒细胞缺乏和骨髓移植后促进骨髓增生等,疗效及安全性非常确切。目前G-CSF用于肝衰竭治疗,是治疗适应证的扩展,通俗地说是“老药新用”。虽然临床观察到G-CSF临床治疗肝衰竭的前景,但进一步扩展使用仍需要坚实理论基础支持,也就是说我们必须尽可能地了解G-CSF治疗肝衰竭的作用机制。
2.1 动员骨髓干细胞,促进肝组织修复 以往的研究认为G-CSF可以动员骨髓造血干细胞(hematopoietic stem cells, HSCs),通过基质细胞衍生因子-1(stromal-cell-derived factor-1, SDF-1)的调节作用归巢进入损伤肝脏,G-CSF会明显减少SDF-1在骨髓中的表达,但同时上调在受损肝脏中的表达水平,于是就构成了骨髓与肝脏之间SDF-1的浓度差别,这种化学驱动力促使HSCs和前体细胞进入肝脏[11]。而当减弱趋化因子受体-4与SDF-1之间的敏感性或下调相关的黏附分子后,G-CSF诱导的HSCs定植活动将受到严重阻滞[12]。Yannaki 等[13]对Ki-67和sry双重染色后显示:G-CSF治疗后的肝组织内增殖成分主要是肝脏原位的细胞(Ki-67+/sry-),而只有少部分是Ki-67+/sry+的HSCs来源细胞。因此认为G-CSF能动员并吸引HSCs定植于损伤肝脏。一方面HSCs可直接分化为肝细胞参与组织修复;另一方面HSCs可能通过旁分泌方式提供某些因子或信号,改变肝脏微环境,刺激并强化内源性肝卵圆细胞(肝干细胞)的反应性增生,启动内源性修复程序[14-15]。这一机制已被广泛接受,也是G-CSF治疗肝衰竭的重要理论基础。
2.2 免疫调节 G-CSF本身作为一个免疫活性因子,在治疗肝衰竭时所起的作用也成为近期的研究热点之一。G-CSF能抑制LPS对Kupffer细胞的激活作用,显著减弱LPS诱导的炎症反应,同时观察到促炎因子TNF-α的增加幅度减弱,而抑炎因子IL-6的活性却比对照组有明显地提高[16]。Sarin SK等[8]报道经G-CSF治疗的慢加急性肝衰竭患者,外周血和肝内树突状细胞显著增加,而分泌IFN-γ的CD8+T 细胞减少。IFN-γ减少对减轻肝损害起到了重要作用。相关证据提示G-CSF的免疫调节作用总体表现为免疫下调或免疫平衡,因此它可能通过免疫调节,减少炎症介质在肝衰竭发病过程中造成的免疫损伤[18-20]。目前,免疫调节机制还未阐明,在G-CSF治疗肝衰竭中的作用和地位有待进一步深入研究。
2.3 调节细胞凋亡关键蛋白,抑制肝细胞凋亡/坏死 在G-CSF治疗肝衰竭的临床观察中,本研究发现有相当一部分肝衰竭患者在G-CSF治疗1周内出现肝功能生化指标的显著改善[21]。不论是HSCs直接分化,还是刺激肝干细胞增殖修复,都需要一个较长的过程,无法解释肝衰竭患者对G-CSF治疗的快速反应。国外研究G-CSF治疗心肌梗死时发现G-CSF能作用于心肌细胞的G-CSF受体,通过B细胞淋巴瘤因子2 (B-cell lymphoma 2, Bcl-2)途径起到抑制坏死/凋亡,直接保护心肌细胞作用[22]。因为肝衰竭组织病理表现为大块/亚大块细胞凋亡,凋亡样坏死或坏死样凋亡是肝衰竭的共同病理特征,那么G-CSF是否可能直接作用于肝细胞,通过调控凋亡路径相关蛋白的表达,抑制肝细胞凋亡/坏死,达到保护肝细胞并改善肝衰竭预后。本课题组首先利用富含G-CSF受体的人胎肝细胞,构建半乳糖胺肝损伤细胞模型,体外实验结果显示G-CSF具有保护人胎肝细胞的作用,同时观察到经G-CSF处理的人胎肝细胞内蛋白激酶B、细胞外信号调节激酶磷酸化水平显著升高。研究结果提示G-CSF可能通过调控凋亡/坏死关键蛋白(如Akt、ERK等),抑制肝细胞凋亡/坏死,达到保护肝细胞作用(图1)。我们还观察到损伤肝组织内肝细胞G-CSF受体表达显著增加,经G-CSF治疗肝衰竭小鼠模型组的肝组织凋亡/坏死显著减少,这些为G-CSF抑制肝细胞凋亡,保护肝组织的作用机制提供了重要证据。阐明这一机制将是一个理论创新,可以为G-CSF治疗肝衰竭提供新的理论依据。本课题组将部分结果发表,希望引起关注,使更多的研究者能参与,并进一步深入研究。
3 展 望
关于G-CSF治疗肝衰竭,不管是临床治疗还是机制研究,目前还存在诸多问题,正如《慢加急性肝衰竭共识》所指出的G-CSF治疗肝衰竭有必要进行更多的相关临床及机制研究,特别是多中心的临床研究,以提供更高级别的循证医学依据[8]。以往报道的G-CSF治疗剂量、疗程和用法各不同,如何优化,须要进一步临床研究。亟待回答的临床问题有:①G-CSF治疗对感染并发症的影响如何,特别是治疗期间粒细胞显著增加,在临床上是否影响对感染的观察;②G-CSF治疗的最佳时机;③G-CSF疗效有哪些影响因素以及远期疗效,特别是远期安全性等。本课题组的临床观察显示G-CSF仍然只能对部分患者疗效显著[4],提示可以通过现代科学手段,例如从基因多态性进行分析筛选出合适G-CSF治疗患者群,实现精准治疗。
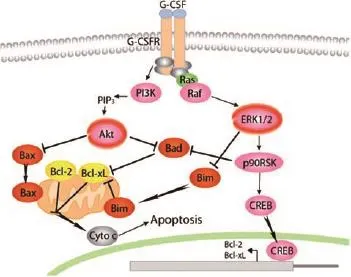
图1 G-CSF调控细胞凋亡/坏死关键蛋白抑制肝细胞凋亡/坏死分子路径示意图注:G-CSF通过与细胞表面G-CSF受体结合,调控Akt,ERK等蛋白表达,进一步调控细胞凋亡/坏死通路相关蛋白(Bax,Bad等),抑制受损肝细胞调亡/坏死Figure 1 G-CSF modulates molecular pathway of apoptosis/necrosis in the liver cell
明确G-CSF治疗肝衰竭机制有利于指导临床用药。研究机制应紧紧围绕临床相关问题进行,例如G-CSF提高了肝衰竭患者粒细胞水平,但功能是否改善,更多的粒细胞是否增加损伤肝组织内的浸润;G-CSF造成微环境变化的利与弊;G-CSF刺激免疫细胞发生变化对肝脏局部及全身的影响;G-CSF对治疗不同病因引起的肝衰竭的疗效及机制是否不同等。
总之,随着对G-CSF治疗肝衰竭研究的不断深入,近期有望在G-CSF治疗肝衰竭临床研究及相关基础研究上形成突破,为亚太及我国肝衰竭诊治共识及指南修订提供新的循证医学依据和理论基础。
[1] Cho KA, Lim GW, Joo SY, et al. Transplantation of bone marrow cells reduces CCl4 -induced liver fibrosis in mice[J]. Liver Int, 2011, 31(7):932-939.
[2] 徐旭雯,谭德明,鲁猛厚. 粒细胞集落刺激因子对小鼠急性肝衰竭的保护作用[J]. 中南大学学报(医学版),2006,31(4):543-547.
[3] Garg V, Garg H, Khan A, et al. Granulocyte colony-stimulating factor mobilizes CD34(+) cells and improves survival of patients with acute-on-chronic liver failure[J]. Gastroenterology, 2012, 142(3):505-512.
[4] Duan XZ, Liu FF, Tong JJ, et al. Granulocyte-colony stimulating factor therapy improves survival in patients with hepatitis B virus-associated acute-on-chronic liver failure[J]. World J Gastroenterol, 2013, 19(7):1104-1110.
[5] Theocharis SE, Papadimitriou LJ, Retsou ZP, et al. Eration in animal model of fulminant hepatic failure and encephalopathy[J]. Dig Dis Sci, 2003, 48(9):1797-1803.
[6] Di Campli C, Zocco MA, Saulnier N, et al.Safety and efficacy profile of G-CSF therapy in patients with acute on chronic liver failure[J]. Dig Liver Dis, 2007, 39(12):1071-1076.
[7] Yannaki E, Athanasiou E, Xagorari A, et al. G-CSF-primed hematopoietic stem cells or G-CSF per se accelerate recovery and improve survival after liver injury, predominantly by promoting endogenous repair programs[J]. ExpHematol, 2005, 33(1):108-119.
[8] Sarin SK, Kedarisetty CK, Abbas Z, et al. The Asian Pacific Association for the study of the liver (APASL) 2014[J].Hepatol Int, 2014, 8(4):453-471.
[9] Singh V, Sharma AK, Narasimhan RL, et al. Granulocyte colonystimulating factor in severe alcoholic hepatitis: a randomized pilot study[J]. Am J Gastroenterol, 2014, 109(9):1417-1423.
[10] Chavez-Tapia NC, Mendiola-Pastrana I, Ornelas-Arroyo VJ, et al. Granulocyte-colony stimulating factor for acute-on-chronic liver failure: systematic review and meta-analysis[J]. Ann Hepatol, 2015, 14(5):631-641.
[11] Lei Y, Liu Z, Han Q, et al. G-CSF enhanced SDF-1 gradient between bone marrow and liver associated with mobilization of peripheral blood CD34+cells in rats with acute liver failure[J]. Dig Dis Sci, 2010, 55(2):285-291.
[12] Petit I, Szyper-Kravitz M, Nagler A, et al. G-CSF induces stem cell mobilization by decreasing bone marrow SDF-1 and up-regulating CXCR4[J]. Nat Immunol, 2002, 3(7):687-694.
[13] Yannaki E, Athanasiou E, Xagorari A, et al. G-CSF-primed hematopoietic stem cells or G-CSF per se accelerate recovery and improve survival after liver injury, predominantly by promoting endogenous repair programs[J]. ExpHematol, 2005, 33(1):108-119.
[14] Piscaglia AC, Shupe TD, Oh SH, et al. Granulocyte-colony stimulating factor promotes liver repair and induces oval cell migration and proliferation in rats[J]. Gastroenterology, 2007, 133(2):619-631.
[15] Hsu LW, Nakano T, Huang KT, et al. Prolonged survival by combined treatment with granulocyte colony-stimulating factor and dipeptidyl peptidase IV inhibitor in a rat small-for-size liver transplantation model[J]. Hepatol Res, 2015, 45(7):804-813.
[16] Vollmar B, Messner S, Wanner GA, et al. Immunomodulatory action of G-CSF in a rat model of endotoxin-induced liver injury: an intravital microscopic analysis of Kupffer cell and leukocyte response[J]. J Leukoc Biol, 1997, 62(6):710-708.
[17] Khanam A, Trehanpati N, Garg V, et al. Altered frequencies of dendritic cells and IFN-gamma-secreting T cells with granulocyte colony-stimulating factor (G-CSF) therapy in acute-on- chronic liver failure[J]. Liver Int, 2014, 34(4):505-513.
[18] 杨昊臻,郑楠楠,胡瑾华,等. 重组人粒细胞集落刺激因子的免疫调节作用及其在肝衰竭中的应用[J]. 中华肝脏病杂志,2013,21(9):718-720.
[19] Rutella S, Zavala F, Danese S, et al. Granulocyte colonystimulating factor: a novel mediator of T cell tolerance[J]. J Immunol, 2005, 175(11):7085-7091.
[20] Zhang C, Xu YG, Duan XN, et al. Role of granulocyte colonystimulating factor in paclitaxel-induced intestinal barrier breakdown and bacterial translocation in rats[J]. Chin Med J (Engl), 2011, 124(12):1870-1875.
[21] 许祥,刘晓燕,陈婧,等. 粒细胞集落刺激因子治疗乙型肝炎相关慢加急性肝衰竭随机对照临床研究[J]. 传染病信息,2016,29(5):279-283.
[22] 胡瑾华. 肝衰竭肝细胞凋亡和膨胀性坏死分子机制研究进展[J]. 传染病信息,2008,21(2):74-77.
(2016-11-15 收稿 2016-12-10 修回)
(责任编委 李 军 本文编辑 胡 玫)
Study on the mechanism of granulocyte colony-stimulating factor in the treatment of liver failure
HU Jin-hua*
Liver Failure Treatment and Reaserch Center, 302 Military Hospital of China, Beijing 100039, China
The clinical medical treatment of liver failure is lack of effects of drugs. Recent reports of granulocyte colonystimulating factor (G-CSF) can be effective in the treatment of liver failure induced by alcoholic hepatitis and hepatitis B virus (HBV), and improve the survival rate of patients. The study of related therapeutic mechanism showed that G-CSF could mobilize bone marrow hematopoietic stem cells (HSCs). Among them, on one hand, HSCs is directly differentiated into hepatocytes; on the other hand, HSCs may change the microenvironment of the liver by paracrine secretion, enhance endogenous hepatic oval cells proliferation and initiate endogenous repair procedures involved in liver tissue repair. G-CSF may also play a role in protecting the liver by inhibiting apoptosis / necrosis and regulating immune. At the same time, it is necessary to carry out a multicenter randomized controlled clinical trial of the therapeutic effects and safety of G-CSF for the treatment of liver failure, and to provide a high level basis of evidence-based medicine for the application of G-CSF.
liver failure; G-CSF; apoptosis; immune regulation; therapies; investigational
R392.114
A
1007-8134(2016)06-0375-03
10.3969/j.issn.1007-8134.2016.06.014
首都特色临床应用研究课题 (Z131107002213157)
100039 北京,解放军第三〇二医院肝衰竭竭诊疗与研究中心(胡瑾华)
胡瑾华,E-mail: hjh@medmail.com.cn
*Corresponding author, E-mail: hjh@medmail.com.cn
