HIV-1基因变异与耐药之间的关系研究现况
2016-02-05徐亚文李健健董兴齐
徐亚文,李健健,董兴齐
HIV-1基因变异与耐药之间的关系研究现况
徐亚文,李健健,董兴齐
HIV-1以其高突变率、高重组率和高复制率的生物学特性,使得患者体内的病毒成为复杂的准种,给艾滋病的诊断、治疗和疫苗的研制带来众多难题。高效抗逆转录病毒联合疗法的使用降低了艾滋病患者的病死率,然而在高速复制、高度遗传变异和药物选择压力的作用下,日益严重的耐药问题削弱了其抑制病毒复制的作用,降低了抗病毒治疗的效果。本文综述了HIV-1常见的基因变异特点与耐药之间关系的研究进展,以期对临床制订抗HIV-1药物方案、发展新的抗HIV-1策略带来指导意义。
HIV-1;基因变异;耐药
HIV是艾滋病的病原体。至今,全球的HIV感染者已超过6000万。截至2015年5月底,我国报告现存活的艾滋病感染者和患者已达561 807例,死亡173 180万例[1]。虽然,近十年艾滋病流行呈下降趋势,特别是包括美国、加拿大和智利等国可能已经消除了HIV的母婴传播,但是艾滋病依旧是影响全球健康的重大公共卫生问题之一。HIV可以分为HIV-1型和HIV-2型两类,全球流行的主要为HIV-1型,HIV-2型流行于非洲的局部地区。HIV-1型也是我国主要的流行毒株,本文就HIV-1基因变异的特点及其与耐药之间的关系研究现状综述如下。
1 HIV-1基因的分子特性及其高度变异的生物学特性
1.1 HIV-1基因的分子特性 HIV-1属于RNA逆转录病毒科中的慢性病毒亚科,其成熟的病毒粒子含2个基因组,每个基因组全长约9.8 kb,包括3个结构基因、6个调节基因和两侧长末端重复序列(long terminal repeat, LTR)。HIV-1的基因排列为LTR-gag-pol-vif-vpr-tat-rev-vpu-env-nef-LTR,其中vif、vpr、tat、rev、vpu、nef为调节基因,pol基因编码病毒复制所需要的蛋白酶(p31、p51、p66),gag和env基因分别编码病毒的核心蛋白(p17、p24、p55)和病毒包膜蛋白(gp41、gp120、gp160)[2-3]。HIV-1基因组具有高度的变异性,其变异包括核苷酸的替换(转换和颠换)、缺失、插入和重组等,且变异具有不均一性。
1.2 HIV-1高度变异的生物学特性 HIV-1是具有高突变率、高重组率和高复制率的逆转录病毒。逆转录病毒的共同特征是病毒RNA基因组要逆转录为DNA分子。HIV有2条相同的正链RNA在5´端通过氢键互相连接在一起形成二聚体,通过逆转录酶(reversetranscriptase, RT)逆转录后生成cDNA,与人体细胞基因组结合实现病毒的复制。由于HIV-1在复制过程中RT的忠实性较差,缺乏3´→5´端外切核酸的校读功能,基因转录在人体免疫或抗HIV-1药物压力下容易产生错乱导致基因突变。 HIV-1基因组由将近10 000个核苷酸组成,每天至少有104~105个子代HIV-1出现位点的突变,同时在DNA合成过程中,几乎基因组的全部区域都可能出现重组。因而在HIV-1感染的各个阶段,HIV-1的持续高速复制及复制过程中的高突变率和重组率使得患者体内的病毒成为复杂的准种[1,4],给艾滋病的诊断、治疗和疫苗的研制带来众多难题。
2 HIV-1基因变异与疾病之间的关系
2.1 HIV-1 pol基因区变异与疾病之间的关系 pol基因是HIV-1中最保守的区域,编码病毒的蛋白酶(protease, PR)、RT及整合酶(integrase, IN),是目前抗HIV治疗的主要靶点。当强大的药物压力使毒株的pol基因发生突变时,大量耐药株出现。临床试验表明由于突变,大约30%的HIV-1感染者不能有效激活抗逆转录药物的活性[5]。基因的多样性能够影响同种抗病毒药物交叉耐药的程度,导致病毒学的治疗失败,进而决定临床治疗效果、疾病进展及免疫学效应。研究表明:运用一线药物治疗失败的患者,调整使用相应类别二线药物时更有可能产生交叉耐药[6],提示一旦出现耐药问题,调整用药方案后应更加严密观察药物的有效性,及时发现交叉耐药的发生,以减缓患者疾病进程,降低病死率。另外,在抗病毒疗程方面,抗病毒治疗早期基因突变最频繁,故应注意在治疗早期对患者进行服药依从性教育及耐药监测[7]。
目前,已经确定的与艾滋病抗病毒药物耐药有关的HIV基因突变有200多个。其中RT区中与核苷类反转录酶抑制剂(nucleoside analogue reverse transcriptase inhibitors, NRTIs)耐药相关的突变包含核苷类似物的耐药相关突变、胸苷相关突变、非核苷类似物的耐药相关突变、多核苷耐药性突变和附属突变共5类50多个;与非核苷类反转录酶抑制剂(non-nucleoside analogue reverse transcriptase inhibitors, NNRTIs)耐药相关的突变包含主要的原发突变、主要的继发突变、非多态性次要突变和多态性附属突变共4类40多个。PR区中与PR抑制剂有关的突变包含主要突变、附属突变、PR裂开部位突变共3类60多个;与IN抑制剂耐药相关的IN基因突变共30多个[6,8-9]。主要突变位点与药物治疗的关系详见表1。
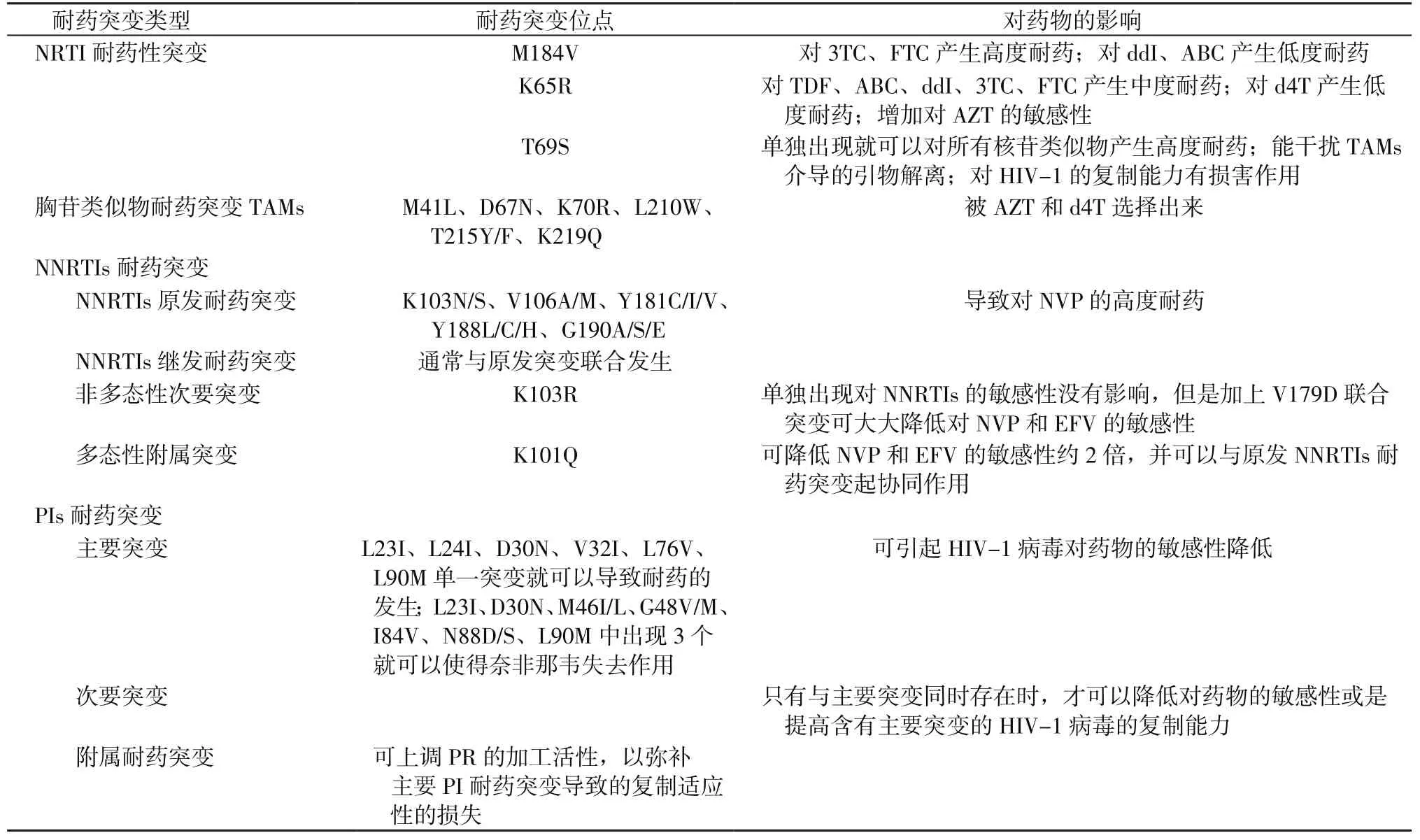
表1 主要耐药基因相关突变Table 1 The correlating mutations of main resistance genes
小部分HIV-1感染者在接受抗病毒治疗以后,在机体免疫压力和药物压力的作用下,可出现表中的突变点,导致该种类药物临床治疗失败。而大部分患者在接受治疗以后,其耐药基因却没有发生改变,这与患者的依从性以及毒株特点存在很大关系。在耐药基因检测应用于临床的实际操作中,很多位点突变要结合实验操作本身,有的突变并不是本身体内病毒发生的突变,而是在体外实验过程中的误差导致的错误突变,结果造成最终的耐药情况误差,以致于临床用药方案使用错误。因此,虽然我们已经将HIV-1耐药基因型检测应用于临床疾病,但是在实际操作过程中,还需要根据该患者的其他表征结合基因型耐药结果来判断是否应当更换药物,基因型毕竟不是表型,基因变异和表型变异之间还是存在一定差异,要灵活应用耐药基因型检测。
2.2 HIV-1 gag区变异与疾病之间的关系 gag基因编码蛋白是构成病毒颗粒的主要成分,在病毒的组装、出芽、成熟以及保持病毒的传染性和病毒结构的完整性中发挥重要的作用,在成熟HIV病毒颗粒的包装和病毒颗粒从细胞膜上的释放等环节中也非常重要。Gag蛋白上存在大量的细胞毒性T淋巴细胞(cytotoxic lymphocyte, CTL)表位,在免疫选择压力作用下gag的基因序列不断发生变异,这种变异在一定程度上反映HIV-1逃避机体免疫压力的能力及其适应度的变化[10]。近年来的一些研究分析了我国HIV-1毒株gag基因区的变异特征,但这些研究主要通过分析所获得的序列与早期共享序列在已知表位中的分布情况或根据基因内不同片段的遗传变异状况来研究gag基因的变异,而没有全面分析Gag蛋白中不同氨基酸位点的变异特征。有研究发现在Gag蛋白全长氨基酸序列中存在10个多态性增加的氨基酸位点。研究表明, 我国人群中主要的HLA-I类等位基因为HLA-A02、HLA-A11和HLA-A24;HLA-B13、HLA-B15和HLA-B40;HLA-Cw01、HLA-Cw03、HLA-Cw07和HLA-Cw06[11]。通过对Los Alamos HIV免疫数据库搜索已鉴定的CTL表位,发现其中有8个位点在我国人群主要HLA呈递的CTL表位内,这很可能是在CTL的正向选择压力作用下,病毒为逃避宿主体内的免疫压力而发生有利于病毒进化的突变。剩余第114和第376位点迄今尚无相应的CTL表位报道。因此,这2个位点是否存在仍未发现的新CTL表位有待通过免疫学实验证实。另外,该区段被广泛用于HIV-1分子流行病学和HIV-1疫苗的研究中[12]。Gag蛋白第153~172位氨基酸的位置为主要同源区,该区段对病毒样颗粒的形成至关重要,此区段的氨基酸变异将影响HIV-1的复制[13]。研究表明,HLA-B13在HIV-1感染早期可抑制病毒复制,控制病毒血症,延迟HIV-1感染后的进展,其部分作用机制是HLA-B13相关抗原表位逃逸突变如:gag-K436R、gag-I147L通过降低gag的适应度及减弱nef的免疫规避功能两种方法以降低HIV-1的产生能力[14]。
2.3 HIV-1 env区变异与疾病之间的关系 HIV-1env基因所编码的前体分子gp160经蛋白酶剪切加工后,成为成熟的外膜蛋白gp120和跨膜蛋白gp41,介导病毒入侵靶细胞。其中gp120是HIV-1基因组中变异率最高的片段,具有5个可变区(V1~V5)和5个恒定区(C1~C5),主要参与HIV-1对靶细胞的吸附及病毒从宿主细胞出芽释放的生物学过程。研究显示gp120的变异主要存在于V1~V5区,其中V3区氨基酸的改变可影响病毒与细胞的亲和性及gp120的抗原性,并与中和抗体的产生有关[15-16]。若V3环11和25位同时被精氨酸(R)和谷氨酰胺(Q)所替代,HIV-1将以CXCR4作为辅助受体进入细胞,呈T细胞嗜性,体内主要是X4单嗜性病毒;若未被同时取代,则以CCR5作为辅助受体进入细胞,呈巨噬细胞嗜性,体内主要是R5单嗜性毒株。当HIV-1为T细胞嗜性时,相对巨噬细胞嗜性会加快艾滋病病程发展,X4毒株的出现伴随感染由无症状转变为有症状,标志着进展为艾滋病症状期[17]。HIV-1 gp41分为3个结构功能区域:膜外区、跨膜区和膜内区。膜内区突变、缺失不但可能损害病毒的复制、感染和致细胞病变能力,而且可以影响gp160的加工及env的装配和稳定性,减弱env的细胞表面内化、病毒颗粒脱壳及与基质蛋白的相互作用[18]。另外,两性霉素B甲酯通过抑制病毒的进入及病毒颗粒的产生等方式减缓HIV-1复制,但是gp41膜内区发生突变后可以产生新的蛋白酶分裂位点,导致HIV-1对两性霉素B甲酯产生抗性[19]。
2.4 HIV-1其他调节基因变异与疾病之间的关系 作为HIV-1的调节蛋白之一,Vif以细胞依赖方式在新生病毒的组装、释放或者成熟阶段增加病毒自身的感染性。有研究显示Vif V7A及F39V取代可能分别与延缓和加速疾病进展有关,是独立于APOBEC3G表达水平之外影响疾病进程的病毒学因素,但尚须深入研究证实[20]。
tat通过转录反应因子与部分细胞因子作用形成蛋白-RNA复合物,活化转录启动因子,加强RNA多聚酶Ⅱ的活性,从而增强病毒的转录能力。tat的高表达促进病毒的复制,相反tat基因缺失或突变则可使病毒复制不完全。Tat区多个位置的氨基酸变异可以影响病毒的复制能力,其中50位点K被R/Q取代,41位点K被A取代,28位点K被R/Q取代,22位点C被G取代等基因突变会较大程度的损害病毒的复制能力,而65位点H被D取代,58位点T被A取代都将增强病毒的复制能力[21]。
Nef可通过加强病毒颗粒侵袭力、激活CD4+T淋巴细胞及防止受感染细胞凋亡等多种途径提高HIV的复制能力,Nef表位缺失可帮助HIV-1逃逸,影响机体针对HIV-1病毒的免疫反应[22]。故推测Nef蛋白不同位点的突变将影响HIV-1的各项生物学特性,如:病毒致病性、复制能力、免疫细胞激活、信号转导等方面,从而干预病毒与宿主间相互作用,影响HIV感染后的疾病进程。
研究显示,vpr基因参与反转录过程的保真性调节,促进整合前复合物的核运输,影响细胞周期过程,诱导细胞凋亡,并对HIV-1长末端重复序列及宿主基因具有调节作用,参与RNA剪接。HIV-1 患者有vpr R85P、Q86G、A89G或E55A变异位点较无变异位点患者而言,CD4+T淋巴细胞计数值更低,考虑此变异可能与疾病进展迅速相关[23]。
3 总结与展望
作为我国艾滋病的重灾区,云南省地处西南边陲,毗邻越南、老挝、缅甸三个艾滋病高发国家,艾滋病输入性病例较多,加之云南省抗病毒治疗推行时间早,大大增加了HIV-1基因变异及基因重组的几率,故云南省涵盖了我国几乎所有的基因突变位点及基因型。未来,须进一步做好艾滋病跨境传播的管理,动态监测HIV-1基因变异特点,准确调整抗病毒治疗方案以减少HIV传播性耐药的发生。与此同时,深入研究了解HIV-1的各个基因段变异的规律及其与宿主免疫应答的特征、产生的功能性变化,分析HIV-1变异与机体免疫系统及不同疾病状态之间的关系,才能发现新型的抗病毒药物的靶点以控制病毒的复制, 指导临床医生为患者做出更好的治疗药物选择,最大程度避免耐药发生,以降低疾病经济负担。
[1]中国疾病预防控制中心性病艾滋病预防控制中心. 2015年8月全国艾滋病性病疫情及主要防治工作进展[J]. 中国艾滋病性病,2015,21(10):835.
[2]李玉笑,杜耀民,汪传喜,等. 广州地区献血人群HIV-1 gag基因序列分析[J]. 广东医学,2012,33(7):926-928.
[3]Li X, Feng Y, Yang Y, et al. Recombinant form (CRFO1-AE/ B) detected among men who have sex with men in Jilin province, China[J]. AIDS Res Hum Retroviruses, 2014, 30(7):701-705.
[4]李彦媚,赵红心,周海卫,等. AIDS患者高效一线抗逆转录病毒治疗失败后HIV耐药基因型分析[J]. 中华实验和临床感染病杂志(电子版),2013,7(1):82-87.
[5]Hamilton CL, Eyzaguirre LM, Amarakoon II, et al. Analysis of protease and recerse transcriptase genes of HIV for antiretroviral drug resistance in Jamaican adults[J]. AIDS Res Hum Retroviruses, 2012, 28(8):923-927.
[6]杨翕然,杨翠先,杨绍敏,等. 临沧市2012年高效抗反转录病毒治疗失败的AIDS患者耐药基因变异分析[J]. 传染病信息,2014,27(3):164-166.
[7]华近. 浙江省台州地区耐药HIV-1感染的分子流行病学研究[D]. 上海:复旦大学公共卫生学院,2014.
[8]Dinesha TR, Gomathi S, Boobalan J, et al. Genotypic HIV-1 drug resistance among patients failing tenofovir-based first-line HAART in South India[J/OL]. AIDS Res Hum Retroviruses, 2016 [2016-11-14]. http://online.liebertpub.com/doi/10.1089/ aid.2016.0110.
[9]Wensing AM, Calvez V, Günthard HF, et al. 2015 update of the drug resistance mutations in HIV-1[J]. Top Antivir Med, 2015, 23(4):132-141.
[10]Song H, Pavlicek JW, Cai F, et al. Impact of immune escape mutations on HIV-1 fitness in the context of the cognate transmitted/founder genome[J]. Retrovirology, 2012 [2016-11-14]. http://retrovirology.biomedcentral.com/articl es/10.1186/1742-4690-9-89.
[11]赵稳. HIV-1抗原特异性CTL免疫应答影响因素的研究[D].广州:广州医学院,2010.
[12]Song H, Hora B, Bhattacharya T, et al. Reversion and T cell escape mutations compensate the fitness loss of a CD8+T cell escape mutant in their cognate transmitted/founder virus[J]. PLoS One, 2014, 9(7):e102734.
[13]孙冬莹,邵冰,张春蕾,等. 哈尔滨市男男同性恋HIV-1感染者gag区基因分析[J/CD]. 中华实验和临床感染病杂志(电子版),2015,9(1):14-18.
[14]Shahid A, Olvera A, Anmole G, et al. Consequences of HLAB*13-Associated escape mutations on HIV-1 replication and nef function[J]. J Virol, 2015, 89(22):11557-11571.
[15]饶嫚,蔡卫平,魏绍静,等. 广东省不同亚型AIDS病人HIV-1gp120V3环基因变异及其利用辅助受体的情况[J]. 中国艾滋病性病,2015,21(5):354-357.
[16]Edo-Matas D, Rachiger A, Setiawan LC, et al. The evolution of human immunodeficiency virus type-1(HIV-1) envelope molecular properties and coreceptor use at all stages of infection in an HIV-1 donor-recipient pair[J]. Virology, 2012, 422(1):70-80.
[17]刘婷,邵冰,李文静,等. 哈尔滨市男男同性恋HIV-1感染者env基因V3环序列分析[J/CD]. 中华实验和临床感染病杂志(电子版),2013,7(4):566-570.
[18]Shin Y, Yoon CH, Yang HJ, et al. Functional characteristics of the natural polymorphisms of HIV-1 gp41 in HIV-1 isolates from enfuvirtide-naïve Korean patients[J]. Arch Virol, 2016, 161(6):1547-1557.
[19]Waheed AA, Ablan SD, Sowder RC, et al. Effect of mutations in the human immunodeficiency virus type 1 protease on cleavage of the gp41 cytoplasmic tail[J]. J Virol, 2010, 84(6):3121-3126.
[20]Mori H, Kojima Y, Kawahata T, et al. Acluster of rapid disease progressors upon primary HIV-1 infection shared a novel variant with mutations in the p6gag/poland pol/vif genes[J]. AIDS, 2015, 29(13):1717-1719.
[21]文小宁,尚红,韩晓旭,等. HIV-AIDS患者基因变异与疾病关系的研究[J]. 中国公共卫生,2004 20(4):390-391.
[22]Meribe SC, Hasan Z, Mahiti M, et al. Association between a naturally arising polymorphism within a functional region of HIV-1 Nef and disease progression in chronic HIV-1 infection[J]. Arch Virol, 2015, 160(8):2033-2041.
[23]曹颖. HIV-1感染者vpr基因多态性及临床意义研究[D]. 北京:北京协和医院,2013.
(2016-11-08收稿 2016-12-02修回)
(责任编委 王永怡 本文编辑 赵雅琳)
Current status of relationship between gene variation and drug resistance of HIV-1
XU Ya-wen, LI Jian-jian, DONG Xing-qi*
Dali University, Dali, Yunnan 671000, China
The biological characteristics of HIV-1 such as high rate of mutation, recombination and replication make the virus become the complicated quasispecies in AIDS, which brings a lot of problems to the diagnosis, treatment even the development of the vaccine. Although the use of highly active antiretroviral therapy(HAART) has greatly reduced the mortality of AIDS, the growing problem of drug resistance has greatly weakened the role of HAART in inhibiting viral replication and the antiviral treatment effect in the result of the high-speed replication, high genetic variation and drug selection pressure. This review focuses on summarizing research progress about the features of gene variation and the relationship between the drug resistance among HIV-1, so as to guide the clinician to make anti-HIV-1 drug programs and new anti-HIV-1 strategies.
HIV-1; gene variation; drug resistance
R373.51; R962
A
1007-8134(2016)06-0350-04
10.3969/j.issn.1007-8134.2016.06.008
云南省科技计划项目(2016BC005)
671000,大理大学(徐亚文);650301 昆明,云南省传染病专科医院(李健健、董兴齐)
董兴齐,E-mail: dongxq8001@126.com
*Corresponding author, E-mail: dongxq8001@126.com
