3种荧光标记根瘤菌数量测定方法比较
2016-02-05李佳欢张佳良李东琴
李佳欢,邓 波,漫 静,张佳良,刘 静,李东琴
(1.中国农业大学动物科技学院,北京 100193; 2.吉林农业大学动物科技学院,吉林 长春 130118)
3种荧光标记根瘤菌数量测定方法比较
李佳欢1,邓 波1,漫 静1,张佳良2,刘 静1,李东琴1
(1.中国农业大学动物科技学院,北京 100193; 2.吉林农业大学动物科技学院,吉林 长春 130118)
试验以绿色荧光蛋白标记的中华苜蓿根瘤菌菌株Sm1021为试验材料,将平板涂布法、膜过滤法、流式细胞术3种微生物计数方法测得结果进行对比,以平板涂布法为基准,观察膜过滤法与流式细胞术的准确性。结果表明:利用膜过滤法测定根瘤菌数量可获得与平板涂布法相近的结果,但在操作层面上具有一定制约,且测定成本较高,只有在某些特定情况下具有应用优势;流式细胞术测定的结果与平板涂布法所得结果间存在显著的差异,但由于菌类的数量基数较大,可进行粗略的统计估算。此外,当菌液中菌量较大时,流式细胞术的准确性增加(P=0.495)。
荧光标记;平板涂布法;膜过滤法;流式细胞术;根瘤菌
豆科植物与根瘤菌共生形成的根瘤具有高效的固氮能力,所固定的氮素约占生物固氮总量的65%[1-2]。在发达国家,接种高效根瘤菌以提高豆科植物的产量已成为广泛使用的农业措施[3]。但在田间条件下,人工接种的高效根瘤菌的占瘤率很低,并不能达到预期效果[4]。接种菌在植株根际的定殖是其与植株发生共生作用的前提。研究报道,根瘤菌在植株根系的定殖数量,尤其是在根尖的定殖数量对根瘤菌的竞争结瘤能力有显著影响[5-7]。准确、快速测定根瘤菌的数量对于制定科学、合理的提高接种菌占瘤率的方法具有指导意义。
平板涂布法(spread plate method,SPM)是根瘤菌计数常用的方法[8-10]。其所需材料简单、成本较低,但操作繁琐,工作量大。显微镜直接镜检法(Direct microscope counting,DMC)利用显微镜直接对可染色微生物进行镜检计数,主要包括涂片法、琼脂薄片法、膜过滤法。此方法操作简单,试验周期较短。其中,膜过滤法相比于其他两种方法制样均匀、制片简单、无需培养,用于可被特异染色微生物的计数[7,11-12],但准确性受细胞染色质量,环境因素影响较大,使用范围受限。随着分子生物学的发展,微生物标记手段逐渐成熟,荧光蛋白标记技术得以完善,如绿色荧光蛋白(GFP)、红色荧光蛋白(RFP)等[13-14]。此类标记蛋白在适当波长的光的照射下便可发射荧光,能量消耗较小。利用荧光显微镜测定荧光标记的菌株的数量可减小镜检法的主观判断误差及染色偏差。
流式细胞术是近年来新兴的热门技术,该技术基于流式细胞仪的应用可准确快速测定生物细胞大小、数量、活性状态或其他精量指标如膜电势、胞内钙浓度等并进行细胞分选[15],具有快速、准确、信息量大等优点。流式细胞仪的许多应用是基于内置光源对荧光物质的激发而设计。带有荧光蛋白的微生物样本不需进行任何染色处理便可被高效识别分选并计数。研究结果报道,流式细胞仪可准确计数<15 μm的细胞,如网织红细胞、白细胞等[16-18]。但此类细胞体积较大,便于识别。对于细菌细胞来说,直径小,数量多,利用流式细胞仪计数的准确性有待验证。
1 材料和方法
1.1 材料
1.1.1 菌株、质粒、培养基 绿色荧光蛋白标记的Sm1021菌株(GFP-Sm1021)由中国农业大学王涛教授实验室馈赠。
根瘤菌培养基配方:YEM培养基[19],甘露醇10 g,酵母浸粉0.4 g,NaCl 0.1 g,MgSO4·7H2O 0.2 g,K2HPO40.5 g,1 000 mL水(固体培养基加15 g琼脂)。
1.1.2 试验仪器及分析软件 Millipore直径25 mm针头式过滤器,Whatman孔径0.25 μm,直径25 mm微孔滤膜, 奥林巴斯荧光显微镜BX53,流式细胞仪BD FACS Calibur,流式细胞仪获取分析软件为cellquest pro,754型分光光度计,数据分析软件为SPSS 18.0。
1.2 试验方法
在抗性平板上取GFP-Sm1021菌落接种YEM液体培养基,28℃,180 r/min振荡培养48 h为种子液。取500 μL种子液接种至含50 mL YEM液体培养基的150 mL锥形瓶中,18个重复。28℃,180 r/min振荡培养,每4 h取样1次,每次取出1瓶菌液,利用分光光度计在600 nm波长下测定吸光度,绘制GFP-Sm1021吸光度曲线。用平板涂布法、膜过滤法、流式细胞术3种方法测定每个时期样品所含根瘤菌数量,绘制GFP-Sm1021数量曲线。
平板涂布法参考文献[20]方法进行,在395 nm波长简易紫外灯下计发光菌落数量。
膜过滤法参考文献[12],取1 mL适当稀释度的菌液利用可换膜针头式滤器进行过滤,无菌水冲洗针筒内壁。用镊子小心取出湿润的滤膜平铺于载玻片上,有菌面朝上。在滤膜中央滴加1滴香柏油,盖上盖玻片。在盖玻片上滴加一滴香柏油,放在荧光显微镜下,100倍油镜下镜检。随机抽取10个视野进行荧光根瘤菌计数。注意控制菌液浓度,使每个视野内的菌的数量介于20~70。根据公式计算1 mL菌液所含根瘤菌数量。
式中:N为1mL样本菌液所含根瘤菌数量,d为滤膜直径,F为显微镜视场数,M为显微镜物镜放大倍数,n为视野内看到的根瘤菌细胞数量的平均值,k为所取菌液的稀释倍数。
流式细胞术测定:采用荧光标记后的根瘤菌为试验样品,省去荧光标记过程。将菌液调节至合适浓度,尽量保证测定过程中流式细胞仪计数小于500个/管,以提高测定精确度。
调节后的样品放入流式管中待测。流式细胞仪的使用方法参照BDFACSCalibur使用说明进行。
2 结果与分析
2.1 GFP-Sm1021的吸光度曲线
利用YEM液体培养基培养GFP-Sm1021,其在600 nm波长处的吸光度曲线呈“S”形,0~12 h吸光度增加缓慢,12 h后开始进入对数生长期,吸光度快速增加,40 h后吸光度增加速率减慢(图1)。由于菌液浓度与其吸光度在一定范围内呈现正相关关系,可根据吸光度值大致估计菌液中的根瘤菌数量。

图1 GFP-Sm1021 吸光度曲线Fig.1 Absorbance curve of GFP-Sm1021
2.2 GFP-Sm1021数量测定结果
利用平板涂布法测定根瘤菌数量,所得数量曲线如图2所示。由根瘤菌的吸光度曲线分析,在12~40 h,菌液中根瘤菌的吸光度处于对数期增长期,但通过测定根瘤菌的数量曲线可知,在20 h之后,根瘤菌菌液中的活菌增加量减少。由此,在根瘤菌生长的对数后期,由于空间、营养等因素的限制,根瘤菌的死亡量增大,总体活菌数量基本维持在稳定值。

图2 GFP-Sm1021 数量曲线Fig.2 Dynamic of the number of GFP-Sm1021
利用吸光度值可大致估计对数生长前期菌液中的根瘤菌数量,但此法并不能估算对数生长后期的活菌数量,因为对数生长后期死亡根瘤菌的数量逐渐增加多,影响菌液吸光度与活菌数量间的相关性。 目前,常用的微生物数量的测定方法为平板涂布法,试验将膜过滤法、流式细胞术测定结果与之进行对比(图2),并对平板涂布法与滤膜法、流式细胞术所测得的数据进行配对样本T检验,观察平板涂布法与膜过滤法、流式细胞术测得的数据间差异显著性(表1)。
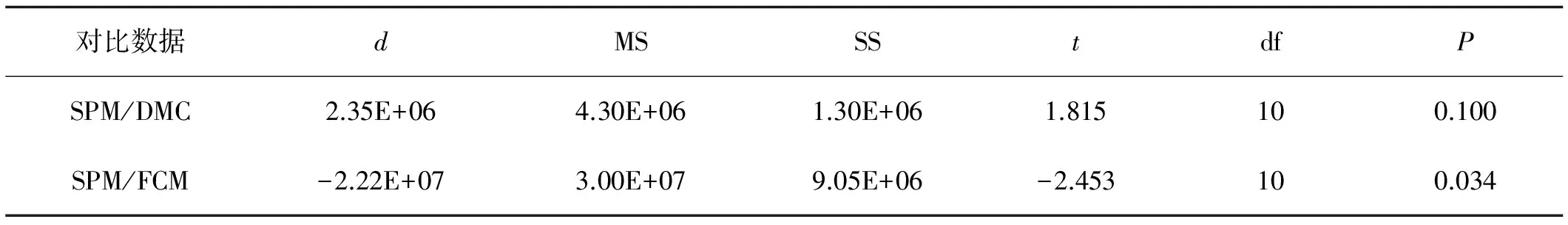
表1 3种方法测得数据间差异显著性分析
分析可知,利用微孔滤膜截留样品中的微生物,在荧光显微镜下直接镜检,测定荧光根瘤菌的数量与平板计数法间没有显著性差异,数量曲线基本重合,数值差异大多不超过平板涂布法的3%。膜过滤法可用来代替平板涂布法,进行快速的根瘤菌数量测定。但此方法仅限于可荧光染色或已进行荧光标记的菌种,有一定的局限性。此外,大量重复是膜过滤法进行的前提,以保证数据准确性。
利用流式细胞仪的分选功能,可测定并计算菌液中的菌量。在菌体荧光标记的基础上,流式细胞仪的内置光源可激发荧光,捕捉样品中的发光体。然而,流式细胞术在根瘤菌计数上的准确性鲜有报道。试验利用流式细胞仪测得的数据与平板涂布法测得的数据进行比较,发现二者测得结果间存在显著差异,尤其是在菌液浓度较低时,流式细胞术测得结果甚至可达平板涂布法的6倍以上。但在培养20 h后菌液中活菌数量增大,流式细胞术的准确性增加(P=0.495),二者间的差值大多不超过平板涂布法测得数量的20%。
3 讨论
20世纪60年代,Shimomura 等从从维多利亚多管水母中首次分离纯化出生物发光蛋白质,得到绿色荧光蛋白(GFP),并在2008年因此获得诺贝尔化学奖。随后,绿色荧光蛋白广泛应用于多种细菌、真菌、植物和哺乳动物细胞的研究[21-22]。GFP是由238个氨基酸残基组成的酸性单体球状蛋白,能够抵抗高温及性剂,分子量为27~30 kD,可在长波紫外光的照射下发射绿光。因其灵敏、稳定、无毒害、光谱等优点常用作标记物[23-24],在根瘤菌标记上的应用也较为普遍。
虽然膜过滤法已常用于微生物数量的检测,尤其是水体中大肠杆菌的测定[25],但笔者在试验过程中发现膜过滤法虽可在短时间内测定微生物的数量,但并不像部分文献中提到的简单易行,存在一定的局限性。①国产微孔滤膜与可换膜过滤器的质量标准尚不能满足此项测定,只能选用进口滤膜及滤器,造成了此方法的成本提高;②为保证计数方便和测定结果的准确性,要保证视野内细胞数量在一定的数量范围内,不能过多或过少,这就意味着对于未知浓度的样本来说,需进行多次预实验确定合适的稀释度,增加工作量与试验成本;③由于滤膜在负压过滤过程中会被压出轻微褶皱,而且在镜检的过程中需在滤膜的中央滴加香柏油以排除盖玻片与滤膜间的空气,导致微生物细胞向凹陷处的移动,干扰试验结果。基于以上原因,只有在某些特定条件下,如快速测定样品,样品中有两种以上荧光标记(便于一次性同时测出),样品中杂菌过多等,膜过滤法才具有明显优势,否则应采用平板涂布法。
随着流式细胞仪的普及,利用流式细胞术进行细胞的分选、计数已逐步应用于微生物领域。许多试验结果表明,流式细胞术在进行水体微型浮游植物[26]、酵母菌[27]、细菌[28-29]计数,检测DNA含量和细胞的倍性水平[30-31]、观测细胞凋亡[32]时均表现出较高的准确性。但在此次试验中,利用流式细胞仪测定荧光标记根瘤菌的数量时,并未获得十分准确的结果。原因有几点:①根瘤菌体积较小,仪器不能精确识别;②部分前人试验仅选取了几个样本,样本量过少或样本间的菌量差异过小,不足以代表流式细胞术计数的准确性。同时反映出应用流式细胞仪进行细菌计数时,当菌量处于某一数量级时才可达准确水平。本试验中,流式细胞仪测得的培养20 h后的样品菌量与稀释平板法相近(P=0.495)也可支持这一结论。此外,虽然在样品中根瘤菌数量较少时利用流式细胞仪测定根瘤菌数量得出的结果与稀释平板法得出的结果间存在显著差异,但由于菌类数量的数量级较高,测定的数据间差距并未达到一个数量级以上,对于某些杂菌多,不适于平板培养的样品,可利用流式细胞仪进行粗略、快速地估计,从而提高工作效率。
4 结论
膜过滤法可快速测定样品中荧光根瘤菌数量,操作过程不需严格无菌条件。但此方法成本昂贵,不易操作,仅在快速测定数据、样品中荧光标记种类较多或杂菌干扰时具有使用优势。流式细胞术测得的荧光根瘤菌的数量并不精确,但由于菌类数量的基数较大,可用来粗略估测样品中荧光根瘤菌数量。
[1] 陈文新,汪恩涛,陈文峰.根瘤菌-豆科植物共生多样性与地理环境的关系[J].中国农业科学,2004(1):81-86.
[2] 史晓霞,师尚礼,杨晶,等.豆科植物根瘤菌分类研究进展[J].草原与草坪,2006(1):12-17.
[3] Vlassak K M,P J V,Graham P H.Factors Influencing Nodule Occupancy by Inoculant Rhizobia[J].Critical Reviews in Plant Sciences,1997,16(02):163-229.
[4] Duodu S,Brophy C,Connolly J,etal.Competitiveness of a native Rhizobium leguminosarum biovar trifolii strain for nodule occupancy is manifested during infection[J].Plant and Soil,2009,318:117-126.
[5] J Brockwell,RR Gault,LJ Morthorpe,etal.Effects of soil nitrogen status and rate of inoculation on the establishment of populations of Bradyrhizobium japonicum and on the nodulation of soybeans[J].Australian Journal of Agricultural and Resource Economics,1989(40):753-762.
[6] R R Young,J Brockwell.Influence of soil pH on the development of symbiosis in field-grown acid-sensitive and acid-tolerant annual medics.Australian Journal of Experimental Agriculture[J].1992(32):167-173.
[7] McDermott T R,Graham P H.Bradyrhizobium japonicum Inoculant Mobility,Nodule Occupancy,and Acetylene Reduction in the Soybean Root System[J].1989,55(10):2493-2498.
[8] Lopez-Garcia S L,Vazquez T E,Favelukes G,etal.Rhizobial position as a main determinant in the problem of competition for nodulation in soybean.Environmental microbiology[J].2002,4(4):216-224.
[9] 张晓霞,王平,冯新梅,等.外源基因标记的紫云英根瘤菌在水稻根部的定殖研究[J].生态学报,2003(4):771-776.
[10] 王浩,绳志雅,隋新华,等.用gfp基因标记法研究大豆根瘤菌在大豆根部定殖结瘤情况[J].微生物学杂志,2006(2):1-4.
[11] 晏荣军,尹平河,林小涛.荧光显微镜细菌计数方法研究[J].海洋技术,2005(1):64-66.
[12] 赵海萍,李清雪,陶建华.海洋细菌荧光显微计数法及其应用[J].河北工程大学学报(自然科学版),2007,24(1):57-60.
[13] 陈力玉.基于三亲本杂交的荧光标记根瘤菌的构建及其稳定性检测研究[D].兰州:甘肃农业大学,2013.
[14] 陈力玉,张淑卿,李剑峰,等.接种荧光标记根瘤菌对苜蓿幼苗生长的影响[J].草原与草坪,2013(6):1-8.
[15] 谢小梅.流式细胞术[J].中国生物工程杂志,2003,23(9):100-103
[16] 邹德学,吴志成,卢丽华.采用流式细胞术对白细胞分类计数的评估[J].检验医学,2009(8):606-610.
[17] 李胜男,王秀娟,周建,等.利用流式细胞仪计数微型浮游生物的方法[J].湖泊科学,2015(5):757-766.
[18] 曹永献,姚远,张飚,等.流式细胞仪计数网织红细胞方法评价[J].检验医学,2004(3):200-202.
[19] Anolles C C,Favelukes G.Quantitation of Adsorption of Rhizobia in Low Numbers to Small Legume Roots[J].Applied and Environmental Microbiology,1986,52:371-376.
[20] 吴金水,林启美,黄巧云,等.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006:3-5.
[21] 邓超,黄大昉,宋福平.绿色荧光蛋白及其应用[J].中国生物工程杂志,2011,31(1):96-102.
[22] Chalfie M,Tu Y,Euskirchen G,etal.Green Fluorescent Protein as a Marker for Gene-Expression[J].Science,1994,263:802-804.
[23] 王洪伟.绿色荧光蛋白标记的豌豆根瘤菌的获得与功能分析[D].重庆:西南大学,2009.
[24] 吴沛桥,巴晓革,胡海,等.绿色荧光蛋白GFP的研究进展及应用[J].生物医学工程研究,2009(1):83-86.
[25] 郝江燕,胡文忠,冯叙桥,等.食品中大肠杆菌生物检测方法的研究进展[J].食品工业科技,2013(15):370-375.
[26] 徐兆安,高怡,吴东浩,等.应用流式细胞仪监测太湖藻类初探[J].中国环境监测,2012(4):69-73.
[27] 朱永泽.流式细胞术快速检测假丝酵母菌药物敏感性方法的建立及应[D].杭州:浙江大学,2014.
[28] 王宁,刘宁.流式细胞术快速检测生乳中细菌总数[J].食品工业科技,2007(9):197-200.
[29] 刘晓露.利用流式细胞仪对饮用水中细菌的快速检测[D].北京:北京林业大学,2014.
[30] 田新民,周香艳,弓娜.流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J].中国农学通报,2011(9):21-27.
[31] 柳青慕,王赟文,王小山.流式细胞仪快速检测鸭茅与多花黑麦草染色体倍性的研究[J].草业科学,2012(3):403-410.
[32] 娜仁图娜拉,闫雷,赵瑞杰,等.流式细胞术及其在细胞凋亡检测中的应用[J].中国组织工程研究与临床康复,2009(27):5353-5356.
Accuracy comparison of three methods on fluorescence labelled rhizobia counting
LI Jia-huan1,DENG Bo1,MAN Jing1,ZHANG Jia-liang2,LIU Jing1,LI Dong-qin1
(1.CollegeofAnimalScienceandTechnology,ChinaAgriculturalUniversity,Beijing,100193,China;2.CollegeofAnimalScienceandTechnology,JiLinAgriculturalUniversity,ChangChun130118,Chian)
Rhizobia strain Sm1021 marked with GFP (GFP-Sm1021) was used as an experimental strain to compare the counting accuracy of spread plate method(SPM),membrane filter method(MFM) and flow cytometry method (FCM).The results showed that the number of rhizobia counted by MFM was similar to SPM,however,MFM had some technical restrictiveness and higher experimental cost.There was a significant difference on the counted number between FCM and SPM,however,FCM can be used as a rough counting method because of the larger population of rhizobia.In addition,the accuracy of flow cytometry was better when the number of rhizobia was increased.
fluorescent mark;spread plate method;direct microscope counting;flow cytometry;rhizobia
2016-05-27;
2016-09-29
国家牧草产业技术体系(CARS-35)
李佳欢(1992-),女,内蒙古通辽人,硕士研究生。 E-mail:410243571@qq.com 邓波为通讯作者。
S 182;S 541
A
1009-5500(2016)06-0055-05
