羊口疮病毒B2L基因的原核表达、纯化及反应原性分析
2016-02-05石正旺刘华南胡永浩郑海学
石正旺,刘华南,胡永浩,郑海学
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,国家口蹄疫参考实验室,甘肃 兰州 730046)
羊口疮病毒B2L基因的原核表达、纯化及反应原性分析
石正旺1,2,刘华南2,胡永浩1,郑海学2
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,国家口蹄疫参考实验室,甘肃 兰州 730046)
【目的】 克隆和表达羊口疮病毒(ORFV)的B2L基因,进而纯化并分析其反应原性.【方法】 根据GenBank已发表的ORFV(GQ328006)的B2L基因序列设计一对特异引物,以提取阳性临床样品的总DNA为模板,通过PCR方法获得ORFV的B2L基因,将该基因片段连接至原核表达载体pET-30a(+)上,获得重组质粒pET-30a(+)-B2L.将此重组质粒转化BL21(DE3)感受态细胞,挑取单克隆进行扩大培养,经IPTG诱导获得重组融合蛋白.用SDS-PAGE和Western-blotting对表达的目的蛋白进行分析.【结果】 成功获得重组质粒pET-30a(+)-B2L,读码框正确.获得了43 ku的表达产物,与预期目的蛋白大小相符;纯化后的目的蛋白能与ORFV阳性血清发生特异反应.【结论】 成功对ORFV-B2L蛋白进行了原核表达,且纯化后蛋白具有良好的反应原性.
羊口疮病毒;B2L基因;原核表达;纯化;反应原性分析
羊口疮病毒(orf virus,ORFV)即羊传染性脓疮病毒(ecthyma contagiosum virus),是痘病毒科(Poxviridae)脊椎动物痘病毒亚科(Chordopoxvirinae)副痘病毒属(Parapoxvirus)成员[1].副痘病毒属是一类引发动物上皮组织发生病变的相关病毒,可感染绵羊、山羊、骆驼、红鹿、糜、松鼠、海豹、麝牛、羚牛和人[2-11],本属成员还有牛丘疹性口内炎病毒(bovine papular stomatitis virus,BPSV)和假牛痘病毒(pseudocowpox virus,PCPV),均呈世界范围流行,包括北美和南美,新西兰、芬兰、德国、挪威、日本、中国、意大利、英国、澳大利亚和南非一些国家,甚至南极洲[12-14].ORFV感染后动物的口、眼、鼻周围皮肤出现水泡,然后形成痂皮或者疣状病变[15],此症状一般持续3-4周,之后动物会出现伏地不起,食欲不振等症状[16],该病发病率高,但死亡率低,康复动物会出现二次感染,且极度虚弱[17].自19世纪50年代起,在我国10余省份就有相关疫情的报道,其主要流行于我国西北地区.由于其具有高度传染性,及目前高效疫苗的匮乏,该病危害严重,被OIE列为法定必报的动物传染病之一,在我国被列为I类动物传染病[14].
ORFV为双链DNA病毒,基因组长138 kb,编码132个蛋白[18],该基因组中,中心区域主要编码病毒结构蛋白,两侧区域主要编码和病毒宿主嗜性及毒力相关蛋白[19].ORFV的B2L基因编码一种囊膜蛋白,该基因在不同分离株间具有很高的同源性,因此该基因可用于病毒PCR检测方法的靶标蛋白[17],此基因全长1 137 bp,位于ORFV基因组5′端,编码产生43 ku大小的囊膜蛋白,囊膜蛋白能刺激宿主机体产生很强的中和抗体,是一种重要的免疫原性蛋白[16].本试验旨在对ORFV-B2L基因进行扩增,并构建原核表达重组载体pET-30a(+)-B2L,转化BL21(DE3)感受态细胞,进行原核表达,并对表达产物进行纯化及反应原性分析,为进一步开发ORFV诊断试剂奠定基础.
1 材料与方法
1.1 ORFV阳性病料、载体及菌株
病料和阳性血清由兰州兽医研究所王光祥助理研究员馈赠,pET-30a(+)表达载体由病毒基因工程课题组保存,E.coliBL21(DE3) 购自宝生物(大连)生物工程公司.

1.3 试验方法
1.3.1 引物的设计与合成 参照GenBank中登录的ORFV-B2L基因序列(GQ328006), 应用Primer 5.0软件设计扩增ORFV-B2L基因的引物,引物由苏州金维智生物科技公司合成,上游引物序列:5′-CGCGGATCCATGTGGCCGTTCTCCTCCATCCCCGTG-3′;下游引物序列:5′-CCG CTCGAG TTATTAATTTATTGGTTTGCAG AACTC-3′,上游引物和下游引物分别引入BamHⅠ和XhoⅠ酶切位点(下划线处为酶切位点).

1.3.3ORFV-B2L基因扩增与纯化ORFV-B2L基因的扩增体系:10×LA PCRTMBufferII 5 μL,2.5 mmol/L dNTP Mixture 8 μL,上、下游引物各1 μL,DNA模板2 μL,补加RNase Free dH2O 至50 μL.PCR扩增程序:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸80 s,共35个循环,72 ℃终延伸10 min,扩增产物用1%的琼脂糖凝胶电泳检测,并用胶回收试剂盒回收纯化PCR产物.
1.3.4ORFV-B2L基因原核表达载体的构建与鉴定 将PCR回收产物和pET-30a(+)载体均用BamHⅠ和XhoⅠ,37 ℃,酶切4 h.对双酶切产物进行纯化,分别取目的片段6 μL,载体1 μL,T4 DNA Ligase 1 μL,T4 DNA Ligase buffer 2 μL,16 ℃连接过夜,将连接产物转化至大肠杆菌DH5α感受态细胞,挑取单菌落进行培养,提取质粒,进行双酶切鉴定,将鉴定为阳性克隆送至苏州金维智生物科技公司测序.
1.3.5 重组表达菌的诱导表达 将阳性质粒转化BL21感受态细胞,涂布于Kan+(100 μg/mL)抗性的LB平板上,37 ℃过夜培养.挑取单克隆菌落,分别于5 mL Kan+抗性的LB培养基中37 ℃ 220 r/min培养,当D600值达到0.6~0.8时,保存菌液,后加入终浓度为1 mmol/L的IPTG,继续摇菌5 h.吸取箘液1 mL,12 000 r/min离心收菌,加入80 μL 8 mol/L的尿素,涡旋混匀后室温静置20 min,加入20 μL 5×loading buffer,煮沸8 min后上样8 μL,进行SDS-PAGE电泳,考马斯亮蓝染色,脱色.
2) 从左上角的第一个像素点开始,与设置的5级烧伤颜色阈值进行比较,得出该点的烧伤级别,若无烧伤则标记为0,再统计出已发生烧伤的各像素点的个数。
1.3.6 重组蛋白的可溶性分析 将阳性种子液,扩大200 mL体系培养,并在上述条件下诱导,12 000 r/min离心收取菌粒后,用裂解液悬浮,反复冻融3次,冰浴条件下超声破碎20 min(超声6 s,停8 s),离心15 min(10 000 r/min ,4 ℃),收取上清,将沉淀用与上清等量体积的PBS涡旋混匀,分别取上清与沉淀溶液80 μL,加入20 μL 5×loading buffer,煮沸8 min后上样8 μL,进行SDS-PAGE电泳,之后用考马斯亮蓝染色,脱色.
1.3.7 重组蛋白纯化 将1.3.6中收集到的沉淀悬浮液,4 ℃ 10 000 r/min离心15 min,弃去上清,按照Protein Refolding Kit说明书纯化包涵体,后取纯化产物80 μL,加入20 μL 5×loading buffer,煮沸8 min后上样8 μL,进行SDS-PAGE电泳分析.
1.3.8 重组蛋白的Western-blotting分析 将纯化后的重组蛋白进行SDS-PAGE电泳后,用半干转膜电泳仪转至硝酸纤维素膜上(15 V,25 min),5%的脱脂奶粉室温封闭2 h,用TBST洗膜3次(水平摇床,10 min/次),加入1∶500 TBS稀释ORFV感染后羊的阳性血清,摇床4℃孵育过夜,洗膜3次,加入1∶5 000 TBS稀释的辣根过氧化物酶标记的兔抗山羊IgG,摇床室温孵育2 h,洗膜3次,加入ECL显色试剂,之后进行显影.
2 结果与分析
2.1 ORFV B2L基因片段的扩增
对提取的病毒DNA进行PCR扩增,扩增产物约为1 137 bp,与预期相符(图1),说明通过PCR方法成功获得了B2L基因.
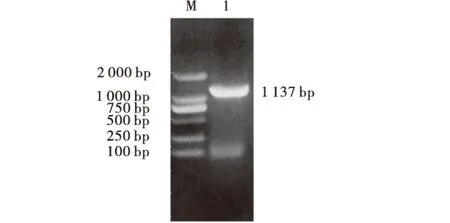
M:DNA分子量标准;1:ORFV-B2L基因扩增产物.图1 ORFV-B2L基因的PCR扩增Fig.1 PCR product for ORFV-B2L gene
2.2 重组质粒的鉴定
将构建的重组质粒pET-30a(+)-B2L经BamHⅠ和XhoⅠ双酶切鉴定得到5382 bp左右的pET-30a(+)载体和1137 bp左右大小的B2L目的条带,符合预期大小(图2),说明重组质粒构建成功.测序结果进一步表明重组质粒构建成功,且读码框正确.
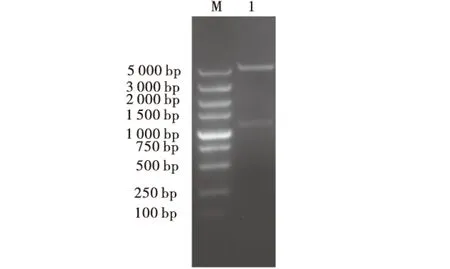
M:DNA分子质量标准;1:重组质粒的BamHⅠ和XhoⅠ双酶切产物.图2 重组质粒pET-30a(+)-B2L的双酶切鉴定Fig.2 Identification of recombinant plasmid pET-30a(+)-B2L
2.3 重组表达菌的诱导表达
用12%的聚丙烯酰胺凝胶对未诱导样品、诱导样品分别进行检测,结果表明诱导的样品在43.0 ku处有一条特异蛋白条带,与预期大小一致,未诱导样品中则无(图3).表明转化重组质粒pET-30a(+)-B2L的工程菌,经IPTG诱导后,成功地表达了重组蛋白B2L.
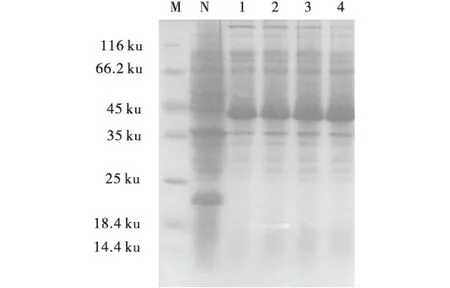
M:蛋白质分子质量标准;N:未诱导菌液样品;1-4:诱导的菌液样品.图3 His-B2L在E.coli BL21中的诱导表达分析Fig.3 The expressed protein His-B2L in the E.coli BL21(DE3) cells
2.4 重组蛋白的可溶性分析
将诱导表达的重组菌进行超声处理,离心后,分别收集上清和沉淀样品,加入loading处理后,上样SDS-PAGE进行检测,结果表明重组蛋白B2L主要以包涵体的形式存在于宿主菌中(图4).
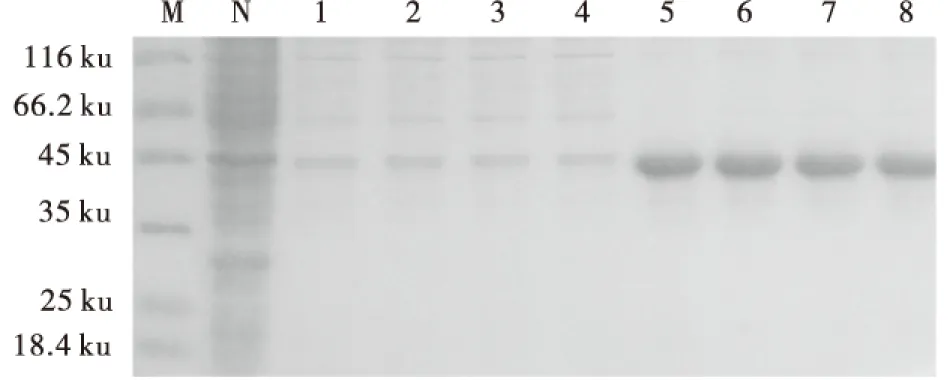
M:蛋白质分子质量标准;N:未诱导菌液样品;1-4:诱导菌液上清;5-8:诱导菌液沉淀.图4 His-B2L可溶性分析Fig.4 Solubility analysis of His-B2L
2.5 重组蛋白的纯化
将经包涵体纯化试剂盒Protein Refolding Kit 纯化后的蛋白样品进行SDS-PAGE检测,结果表明对目的蛋白纯化成功(图5),同时有部分杂带,可能是纯化过程中,IB buffer洗涤次数较少的原因.
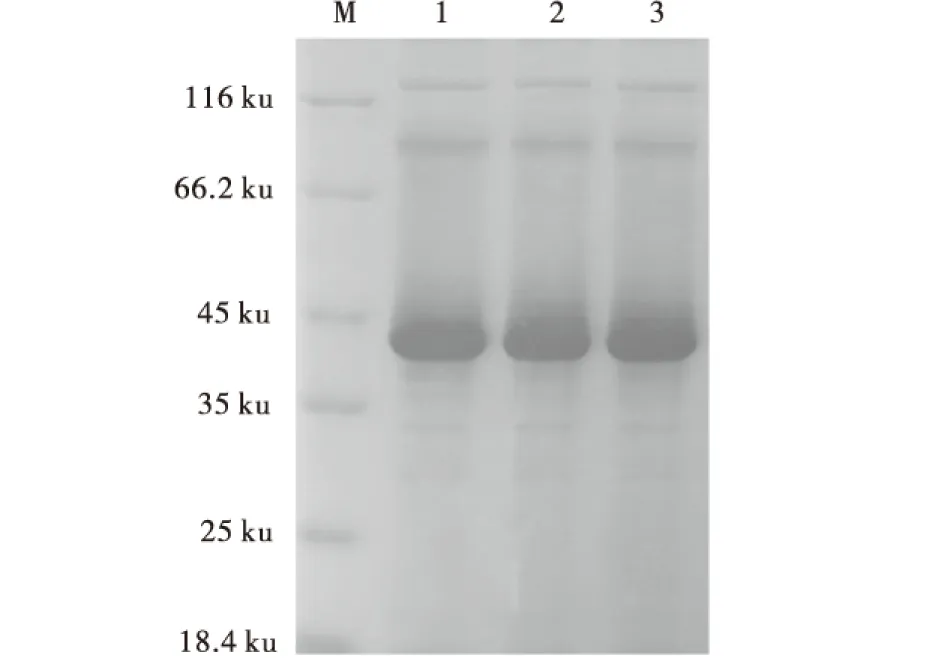
M:蛋白分子质量标准;1-3:纯化的包涵体.图5 His-B2L蛋白纯化Fig.5 The purified protein His-B2L
2.6 重组蛋白的Western-blot分析
将纯化后的重组蛋白His-B2L经Western-blot分析,发现在43.0 ku处有目的条带,表明经纯化的目的重组蛋白BL2和ORFV感染血清具有很好的反应原性(图6).
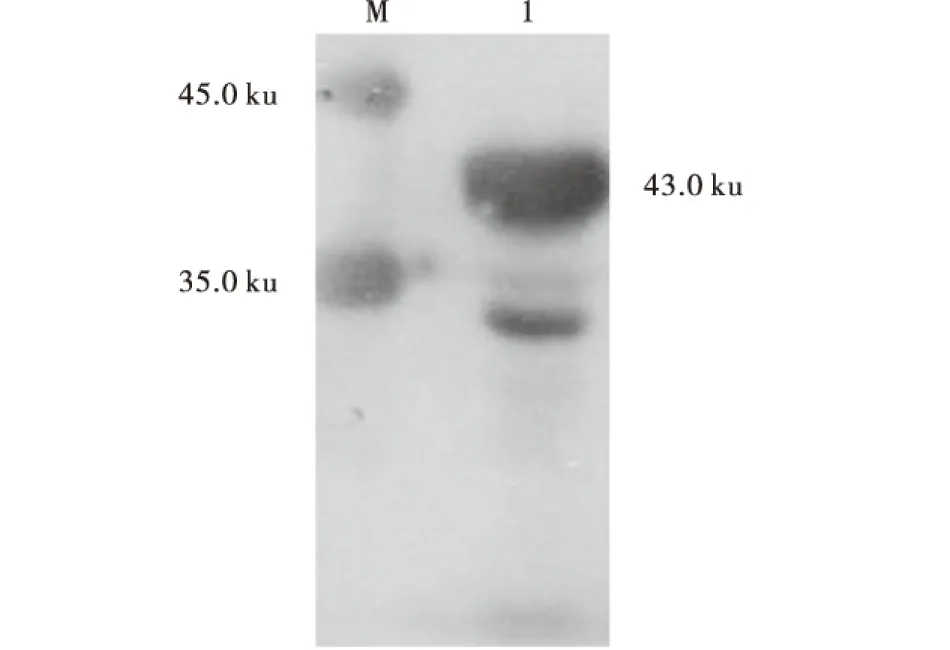
M:蛋白分子质量标准;1:纯化的His-B2L蛋白.图6 His-B2L蛋白Western-blot分析Fig.6 Western-blot analysis of the purified protein His-B2L
3 讨论
羊传染性脓疮病是一种多发于羔羊的,以患病动物的口、眼、鼻周围皮肤出现水泡,之后形成脓包,最后形成痂皮或者疣状病变为特征的接触性传染病[20],呈世界性分布,危害较为严重,近年来发病率逐年上升,是养殖业中需要重点防控的一类疾病[16].
羊口疮病毒为双链DNA病毒,基因全长134~139 kb,包含130个编码病毒结构蛋白和非结构蛋白的基因,这些基因在基因组中的功能还没有完全被研究清楚,编码病毒毒力因子的基因有OVIFNR、Vil-10和GIF等[21].B2L基因主要编码的囊膜蛋白,不同分离株间的同源性达到97%~98%[13].Gallina L等[22]在2006年首次基于ORFVB2L基因建立了一种关于ORF的real time PCR检测方法.随后,2006年Hosamani等[13]和2007年Chan等[23]基于ORFVB2L基因分别进行了毒株的鉴别和系统进化分析等工作.Abrahao J S等[24]于2012年对5株ORFV毒株基于B2L基因进行了系统进化分析工作,指出不同毒株间B2L基因在核苷酸和氨基酸水平发生了替换,常发生替换位点为009,041,079,111,126,185,196,245,249,256,267,294 和257,5株病毒的同源性为96.9%~99.9%.目前关于B2L蛋白的研究较少,其结构和功能还尚未得到深入的阐述.
在本试验中,笔者尝试优化B2L蛋白原核表达的条件,例如调节培养温度、转速、IPTG浓度,使用不同类型的培养基.经过试验发现,温度在37℃,转速220 r/min,使用营养成分较高的培养基(2×YT),有利于宿主菌的快速生长和外源蛋白表达量的增加,但在诱导5 h后,菌种生长进入平稳期,此时,延长诱导时间,已不能有效增加蛋白表达量.同时,IPTG在0.4~1 mmol/L时,随着诱导剂的增加,蛋白量呈现增加的趋势,但当诱导剂超过1 mmol/L时,已不能有效地增加蛋白表达量.本试验中,表达的B2L蛋白呈现包涵体形式,可能是受其序列本身和表达质粒的影响.在一些文献中,研究者通过降低温度、IPTG浓度、转速等条件,来控制蛋白的可溶分泌表达,但在本试验中,改变培养条件并未成功实现可溶诱导表达.在本试验中获得的包涵体B2L蛋白,具有和ORFV感染血清很好的反应原性,为进一步制备B2L相关抗体及ORFV临床诊断试剂开发奠定了基础.
[1] Haig D M,Mercer A A.Ovine diseases Orf[J].Vet Res,1998,29(3/4):311-326
[2] Kummeneje K,Krogsrud J.Contagious ecthyma (orf) in reindeer (Rangifertarandus)[J].Vet Rec,1979,105(3):60-61
[3] Dashtseren T,Solovyev B V,Varejka F,et al.Camel contagious ecthyma (Pustulardermatitis)[J].Acta Virol,1984,28(2):122-127
[4] Meechan J G,MacLeod R I.Human labial orf:a case report[J].Br Dent J,1992,173(10):343-344
[5] Khalafalla A I,Agab H,Abbas B.An outbreak of contagious ecthyma in camels (Camelusdromedarius) in eastern Sudan[J].Trop Anim Health Prod,1994,26(4):253-254
[6] Nettleton P F,Munro R,Pow I,et al.Isolation of a parapoxvirus from a grey seal (Halichoerusgrypus)[J].Vet Rec,1995,137(22):562-564
[7] Robinson A J,Mercer A A.Parapoxvirus of red deer:evidence for its inclusion as a new member in the genus parapoxvirus[J].Virology,1995,208(2):812-815
[8] Becher P,Konig M,Muller G,et al.Characterization of sealpox virus,a separate member of the parapoxviruses[J].Arch Virol,2002,147(6):1133-1140
[9] Guo J,Rasmussen J,Wunschmann A,et al.Genetic characterization of orf viruses isolated from various ruminant species of a zoo[J].Vet Microbiol,2004,99(2):81-92
[10] Tikkanen M K,McInnes C J,Mercer A A,et al.Recent isolates of parapoxvirus of Finnish reindeer (Rangifertarandus) are closely related to bovine pseudocowpox virus[J].J Gen Virol,2004,85(Pt 6):1413-1418
[11] Tryland M,Klein J,Nordoy E S,et al.Isolation and partial characterization of a parapoxvirus isolated from a skin lesion of a Weddell seal[J].Virus Res,2005,108(1/2):83-87
[12] Nandi S,De U K,Chowdhury S.Current status of contagious ecthyma or orf disease in goat and sheep-A global perspective[J].Small Ruminant Res,2011,96(2-3):73-82
[13] Hosamani M,Bhanuprakash V,Scagliarini A,et al.Comparative sequence analysis of major envelope protein gene (B2L) of Indian orf viruses isolated from sheep and goats[J].Vet Microbiol,2006,116(4):317-324
[14] Li H,Zhu X,Zheng Y,et al.Phylogenetic analysis of two Chinese orf virus isolates based on sequences of B2L and VIR genes[J].Arch Virol,2013,158(7):1477-1485
[15] Chou K C,Shen H B.Plant-mPLoc:a top-down strategy to augment the power for predicting plant protein subcellular localization[J].PLoS One,2010,5(6):e11335
[16] Schmidt C,Cargnelutti J F,Brum M C,et al.Partial sequence analysis ofB2Lgene of Brazilian orf viruses from sheep and goats[J].Vet Microbiol,2013,162(1):245-253
[17] Robinson A J.Prevalence of contagious pustular dermatitis (Orf) in six million lambs at slaughter:a three-year study[J].N Z Vet J,1983,31(9):161-163
[18] Mercer A A,Ueda N,Friederichs S M,et al.Comparative analysis of genome sequences of three isolates of Orf virus reveals unexpected sequence variation[J].Virus Res,2006,116(1-2):146-158
[19] Delhon G,Tulman E R,Afonso C L,et al.Genomes of the parapoxviruses ORF virus and bovine papular stomatitis virus[J].J Virol,2004,78(1):168-177
[20] 白刚,贾怀杰,何小兵,等.羊口疮病毒ORF129基因重组质粒的构建及其在BHK-21细胞中的表达[J].甘肃农业大学学报,2013,48(5):8-13
[21] Haig D M,McInnes C J.Immunity and counter-immunity during infection with the parapoxvirus orf virus[J].Virus Res,2002,88(1/2):3-16
[22] Gallina L,Dal Pozzo F,Mc Innes C J,et al.A real time PCR assay for the detection and quantification of orf virus[J].J Virol Methods,2006,134(1-2):140-145
[23] Chan K W,Lin J W,Lee S H,et al.Identification and phylogenetic analysis of orf virus from goats in Taiwan[J].Virus Genes,2007,35(3):705-712
[24] Abrahao J S,Borges I A,Mazur C,et al.Looking back:a genetic retrospective study of Brazilian Orf virus isolates[J].Vet Rec,2012,171(19):476
(责任编辑 胡文忠)
Prokaryotic expression,purification and reactogenicity of ORFVB2Lgene
SHI Zheng-wang1,2,LIU Hua-nan2,HU Yong-hao1,ZHEHai-xue2
(1.College of Veterinary Medicine,Gansu Agricultural University,Lanzhou 730070,China; 2.State Key Laboratory of Veterinary Etiological Biology,Foot-and-Mouth Disease Reference Laboratory,Lanzhou Veterinary Research Institute,Chinese Academy of Agricultural Science,Lanzhou 730046,China)
【Objective】 To clone and express the B2L gene of ORFV,and then purify and analyze the reactogenicity.【Method】 A pair of primer was designed according to ORFVB2Lgene reported in Gen-Bank(GQ328006),taking the DNA of this virus extracted from the pathologic materials as template and the target gene was got by PCR.After purification,the product was cloned into pET-30a(+) vector to ob-tain the recombinant plasmid pET-30a(+)-B2L.After identification,the recombinant plasmid was trans-formed into BL21(DE3) competent cells and the single colony was picked to amplify and culture.After induction with IPTG,the recombinant fusion protein was expressed.The target protein was identified by SDS-PAGE and Western blotting after purification.【Result】The results showed that theB2Lgene was successfully cloned into pET-30a(+),a protein was confirmed at position about 43 kDa by SDS-PAGE and could specifically react with ORFV positive serum identified by western-blot.【Conclusion】This ex-periment realize the prokaryotic expression of protein B2L,and the purified protein had good reactogenicity.
ORFV;B2Lgene;prokaryotic expression;purification;reactogenicity analysis
石正旺(1990-),男,硕士研究生,主要从事动物传染病的研究.E-mail:shizw2015@163.com
胡永浩,教授,主要从事预防兽医学研究.E-mail:hyy0817@126.com.cn 郑海学,研究员,主要从事兽医微生物学及其分子生物学研究.E-mail:haixuezheng@163.com
国家“863”计划项目(2011AA10A211-1);国际原子能机构项目(16025/R);国家自然科学基金项目(31500617).
2015-12-04;
2016-01-27
S 852.6
A
1003-4315(2016)06-0001-05
